Do, 08.10.2020 — Redaktion
Der Chemie-Nobelpreis 2020 ging je zur Hälfte an die französische Biologin Emmanuelle Charpentier und an die US-amerikanische Biochemikerin Jennifer Doudna. Basierend auf CRISPR-Cas, dem Verteidigungsmechanismus von Bakterien gegen Viren (Phagen) haben die Laureaten eine Genschere entwickelt, die präzise, effizient und kostengünstig jede beliebige DNA ansteuert und an einer vorbestimmten Stelle schneidet und verändert. CRISPR-Cas ermöglicht die Genome von Mikroorganismen, Pflanzen und Tieren gezielt zu verändern und hat innerhalb kürzester Zeit die biologisch/medizinischen Labors in aller Welt revolutioniert.
Wie rasant der Fortschritt in den Biowissenschaften verläuft, bislang Unvorstellbares zu etablierten, breitest angewandten Technologien werden kann, lässt sich aus einem kurzen Absatz erkennen, den der berühmte Molekularbiologe und Nobelpreisträger Jaques Monod vor 50 Jahren in seinem Buch "Zufall und Notwendigkeit" so formuliert hat:
"Die moderne molekulare Genetik bietet uns keine wie immer gearteten Mittel um auf unser Erbmaterial einzuwirken, um es mit neuen verbesserten Eigenschaften zu versehen - einen Supermenschen zu erzeugen. Ganz im Gegenteil, sie zeigt uns dass diese Hoffnung vergeblich ist: die mikroskopischen Eigenschaften des Genoms lassen heute und vermutlich auch in der Zukunft eine derartige Manipulation von Genen als unwahrscheinlich erscheinen."
Nun, die Geschichte hat Monod wiederlegt; gezielte Genveränderungen (Genom Editierung) gibt es bereits seit einem Jahrzehnt. Die von Emmanuelle Charpentier und Jennifer Doudna entwickelte CRISPR-Cas Technologie ist ein noch besseres, einfaches und kostengünstiges Verfahren, das die gesamten Biowissenschaften revolutioniert hat.
Als Emmanuelle Charpentier in einem Vortrag über "The revolution of CRISPR-Cas Genome engineering - lessons learned from bacteria" im Mai 2016 in Wien Monod's Ausspruch zitierte, war sie selbst bereits berühmt, international weitesten Kreisen bekannt und mit Auszeichnungen überhäuft. Ein Jahrzehnt zuvor hatte sie an den Max-Perutz Laboratories in Wien (und später an der Universität von Umea/Schweden) über das adaptive Immunsystem CRISPR-Cas9 gearbeitet, mit dem sich Bakterien und Archaea vor infizierenden Viren (Phagen) schützen, indem sie deren DNA zerschneiden. Dabei entdeckte sie in dem Abwehrsystem eine essentielle Komponente (die sogenannte tracrRNA), welche die zu schneidende DNA identifiziert. 2011 veröffentlichte sie diese Entdeckung.
Als Charpentier im selben Jahr auf einer Konferenz die US-amerikanische Biochemikerin Jennifer Doudna (University Berkeley),eine Expertin auf dem RNA- und Cas-Gebiet kennenlernte, startete sie mit ihr eine Zusammenarbeit. Diese führte zur Vereinfachung des CRISPR-Cas Systems und programmierte es um, sodass es nun nicht nur Viren-DNA sondern jede beliebige DNA ansteuert und präzise an einer vorbestimmten Stelle schneidet.
Die erste Publikation über diese revolutionäre Technologie im Jahr 2012 hat eine Welle der Begeisterung ausgelöst - man erkannte das ungeheure Anwendungspotential in unterschiedlichsten Disziplinen von der Synthetischen Biologie, der Humanmedizin bis hin zur Landwirtschaft. Dazu kommt, dass es eine billige Methode ist, leicht und universell anwendbar. Eine nicht abebbende Flut an Untersuchungen war die Folge: die US-amerikanische Datenbank listet über 10 000 Veröffentlichungen und jährlich kommen über 2000 hinzu.
Dass verschiedene Aspekte von CRISPR-Cas auch im ScienceBlog Thema sind, ist nur zu verständlich. Im Folgenden sind mehrere Artikel (in Form von Abstracts) angeführt: i) ein leicht verständlicher Überblick über Entstehung und Anwendungen der Methode, ii) über das Potential in der Gentherapie, iii) das Potential in der Validierung von Wirkstoffen, iv) das Potential in der Therapie der Schmetterlingskrankheit und v) über die Anwendung zur Freisetzung genetisch modifizierter Organismen.
Genom Editierung mit CRISPR-Cas9 - was ist jetzt möglich?
Christina Beck, 23.4.2020 Genom Editierung mit CRISPR-Cas9 - was ist jetzt möglich? .

![]() Bakterien haben gelernt sich gegen die sie infizierenden Viren, die sogenannten Bakteriophagen, zu schützen. Auf diesem Schutzmechanismus basiert die CRISPR-Cas9 Technik, eine einfache, billige Methode, mit der man innerhalb weniger Stunden die DNA präzise schneiden und nach Wunsch verändern kann. Die Methode funktioniert bei jedem Organismus, an dem sie ausprobiert wurde, – vom Fadenwurm über Pflanzen bis hin zum Menschen - und hat die biologisch-medizinischen Wissenschaften revolutioniert. Die Zellbiologin Christina Beck, Leiterin der Kommunikation der Max-Planck-Gesellschaft, gibt einen Überblick über Entstehung und Anwendung der Methode und spannt einen Bogen von Programmen zur Wiederbelebung bereits ausgestorbener Tiere bis zur Genchirurgie von Erbkrankheiten beim Menschen.
Bakterien haben gelernt sich gegen die sie infizierenden Viren, die sogenannten Bakteriophagen, zu schützen. Auf diesem Schutzmechanismus basiert die CRISPR-Cas9 Technik, eine einfache, billige Methode, mit der man innerhalb weniger Stunden die DNA präzise schneiden und nach Wunsch verändern kann. Die Methode funktioniert bei jedem Organismus, an dem sie ausprobiert wurde, – vom Fadenwurm über Pflanzen bis hin zum Menschen - und hat die biologisch-medizinischen Wissenschaften revolutioniert. Die Zellbiologin Christina Beck, Leiterin der Kommunikation der Max-Planck-Gesellschaft, gibt einen Überblick über Entstehung und Anwendung der Methode und spannt einen Bogen von Programmen zur Wiederbelebung bereits ausgestorbener Tiere bis zur Genchirurgie von Erbkrankheiten beim Menschen.
Was bedeutetübrigens CRISPR? Wir blicken zurück in das Jahr 1987: Bei der Untersuchung von E. coli-Bakterien stoßen japanische Mikrobiologen unter Mojica zum ersten Mal auf ungewöhnliche, sich wiederholende DNA-Sequenzen im Erbgut eines Bakteriums. Diese Sequenzen werden als Clustered Regularly Interspaced Short Palindromic Repeats – oder kurz CRISPR bezeichnet. 2005 entdeckt Mojica dass sie mit Ausschnitten aus dem Genom eines Bakteriophagen, eines für Bakterien schädlichen Virus, übereinstimmen. Erstmals äußert er die Vermutung, dass CRISPR in Bakterien die Funktion eines adaptiven Immunsystems haben könnte.
Finden und Ersetzen: Genchirurgie mittels CRISPR/Cas9 erscheint ein aussichtsreicher Weg zur Gentherapie
Francis.S.Collins, 02.02.2017: Finden und Ersetzen: Genchirurgie mittels CRISPR/Cas9 erscheint ein aussichtsreicher Weg zur Gentherapie.
Francis S. Collins 2.2.2017

![]() In der Forschung zur Gentherapie gibt es eine immerwährende Herausforderung: Es ist die Suche nach einem verlässlichen Weg, auf dem man eine intakte Kopie eines Gens sicher in relevante Zellen einschleusen kann, welches dann die Funktion eines fehlerhaften Gens übernehmen soll. Mit der aktuellen Entdeckung leistungsfähiger Instrumente der Genchirurgie ("Gene editing"), insbesondere des CRISPR-Cas9 Systems - beginnen sich nun die Chancen einer erfolgreichen Gentherapie zu vergrößern. Francis Collins, Direktor der US National Institutes of Health (NIH) und ehem. Leiter des "Human Genome Project" berichtet hier von einer zukunftsweisenden Untersuchung , die nicht nur Fortschritte in der Heilung der seltenen Erbkrankheit "septische Granulomatose" verspricht, sondern auch von vielen anderen Erbkrankheiten.
In der Forschung zur Gentherapie gibt es eine immerwährende Herausforderung: Es ist die Suche nach einem verlässlichen Weg, auf dem man eine intakte Kopie eines Gens sicher in relevante Zellen einschleusen kann, welches dann die Funktion eines fehlerhaften Gens übernehmen soll. Mit der aktuellen Entdeckung leistungsfähiger Instrumente der Genchirurgie ("Gene editing"), insbesondere des CRISPR-Cas9 Systems - beginnen sich nun die Chancen einer erfolgreichen Gentherapie zu vergrößern. Francis Collins, Direktor der US National Institutes of Health (NIH) und ehem. Leiter des "Human Genome Project" berichtet hier von einer zukunftsweisenden Untersuchung , die nicht nur Fortschritte in der Heilung der seltenen Erbkrankheit "septische Granulomatose" verspricht, sondern auch von vielen anderen Erbkrankheiten.
 Das CRISPR/Cas9 System ermöglicht Mutationen gezielt aus einem Gen zu entfernen und durch eine korrekte Version zu ersetzen. Das ursprünglich in Bakterien entdeckte Enzym Cas9 (Kristallstruktur, hellblau) kann eine DNA (gelb) an der gewünschten Stelle durchschneiden. Die präzise Positionierung der Schnittstelle wird durch ein an Cas9 gebundenes kurzes Gegenstück zur zu schneidenden DNA - einer "guide RNA" (rot) - ermöglicht. (Credit: Bang Wong, Broad Institute of Harvard and MIT, Cambridge, MA)
Das CRISPR/Cas9 System ermöglicht Mutationen gezielt aus einem Gen zu entfernen und durch eine korrekte Version zu ersetzen. Das ursprünglich in Bakterien entdeckte Enzym Cas9 (Kristallstruktur, hellblau) kann eine DNA (gelb) an der gewünschten Stelle durchschneiden. Die präzise Positionierung der Schnittstelle wird durch ein an Cas9 gebundenes kurzes Gegenstück zur zu schneidenden DNA - einer "guide RNA" (rot) - ermöglicht. (Credit: Bang Wong, Broad Institute of Harvard and MIT, Cambridge, MA)
Wenn das angepeilte Target nicht das tatsächliche Target ist - ein Grund für das klinische Scheitern von Wirkstoffen gegen Krebs
Ricki Lwis, 28.11.2019 Wenn das angepeilte Target nicht das tatsächliche Target ist - ein Grund für das klinische Scheitern von Wirkstoffen gegen Krebs

![]() Der Entwicklung neuer Arzneimittel geht die Suche nach Zielstrukturen - Targets - voraus, die essentiell in das Krankheitsgeschehen involviert sind und gegen die dann Wirkstoffe designt werden können. Der allergrößte Teil der solcherart gegen Krebserkrankungen entwickelten Stoffe scheitert aber in der klinischen Prüfung, wobei mangelnde Wirksamkeit einer der Hauptgründe ist. Eine neue Studie an einer Reihe von klinischen Entwicklungssubstanzen wendet die CRISPR-Cas Technologie nun an, um das postulierte Target zu entfernen - falls ein Wirkstoff dann immer noch wirkt, so war das angenommene Target nicht das wirkliche Target. Damit deckt die Studie auf, dass zahlreiche der postulierten Targets und damit deren Wirkungsmechanismen unrichtig sind und eine bereits in der Präklinik erfolgende Validierung der echten Targets die Zahl unwirksamer klinischer Studien reduzieren könnte. Die Genetikerin Ricki Lewis berichtet über diese Studie.
Der Entwicklung neuer Arzneimittel geht die Suche nach Zielstrukturen - Targets - voraus, die essentiell in das Krankheitsgeschehen involviert sind und gegen die dann Wirkstoffe designt werden können. Der allergrößte Teil der solcherart gegen Krebserkrankungen entwickelten Stoffe scheitert aber in der klinischen Prüfung, wobei mangelnde Wirksamkeit einer der Hauptgründe ist. Eine neue Studie an einer Reihe von klinischen Entwicklungssubstanzen wendet die CRISPR-Cas Technologie nun an, um das postulierte Target zu entfernen - falls ein Wirkstoff dann immer noch wirkt, so war das angenommene Target nicht das wirkliche Target. Damit deckt die Studie auf, dass zahlreiche der postulierten Targets und damit deren Wirkungsmechanismen unrichtig sind und eine bereits in der Präklinik erfolgende Validierung der echten Targets die Zahl unwirksamer klinischer Studien reduzieren könnte. Die Genetikerin Ricki Lewis berichtet über diese Studie.
Gentherapie - Hoffnung bei Schmetterlingskrankheit
Eva Maria Murauer, 02.03.2017: Gentherapie - Hoffnung bei Schmetterlingskrankheit.
Die Schmetterlingskrankheit - Epidermolysis bullosa (EB) - ist eine derzeit (noch) nicht heilbare, seltene Erkrankung, die durch Mutationen in Strukturproteinen der Haut hervorgerufen wird und in Folge durch eine extrem verletzliche Haut charakterisiert ist. Dr. Eva Maria Murauer vom EB-Haus Austria zeigt, dass sich derartige Mutationen in den Stammzellen von Patienten mittels Gentherapie korrigieren lassen und aus den so korrigierten Zellen Hautäquivalente produziert werden können, welche die Haut von EB-Patienten stückweise ersetzen und (langfristig) die Charakteristik einer stabilen, gesunden Haut bewahren können.
Erste Versuche zur Korrektur des Kollagen VII-Gens mittels der CRISPR Cas9 Technologie Bei dieser neuen Technologie wird kein zusätzliches Gen in die Hautzelle eingebracht, sondern die Mutation wird im defekten Gen direkt und bleibend korrigiert. Sind dominant vererbte Erkrankungen durch ein falsch funktionierendes Protein bedingt, so ist dies zweifellos gegenüber der oben beschriebenen Methode von Vorteil - es wird kein zusätzliches, fehlerhaftes Protein mehr produziert. Ein weiterer wichtiger Vorteil besteht darin, dass kein Virusvektor notwendig ist, um die Genreparatur zu bewerkstelligen und damit kein, wenn auch geringes, Risiko einer Tumorentstehung eingegangen wird.
Zur Freisetzung genetisch veränderter Organismen in die Natur
Guy Reeves, 09.05.2019: Zur Freisetzung genetisch veränderter Organismen in die Natur

![]() Das Umweltprogramm der Vereinten Nationen (UNEP) zeigt mit seinem alljährlichen Bericht „Environment Frontiers“ Herausforderungen auf, welche die natürlichen Lebensgrundlagen auf unserem Planeten künftig maßgeblich mitbestimmen werden. Im Report 2018/2019 wird fünf neu auftretenden Themen besondere Bedeutung zugemessen. Am Beginn steht die "Synthetische Biologie", in welcher das Erbgut von Organismen so verändert wird, dass für den Menschen nützliche Eigenschaften entstehen.
Das Umweltprogramm der Vereinten Nationen (UNEP) zeigt mit seinem alljährlichen Bericht „Environment Frontiers“ Herausforderungen auf, welche die natürlichen Lebensgrundlagen auf unserem Planeten künftig maßgeblich mitbestimmen werden. Im Report 2018/2019 wird fünf neu auftretenden Themen besondere Bedeutung zugemessen. Am Beginn steht die "Synthetische Biologie", in welcher das Erbgut von Organismen so verändert wird, dass für den Menschen nützliche Eigenschaften entstehen.
Dank neuer Techniken wie der Genschere Crispr/Cas9 und des sogenannten Gene Drive können Forscher das Erbgut sehr viel schneller verändern und diese Veränderungen in kurzer Zeit selbst in großen Populationen verbreiten. Im Labor werden genetisch veränderte Organismen schon seit einiger Zeit erfolgreich eingesetzt, zum Beispiel in der Grundlagenforschung oder in der Produktion von Medikamenten. Nun sollen genetisch veränderte Organismen auch in die Natur entlassen werden. Im folgenden Interview sieht Dr.Guy Reeves (Max-Planck-Institut für Evolutionsbiologie in Plön) vor allem die Freisetzung genetisch veränderter infektiöser Viren mit Sorge.
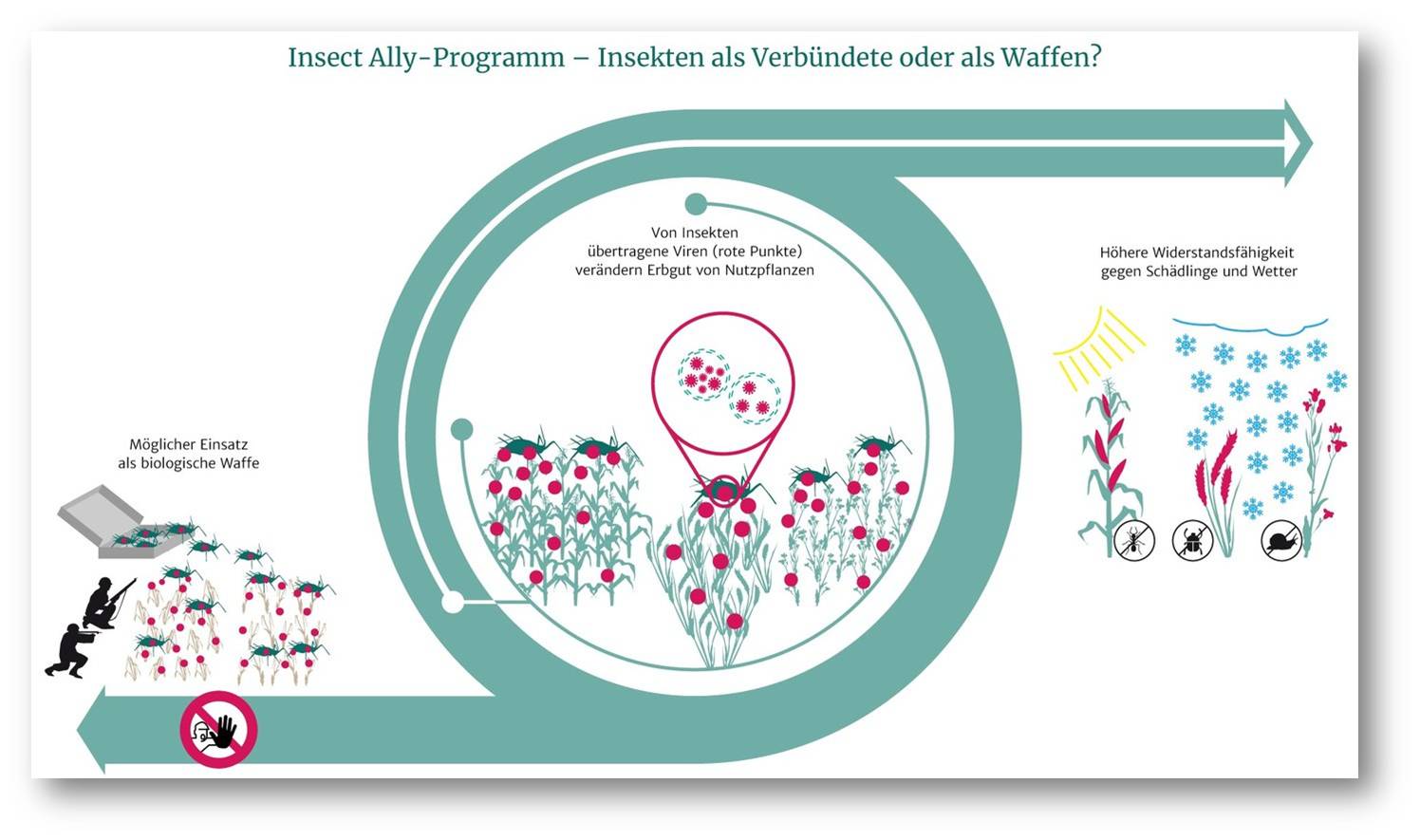 Forschungsprogramm mit Potenzial für militärischen Einsatz: Wissenschaftler befürchten, dass das US-amerikanische Programm andere Länder dazu verleiten könnte, selbst Biowaffen zu entwickeln. © MPG/ D. Duneka
Forschungsprogramm mit Potenzial für militärischen Einsatz: Wissenschaftler befürchten, dass das US-amerikanische Programm andere Länder dazu verleiten könnte, selbst Biowaffen zu entwickeln. © MPG/ D. Duneka
Weiterführende Links
- Nobelpreis in Chemie 2020: https://www.nobelprize.org/prizes/chemistry/2020/press-release/
- Scientific Background on the Nobel Prize in Chemistry 2020. A TOOL FOR GENOME EDITING. https://www.nobelprize.org/uploads/2020/10/advanced-chemistryprize2020.pdf
- Akademie der Naturwissenschaften, Schweiz: Gene Drives - Wundermittel? Biowaffe? Hype? (Fast Forward Science 2018). 6:19 min. (Quelle: https://naturwissenschaften.ch/topics/synbio/applications/gene_drive)
https://www.youtube.com/watch?time_continue=3&v=ezR3CzOi8j8
- Gen-editing mit CRISPR/Cas9 Video 3:13 min (deutsch) , Max-Planck Gesellschaft (2016) (Standard-YouTube-Lizenz )
- Printer-friendly version
- Log in to post comments


