Do, 24.12.2020 - 07:43 — Nora Schultz
Nervenzellen kommunizieren, indem sie elektrische Signale (Aktionspotentiale) auf eine lange Reise bis zu den Synapsen am Ende ihres Axons schicken – ein aufwändiger und verhältnismäßig langsamer Prozess. Mit der Hilfe der Oligodendrozyten - eine Art von Gliazellen - wird das Axon zum Super-Highway. Diese Zellen umwickeln mehrere Axone abschnittsweise, versorgen sie mit Energie und isolieren die ummantelten Stücke mit ihrer als Myelin bezeichneten Biomembran elektrisch. Innerhalb der umwickelten Abschnitte kann sich das Aktionspotential viel schneller fortpflanzen. Die Entwicklungsbiologin Nora Schultz gibt einen Überblick über den Vorgang der Myelinisierung.*
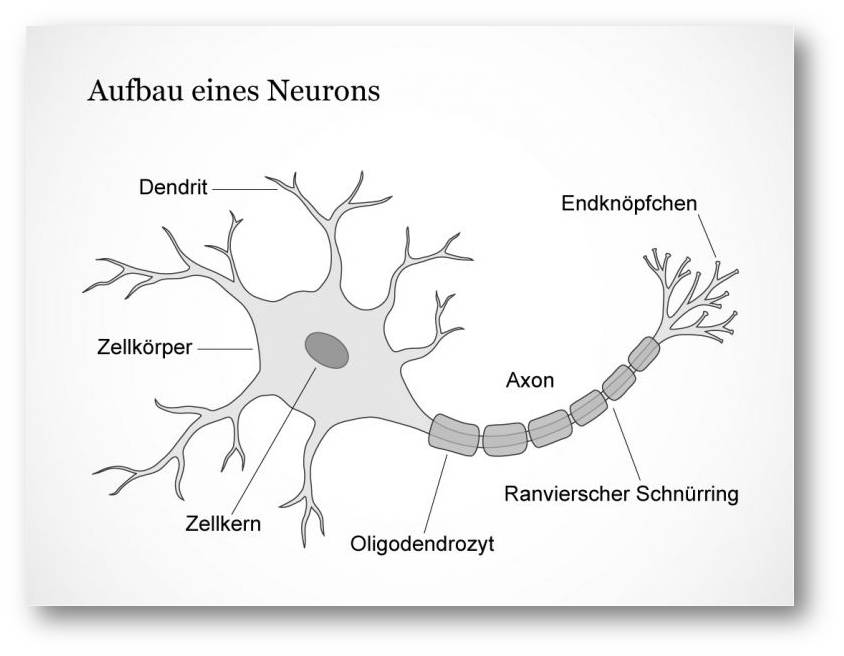
Neuronen, die „grauen Zellen“ im Gehirn, haben ihren guten Ruf als Rechenmeister zu Recht. Doch erst in weiße Gewänder gehüllt, verbringen sie auch Kommunikationswunder. Damit Nervenzellen sich mit vielen, vielen weiteren Kolleginnen austauschen können, braucht es Axone. Abbildung 1.
| Abbildung 1. Wie ein Neuron aussieht. Ein Neuron besteht aus einem Zellkörper und seinen Fortsätzen. Signal-empfangende Fortsätze nennen sich Dendriten, sendende Axone. Axone sind durch eine Myelin-Ummantelung elektrisch isoliert. (Bild: https://www.dasgehirn.info/grundlagen/kommunikation-der-zellen/bild-aufbau-eines-neurons. Lizenz: cc-by-nc) |
Über diese Datenkabel treten sie in Kontakt miteinander und knüpfen weitläufige Netzwerke. Dabei überbrücken sie Entfernungen von bis zu mehreren Metern – für den Zellkosmos eine riesige Distanz. Um das zu bewerkstelligen, benötigen Axone entweder einen beachtlichen Durchmesser oder eine gute Isolierung. Die Lösung der Wirbeltiere heißt Isolierung durch Myelin, Dabei handelt es sich um eine besonders fetthaltige und daher weiß erscheinende, elektrisch isolierende Biomembran. Sie umwickelt die Axone.
Doch wie gelangt die Myelinscheide um die Axone? Und was genau bewirkt sie dort?
Von wegen langweilige Hülle
Was auf den ersten Blick wie eine langweilige Hülle wirkt, entpuppt sich bei genauerer Betrachtung als eine spannende, dynamische und hochkomplexe Angelegenheit. Direkt nach der Geburt ist im Gehirn des Neugeborenen noch vieles grau in grau. Die Myelinisierung der Axone, der die „weiße Substanz“ im Gehirn und Rückenmark ihren Namen verdankt, beginnt zwar bereits während der Schwangerschaft, setzt sich jedoch während der Kindheit fort und wird auch in der Pubertät noch einmal stark verfeinert. Und sogar darüber hinaus findet noch Myelinisierung statt – wenn auch in weit geringerem Maße.
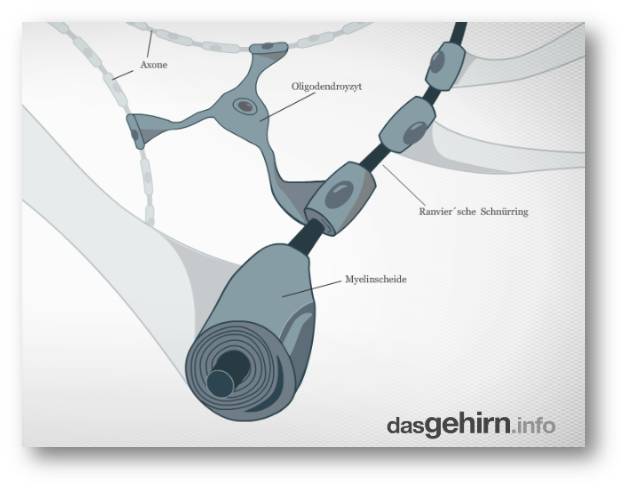
Verantwortlich für die Isolationsarbeiten sind spezialisierte Helfer, die Oligodendrozyten. Jede dieser Zellen, die zu den Gliazellen zählen, kann mehrere Axonabschnitte auf verschiedenen Axonen mit Zellausstülpungen umwickeln, wie mit einem Verband. Abbildung 2. Damit fungieren die Oligodendrozyten zusätzlich auch noch als Kabelbinder, die mehrere Axone bündeln. Außerdem versorgen sie das Axon und seine vielen energiehungrigen Ionenpumpen mit Nährstoffen.
| Abbildung 2. Isolierung der Axone per Myelin. Die Ummantelung übernehmen im Gehirn Oligodendrozyten, die auch mehrere Axone gleichzeitig umwickeln können. Die Zwischenräume werden als Ranviersche Schnürringe bezeichnet. Der Prozess der Myelinisierung kann bis zu 25 Jahre dauern. (Bild: https://www.dasgehirn.info/grundlagen/kommunikation-der-zellen/interaktiv-das-neuron-form-und-funktion. Lizenz cc-by-nc) |
Geschwindigkeitsupgrade durch Isolation
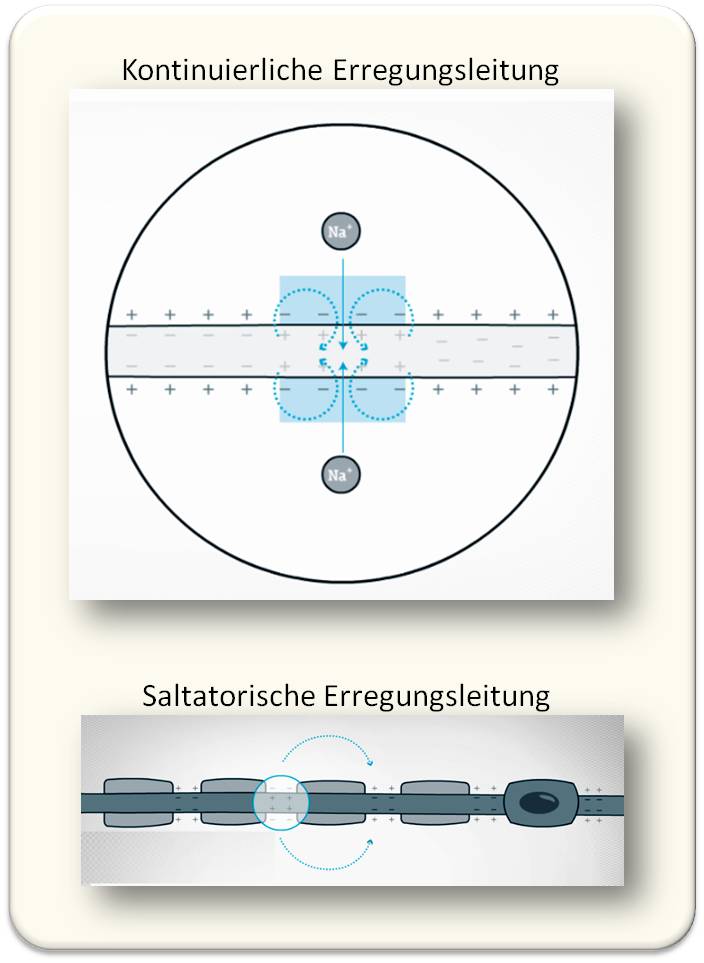
Die Myelin-Verbände verleihen den elektrischen Signalen, den Aktionspotentialen, die entlang des Axons vom Zellkörper bis zu den Synapsen am anderen Zellende reisen, ein wahrlich sprunghaftes Geschwindigkeitsupgrade. Ohne Myelin pflanzt sich ein solches Aktionspotential fort, indem es die Spannung an der Zellmembran Schritt für Schritt über die Gesamtlänge des Axons verändert. Wird ein bestimmter Schwellenwert überschritten, öffnen sich spannungsgesteuerte Membrankanäle, die schlagartig viele positiv geladene Natriumionen ins Zellinnere strömen lassen. Dadurch schnellt das Membranpotential an dieser Stelle noch weiter nach oben und schubst auch die weiter flussabwärts liegende Region über den Schwellenwert, sodass sich dort ebenfalls die spannungsgesteuerten Kanäle öffnen. Das Aktionspotential fließt so per Kettenreaktion bis zum Ende des Axons. Abbildung 3, oben.
Dieser Prozess läuft allerdings relativ langsam ab, mit einer Geschwindigkeit von rund einem Meter pro Sekunde. Wärmere Temperaturen oder ein größerer Axondurchmesser, bei dem pro Einheit Membranoberfläche mehr elektrisch leitendes Innenvolumen – und damit ein reduzierter Längswiderstand – vorhanden ist, vermögen die Reise zu beschleunigen. Manche Weichtiere wie Tintenfische und Meeresschnecken nutzen diese Strategie, um mit ganz besonders dicken Axonen von bis zu einem Millimeter Durchmesser besonders schnelle Signale zu verschicken, auch ohne Myelinisierung.
Bei Wirbeltieren und somit auch im menschlichen Gehirn hingegen sorgt das Myelin für mehr Geschwindigkeit – bei gleichzeitig großer Platzersparnis im hochkomplexen Zentralnervensystem. Es erlaubt dem elektrischen Signal vor allem, umwickelte Axonabschnitte einfach zu überspringen. Dank der Isolierwirkung kann das lokal entstandene Aktionspotential sich vergleichsweise ungestört im Inneren des Axons als elektrisches Feld fortpflanzen. Dieses reicht aus, um an der nächsten Lücke, wo die Zellmembran freiliegt, dem Ranvierschen Schürring, den Schwellenwert für die Öffnung der spannungsgesteuerten Kanäle zu erreichen. Das Aktionspotential springt nun rasend schnell von einem Ring zum nächsten und ermöglicht so eine enorme Leitgeschwindigkeit – von bis zu 100 Metern pro Sekunde. Abbildung 3, unten.
| Abbildung 3.Die Erregungsleitung - Geschwindigkeit des Aktionspotentials - im Axon. Im nicht-myelinisierten Axon (oben) pflanzt sich das elektrische Signal kontinuierlich mit einer Geschwindigkeit von 2 - 3 m/sec fort. Im myelinisierten Axon (unten) springt das Aktionspotential von einem Ranvier'schen Schnürring zum nächstenund erreicht Geschwindigkeiten bis zu 100 m/sec. ((Bild: https://www.dasgehirn.info/grundlagen/kommunikation-der-zellen/interaktiv-das-neuron-form-und-funktion. Lizenz cc-by-nc) |
Trotz der raffinierten Isolationsstrategie gilt bei der Übertragungsgeschwindigkeit: „size matters“. Sie hängt von der Dicke des Axons unter dem Myelin ab sowie seiner Dicke an den dazwischen liegenden Schnürringen. Außerdem zählen die Dicke der Myelinscheide selbst und die Länge der umwickelten Abschnitte.
Benedikt Grothe von der Ludwig-Maximilians Universität München erforscht die Signalübertragung im Hörsystem, wo es oft auf Millisekunden ankommt, um feine Unterschiede zwischen Tönen auseinanderzuhalten. In Versuchen und Modellierungen hat er herausgefunden, dass die schnellstmögliche Signalübertragung stattfindet, wenn der Axondurchmesser groß und die Myelinsegmente kurz sind . Die Höchstgeschwindigkeit hat allerdings ihren Preis, da bei vielen kurzen isolierten Segmenten auch die Zahl der Schnürringe im Verlauf der Faser steigt, an denen das Aktionspotential aktiv weiterspringen muss – ein Prozess, der viel Energie benötigt. „In der Praxis beobachten wir daher oft einen Kompromiss zwischen Schnelligkeit und den metabolischen Kosten“, sagt Grothe. “Aber wenn der Schaltkreis es verlangt, kann die Geschwindigkeit ausgereizt werden.“ Auch entlang eines einzelnen Axons können die Faktoren variieren. Zum Ende des Axons hin beobachten die Forscher etwa eine zunehmende Optimierung von Axondurchmesser und Myelinsegmentlänge ausgerichtet auf Schnelligkeit. Vermutlich dient das der Absicherung, damit das Aktionspotential die Synapse zuverlässig erreicht.
Myelinisierung als Bestandteil der Plastizität
Die Myelinschicht ist also mehr als nur Isolation. Vielmehr handelt es sich um eine sehr präzise Konfiguration von Axon und umwickelnden Oligodendrozyten. Und diese ist bei Weitem nicht starr. „Veränderungen in der Myelinisierung haben viel mit neuronaler Plastizität gemeinsam, auch wenn die Prozesse Monate statt Tage dauern“, sagt Tim Czopka, der mit seiner Arbeitsgruppe derzeit von der Technischen Universität München an die University of Edinburgh umzieht. Er untersucht mit seinem Team bei Zebrafischen, wie sich die Myelinisierung in Abhängigkeit von den Aktivitäten und Erfahrungen einzelner Nervenzellen wandelt. Auch beim Menschen lässt sich beobachten, dass sich intensive und längerfristige Lernprozesse auf die weiße Substanz im Gehirn auswirken. Lernt man beispielsweise Jonglieren oder ein neues Instrument, nimmt die weiße Substanz im manchen Regionen zu; bestimmte Schaltkreise werden verstärkt myelinisiert, um die Signalübertragung dort zu verbessern. “Die Verschaltungen zwischen Neuronen über Synapsen sind nur eine Ebene der Kommunikation innerhalb eines Netzwerks, aber damit die Impulse auch zur richtigen Zeit am richtigen Ort ankommen, muss auch die Myelinisierung angepasst werden“, so Czopka.
Ist ein Axon erst einmal vollständig umwickelt, kann es gemeinsam mit seinen Oligodendrozyten zwar noch einige Feinjustierungen vornehmen, beispielsweise seinen Durchmesser verändern oder die Länge der myelinisierten Abschnitte und die Position der Schnürringe anpassen. Andere Formen der Plastizität sind dann aber nicht mehr möglich. Axonabzweigungen etwa kann es aus seinem Korsett heraus wohl nicht mehr bilden. Czopka vermutet daher, dass die besonders spannenden Ereignisse überall dort stattfinden, wo Axonteile noch nicht – oder gerade nicht mehr – umwickelt sind. Dann gibt es viele Möglichkeiten für Neuronen und Oligodendrozyten, im Austausch miteinander und in Reaktion auf die Aktivitäten im System ihre individuelle Konfiguration zu finden.
Lernen vom Zebrafisch
Die Kommunikation beginnt damit, dass die Vorläuferzellen der Oligodendrozyten auf Partnersuche gehen. Inspiriert von bislang größtenteils unbekannten Signalen tasten die Zellen dann ihr Umfeld nach geeigneten Neuronen ab. „Sie versuchen, alles Mögliche mit Stummelfortsätzen zu umwickeln, wie kleine Spinnen“, erzählt Czopka, der diese Vorgänge in den transparenten Larven von Zebrafischen live filmt. Je nach den Signalen, die sie im Umfeld eines bestimmten Axons finden, stabilisieren sie die Fortsätze oder ziehen sie wieder zurück.
Bereits jetzt zeichnet sich ab, dass der Austausch zwischen beiden Zelltypen sehr fein aufeinander abgestimmt ist. Oligodendrozyten und ihre Vorläufer haben selbst viele Rezeptoren für Neurotransmitter und spannungsabhängige Ionenkanäle, mit denen sie der Aktivität von Neuronen „zuhören“ können. Ist eine Nervenzelle sehr aktiv, verändert sich auch die metabolische Aktivität der sie umwickelnden Oligodendrozyten: Sie teilen und differenzieren sich stärker. Die genaue Identität und Dynamik dieser Signale zu verstehen, ist eines der Forschungsziele von Czopka und seinem Team.
Hinter diesen Forschungsaktivitäten steckt auch der Wunsch, die Zusammenarbeit zwischen Neuronen und Oligodendrozyten in Zukunft wieder besser ins Lot bringen zu können, nachdem sie etwa durch Krankheit oder Verletzung gestört wurde. Bei der Multiplen Sklerose zum Beispiel greifen fehlgeleitete Immunzellen die Oligodendrozyten an und zerstören die Myelinscheide so, zumindest vorübergehend. Das gefährdet sowohl die Energieversorgung der Neuronen als auch ihre Kommunikation mit anderen Nervenzellen. Je nach Krankheitsverlauf kann sich das System jedoch wenigstens teilweise erholen und zerstörte Myelinscheiden neu bilden. Die Hoffnung ist, eines Tages durch gezieltes Eingreifen in das Entstehen und die Aktivität von Oligodendrozyten die Funktion neuronaler Netze passgenau reparieren zu können.
Zum Weiterlesen:
- Ford MC et al: Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications, 2015, 6:8073. https://www.nature.com/articles/ncomms9073
- Marisca R et al: Functionally Distinct Subgroups of Oligodendrocyte Precursor Cells Integrate Neural Activity and Execute Myelin Formation. Nat Neurosci. 2020 Mar; 23(3): 363–374. 10.1038/s41593-019-0581-2
* Der Artikel stammt von der Webseite www.dasGehirn.info, einer exzellenten Plattform mit dem Ziel "das Gehirn, seine Funktionen und seine Bedeutung für unser Fühlen, Denken und Handeln darzustellen – umfassend, verständlich, attraktiv und anschaulich in Wort, Bild und Ton." (Es ist ein Projekt der Gemeinnützigen Hertie-Stiftung und der Neurowissenschaftlichen Gesellschaft e.V. in Zusammenarbeit mit dem Zentrum für Kunst und Medientechnologie Karlsruhe). Der vorliegende Artikel ist am 1.Dezember 2020 unter dem Titel: "Highspeed dank Myelin" erschienen (https://www.dasgehirn.info/grundlagen/struktur-und-funktion/highspeed-dank-myelin). Der unter einer cc-by-nc-sa Lizenz stehende Artikel wurde unverändert in den Blog gestellt und mit einigen Abbildungen von der Webseite Neurone - Bausteine des Denkens: https://3d.dasgehirn.info/#highlight=grosshirnrinde&sidebar=1 ergänzt.
Artikel im ScienceBlog
- Nora Schultz, 11.06.2020: Von der Eizelle zur komplexen Struktur des Gehirns
- Nora Schultz, 15.12.2017: Multiple Sklerose - Krankheit der tausend Gesichter
- Nora Schultz, 19.08.2017: Pubertät – Baustelle im Kopf
- Inge Schuster, 08.12.2016: Wozu braucht unser Gehirn so viel Cholesterin?
- Susanne Donner, 08.04.2016: Mikroglia: Gesundheitswächter im Gehirn
- Printer-friendly version
- Log in to post comments