Do, 23.04.2020 — Christina Beck
 Bakterien haben gelernt sich gegen die sie infizierenden Viren, die sogenannten Bakteriophagen, zu schützen. Auf diesem Schutzmechanismus basiert die CRISPR-Cas9 Technik, eine einfache, billige Methode mit der man innerhalb weniger Stunden die DNA präzise schneiden und nach Wunsch verändern kann. Die Methode funktioniert bei jedem Organismus, an dem sie ausprobiert wurde, – vom Fadenwurm über Pflanzen bis hin zum Menschen - und hat die biologisch-medizinischen Wissenschaften revolutioniert. Die Zellbiologin Christina Beck, Leiterin der Kommunikation der Max-Planck-Gesellschaft, gibt einen Überblick über Entstehung und Anwendung der Methode und spannt einen Bogen von Programmen zur Wiederbelebung bereits ausgestorbener Tiere bis zur Genchirurgie von Erbkrankheiten beim Menschen.*
Bakterien haben gelernt sich gegen die sie infizierenden Viren, die sogenannten Bakteriophagen, zu schützen. Auf diesem Schutzmechanismus basiert die CRISPR-Cas9 Technik, eine einfache, billige Methode mit der man innerhalb weniger Stunden die DNA präzise schneiden und nach Wunsch verändern kann. Die Methode funktioniert bei jedem Organismus, an dem sie ausprobiert wurde, – vom Fadenwurm über Pflanzen bis hin zum Menschen - und hat die biologisch-medizinischen Wissenschaften revolutioniert. Die Zellbiologin Christina Beck, Leiterin der Kommunikation der Max-Planck-Gesellschaft, gibt einen Überblick über Entstehung und Anwendung der Methode und spannt einen Bogen von Programmen zur Wiederbelebung bereits ausgestorbener Tiere bis zur Genchirurgie von Erbkrankheiten beim Menschen.*
Die Fortschritte in der genomischen Biotechnologie bieten erstmals vielleicht die Möglichkeit, lang ausgestorbene Arten – oder zumindest „Ersatz“-Arten mit Merkmalen und ökologischen Funktionen ähnlich wie die der ausgestorbenen Originale – zurückzubringen.
Ein Team unter der Leitung von George Church an der Harvard University versucht, bereits ausgestorbene Mammuts wieder zum Leben zu erwecken, indem es das Erbgut seines heute noch lebenden Verwandten, des asiatischen Elefanten, Buchstabe für Buchstabe umschreibt. Abbildung 1. Das ist möglich seit Forschern der Pennsylvania State University 2008 die erste nahezu vollständige Sequenzierung des Erbguts eines ausgestorbenen Wollhaarmammuts gelungen ist und damit theoretisch der Zugriff auf die Information für alle seine Eigenschaften. Mehr als vier Milliarden DNA-Basen wurden dafür dekodiert.
| Abbildung 1. Das bereits ausgestorbene Wollhaarmammut soll wiederbelebt werden. (Bild © MPG, HN //) |
Das Mammut eignet sich wie kaum ein anderes ausgestorbenes Wirbeltier zur Analyse seines vorzeitlichen Erbguts. Denn die Fossilien der eiszeitlichen Elefanten stammen vorwiegend aus dem Permafrostboden Sibiriens, wo sie relativ gut erhalten bleiben. Der nächste lebende Verwandte des Wollhaarmammuts ist der asiatische Elefant. Nach Erbgutanalysen von Svante Pääbo und seinem Team vom Max-Planck-Institut für evolutionäre Anthropologie haben sich der asiatische Elefant und das Wollhaarmammut vor etwa 440.000 Jahren in verschiedene Arten aufgespalten. Das Genom des Wollhaarmammuts und des asiatischen Elefanten unterscheidet sich daher „nur“ um etwa 1,4 Millionen Mutationen: Ein asiatischer Elefant besteht also praktisch bereits zu 99,96 Prozent aus Wollhaarmammut.
Jurassic Park – von der Fiktion zur Realität?
Das Harvard Woolly Mammoth Revival-Team hat 2015 zunächst das Erbgut eines Wollhaarmammuts analysiert und dann von bestimmten Mammutgenen exakte Kopien künstlich hergestellt. Diese wurden erfolgreich in Fibroblasten-Zelllinien des asiatischen Elefanten eingebaut. „Wir haben vor allem Gene genommen, die etwas mit der Kälteresistenz zu tun haben – also Gene für langes Fell, kleinere Ohren, die Einlagerung von Unterhautfett und vor allem für Mammut-Hämoglobin“, erklärte George Church gegenüber den Medien. Es ist ein erster Erfolg, der sich aber schnell relativiert. Denn selbst wenn man sich auf das Wesentliche beschränkt: Um ein dem Mammut stark gleichendes Genom zu erhalten, müssten die Forscher schon ein paar hunderttausend Erbgutabschnitte ersetzen, so die vorsichtige Schätzung. Hinzu kommt: Noch kennen sie gar nicht alle Sequenzen, die für die mammuttypischen Merkmale relevant sind.
Ungeachtet dessen wollen die US -amerikanischen Wissenschaftler aber auch die Expression von Mammut-Mutationen in lebenden Elefantenzellen untersuchen, um Vorhersagen über die Genfunktion zu testen. Wie formt die Evolution dasselbe Gen, um es in einer Linie an tropische Lebensräume anzupassen, während eine alternative Version dieses Gens an kalte Lebensräume angepasst wird? Diese Forschung bildet nicht nur die Grundlage für die Wiederbelebung („de-extinction“) des Mammuts, sondern liefert potenziell wertvolle Einblicke in die Evolution unter verschiedenen Klimabedingungen. Die Erkenntnisse könnten neue Ansätze für die genetische Biotechnologie aufzeigen, um die Anpassung an vom Klimawandel bedrohte wildlebende Tiere zu erleichtern. Aber zum jetzigen Zeitpunkt ist das alles noch Zukunftsmusik.
Eine Waffe gegen Bakteriophagen
Um was für eine Technik handelt es sich eigentlich, die die Möglichkeiten der Molekularbiologie in den vergangenen Jahren so grundlegend erweitert hat und die Fantasie der Wissenschaftler beflügelt?
Wir blicken zurück in das Jahr 1987: Bei der Untersuchung von E. coli-Bakterien stoßen japanische Mikrobiologen zum ersten Mal auf ungewöhnliche, sich wiederholende DNA-Sequenzen im Erbgut eines Bakteriums. „Die biologische Bedeutung dieser Sequenzen ist vollkommen unbekannt“, schreiben sie. Wenig später nimmt der spanische Mikrobiologie Francisco Mojica an der Universität von Alicante diese Sequenzen genauer unter die Lupe. Sie lassen sich vorwärts wie rückwärts lesen, wie die Palindrom-Worte „Rentner“ oder „Lagerregal“ in der menschlichen Sprache. Während diese Worte aber durchaus eine Bedeutung haben, ergeben Palindrome im Wortschatz der Genetik keinen Sinn: Sie lassen sich nicht in funktionstüchtige Proteine übersetzen.
Mojica nennt diese Sequenzen Clustered Regularly Interspaced Short Palindromic Repeats – oder kurz CRISPR. 2005 entdeckt er, dass sie mit Ausschnitten aus dem Genom eines Bakteriophagen, eines für Bakterien schädlichen Virus, übereinstimmen. Erstmals äußert er die Vermutung, dass CRIS PR in Bakterien die Funktion eines adaptiven Immunsystems haben könnte.
Zwei Jahre später gelingt einem französischen Wissenschaftler der Firma Danisco, dem weltweit größten Hersteller von Nahrungsmittelzusätzen, bei der Untersuchung von Streptokokken, die zur Herstellung von Joghurt eingesetzt werden, tatsächlich der experimentelle Nachweis: Philippe Horvath und seine Kollegen integrieren Ausschnitte der Phagen-DNA in den CRIS PR-Abschnitt und können so tatsächlich die nächste Phagen-Attacke bekämpfen.
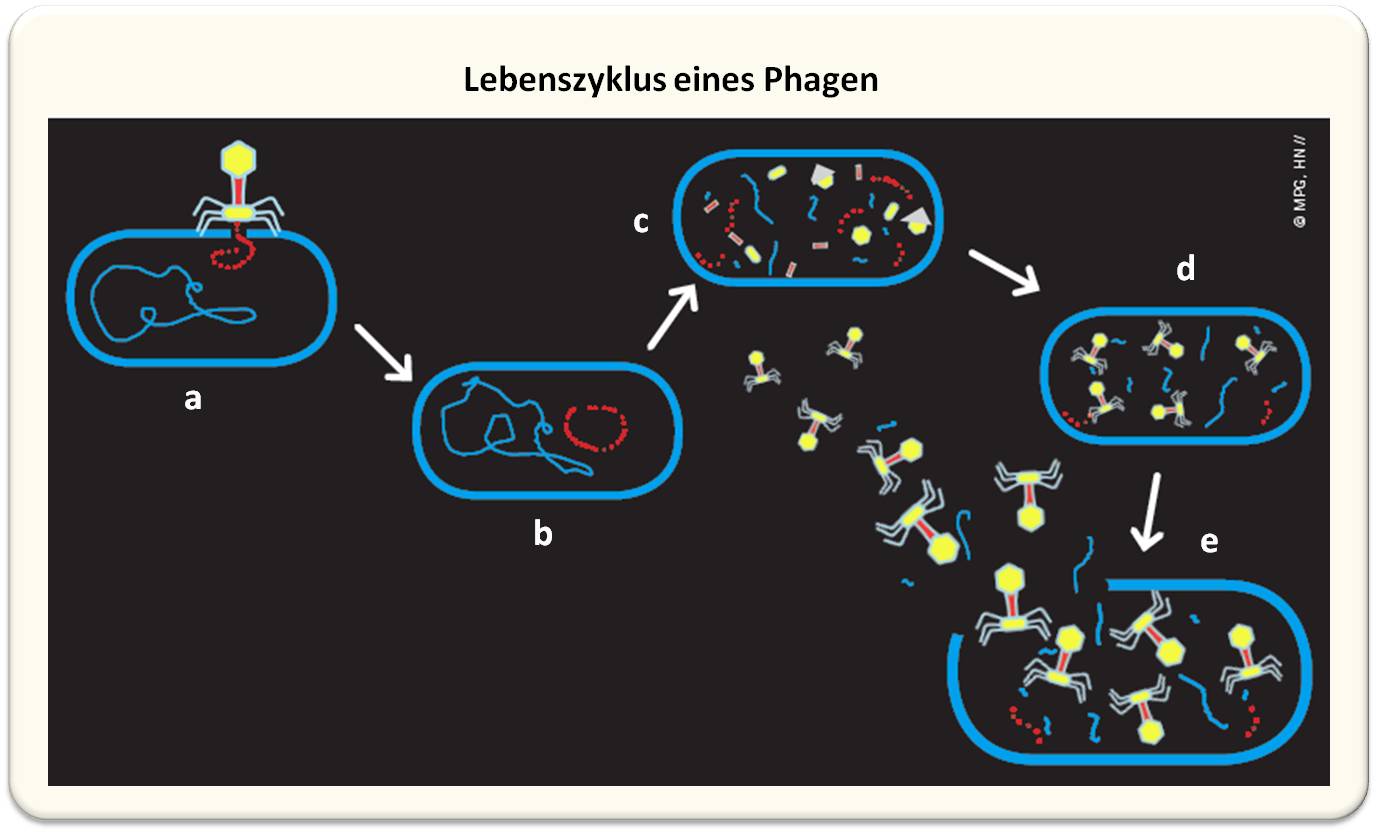
Bakterien sind ständigen Angriffen durch Bakteriophagen ausgesetzt. Denn diese sind nicht in der Lage, sich eigenständig zu vermehren. Sie müssen einen anderen Organismus kapern, in den sie ihr Erbgut einschleusen können. Die vom Phagen eingeschleusten Fremdgene programmieren das Genom des Wirtes um: Das Bakterium produziert nun keine Proteine mehr für sich selbst, sondern wird zu einer kleinen „Phagenfabrik“. Sie arbeitet so lange auf Hochtouren bis die Bakterienzelle voller Phagen ist und platzt, sodass die Phagen freigesetzt werden. (Abbildung 2)
| Abbildung 2. Infektion einer Bakterienzelle durch einen Phagen. Der Bakteriophage koppelt an passende Rezeptoren an der Oberfläche des Bakteriums an (a) und injiziert die phageneigene DNA bzw. RNA (b). Dann beginnt die Transkription des Virusgenoms und es kommt zur Produktion der Virusbestandteile (c). Diese werden zu reifen Phagen zusammengebaut (d). Die fertigen Phagen werden durch Auflösung der Wirtszelle befreit (e). Die Zelle platzt und etwa 200 infektiöse Phagen werden frei. |
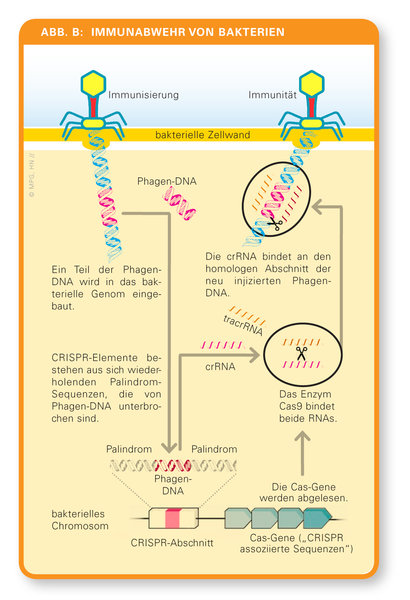
Aber Bakterien haben Abwehrmechanismen entwickelt, um sich gegen solche Infektionen zu wehren. Wenn die Enzyme eines Bakteriums es schaffen, die injizierte Virus-DNA in kleine Stücke zu schneiden, dann kommen andere Enzyme hinzu und bauen diese Fragmente in den CRIS PR-Abschnitt im bakterieneigenen Genom ein. Die seltsam aufgebauten Sequenzen stellen somit eine „Erinnerung“ an zurückliegende Virusinfektionen dar. Es ist eine Art Bibliothek sämtlicher Erreger, mit der das Bakterium schon konfrontiert worden ist. Und diese Bibliothek kann es sogar an seine Nachkommen weitergeben.
Das letzte Puzzle-Teil im CRISPR-CAS-System
Im Jahr 2011 rätselt die französische Mikrobiologin Emmanuelle Charpentier an der Universität Umeå in Schweden darüber, wie der dahinterliegende Mechanismus der Immunabwehr funktioniert.
Charpentier findet das letzte Puzzleteil im CRISPR-Cas-System, indem sie eine RNA-Sequenzierung bei einem Streptococcus-Bakterium durchführt und dabei auf zwei kurze RNAs stößt: Das Bakterium schreibt nämlich die Fremd-DNA im CRIS PR-Abschnitt in ein RNA-Molekül um, CRISPR-RNA (crRNA) genannt. Diese CRISPR-RNA ist quasi ein molekularer Steckbrief, sie liefert die Erkennungssequenz, mit der das Enzym namens Cas9, eine Nuklease, die entsprechende DNA-Sequenz des eingedrungenen Virus aufspürt. Damit Cas9 aktiv werden kann, bedarf es jedoch einer zweiten kleinen RNA, die die Mikrobiologin als trans-aktivierende CRISPR-RNA (tracrRNA) bezeichnet. Erst der Komplex aus crRNA und tracrRNA führt das Cas-Enzym zum Ziel: Indem Cas9 beide Stränge der Virus-DNA zerschneidet, verhindert es eine erfolgreiche Infektion durch den Bakteriophagen Abbildung 3.
| Abbildung 3. Wie sich Bakterien vor einer Zweitinfektion mit Bakteriophagen schützen - ein adaptives Immunsystem (Bild: © MPG, HN //) |
Zusammen mit Jennifer Doudna von der University of California in Berkeley gelingt Emmanuelle Charpentier, die heute die Max-Planck-Forschungsstelle für die Wissenschaft der Pathogene in Berlin leitet, ein Jahr später der entscheidende technologische Durchbruch: Sie fusionieren die beiden RNA-Moleküle crRNA und tracrRNA im Labor zu einem einzigen Molekül, einer sogenannten Single Guide RNA. Für den Einsatz der CRISPR/Cas-Methode muss nur noch eine RNA kloniert werden. Die beiden Wissenschaftlerinnen haben damit das Funktionsprinzip von CRISPRCas9, in der Öffentlichkeit gerne als Gen-Schere bezeichnet, radikal vereinfacht.
2013 adaptiert der Biochemiker Feng Zhang, der am Broad Institute des MIT und der Harvard University forscht, CRISPR-Cas9 erfolgreich für die Genom-Editierung in eukaryotischen Zellen. Zhang und seinem Team gelingt die gezielte Genom-Editierung in kultivierten Zellen der Maus und des Menschen. Sie zeigen, dass das CRISPR-Cas-System so programmiert werden kann, dass es verschiedene genomische Abschnitte verändert. George Church, der das Wollhaarmammut wieder zum Leben erwecken will, berichtet in der gleichen Ausgabe des Fachmagazin Science über ähnliche Ergebnisse.
Grundsätzlich ist Genom-Editierung nicht neu – verschiedene Techniken dafür gibt es schon seit Jahren. Was CRISPR so revolutionär macht, ist seine Präzision. Und es ist unglaublich billig und einfach. Mussten Forscher früher Tausende von US -Dollar und Wochen oder Monate im Labor einsetzen, um ein Gen zu verändern, so kostet es heute noch etwa 75 US -Dollar und dauert lediglich ein paar Stunden. Und diese Technik hat bei jedem Organismus, an dem sie ausprobiert wurde, funktioniert – vom Fadenwurm über Pflanzen bis hin zum Menschen.
CRISPR ist heute das heißeste Forschungsgebiet. 2011 gab es weniger als 100 Veröffentlichungen über CRISPR, 2018 waren es schon mehr als 17.000. Und es werden immer mehr, mit neuen Techniken zur Manipulation von Genen, Verbesserungen in der Präzision sowie weiteren Arten von CRIS PR-Proteinen, die ebenfalls als Gen-Editoren arbeiten. Cas13, zum Beispiel, kann RNA statt DNA editieren. „Wir sind an dem Punkt angelangt, an dem die Effizienz der Genbearbeitung auf einem Niveau liegt, das eindeutig sowohl therapeutisch als auch für eine Vielzahl anderer Anwendungen nützlich sein wird“, sagt Jennifer Doudna in einem Interview.
Und genau deshalb gibt es schon seit einigen Jahren einen intensiven Rechtsstreit darüber, wem die potenziell lukrativen Patentrechte für die CRISPR-Technologie zugesprochen werden sollen. Im September 2018 wies ein US -Bundesberufungsgericht die Einwände der University of California in Berkeley zurück und bestätigte die Patente des Broad Institute für einige CRISPR-Anwendungen. Die europäischen Regulierungsbehörden wiederum haben der Universität grundlegende Patente in Europa erteilt. Diese decken die Single Guide RNA für CRISPR-Cas9 in allen Bereichen, einschließlich eukaryotischer Zellen, weitgehend ab. 2019 hat die University of California in USA neue Dokumente vorgelegt und ficht damit die Entscheidung der US -amerikanischen Behörden an. Die Patentschlacht geht also weiter.
Genom-Editierung – Chancen und Risiken
Viele Mediziner sind überzeugt, dass sie durch das Editieren von Genen zum Beispiel Erbkrankheiten behandeln können, bei denen ein oder mehrere Gene nicht richtig funktionieren. Sie wollen es bei Mutationen anwenden, die beispielsweise die Huntington-Krankheit oder Mukoviszidose auslösen. Versuche an Mäusen haben gezeigt, dass fehlerhafte Genabschnitte, wie sie auch bei menschlichen Erbkrankheiten auftreten, durch das Editieren von Genen entfernt und die entsprechenden Krankheitsbilder behandelt werden können.
Eines der größten Probleme beim Versuch, die menschliche DNA zu verändern, besteht in den sogenannten Off-Target-Effekten. Diese entstehen, wenn Cas9 ein Stück DNA schneidet, auf das es nicht programmiert wurde. Das ist wie bei der Programmierung des Navigationsgerätes im Auto beispielsweise mit der Adresse „Restaurant“. In jeder Stadt führt diese Suche zu mehreren individuellen Standorten. Aber welcher Standort ist der richtige? In der gleichen Weise wird Cas9 durch die Guide RNA zu seinem DNA-Ziel geleitet. Wenn die von der Guide RNA angegebene Adresse nicht eindeutig ist – was bei lediglich 20 Basenpaaren leicht möglich ist –, wird Cas9 an mehrere Stellen geführt, wo es die DNA schneidet. Das könnte zu unerwünschten und schwerwiegenden Nebenwirkungen, einschließlich Krebs, führen. Für jede therapeutische Anwendung beim Menschen mit Hilfe von CRISPR ist die Minimierung dieser Off-Target-Effekte daher von größter Bedeutung.
Es gibt aber auch schon erste erfolgversprechende Ansätze. So wurden zwei Patientinnen mit Beta-Thalassämie bzw. Sichelzellanämie mit der CRISPR-Technik behandelt. Bei beiden Krankheiten ist die Herstellung des Blutfarbstoffs Hämoglobin gestört, beide konnten bislang nur mit häufigen Bluttransfusionen behandelt werden, die lebensverkürzende Nebenwirkungen haben. Nun kommen die Patientinnen seit Monaten ohne Bluttransfusionen aus, wie das Bostoner Online-Magazin STAT im November 2019 vermeldete. Die Gentherapien wurden von den Biotech-Firmen Vertex Pharmaceuticals und CRISPR Therapeutics entwickelt. Emmanuelle Charpentier hat CRISPR Therapeutics gegründet und zeigt sich gegenüber der Presse glücklich, „dass CRISPR-basierte Gentherapien nach einer einzigen Behandlung einen heilsamen Effekt für Patienten mit Beta-Thalassämie und Sichelzellanämie haben.“ Aber noch ist die Studie nicht abgeschlossen, insgesamt 45 Patienten sollen in deren Rahmen therapiert werden. Bei vielen von ihnen hat die Behandlung noch nicht einmal begonnen. Und noch kann man nicht sagen, ob die Therapie für immer wirkt und ob sie – ggf. zu einem viel späteren Zeitpunkt – Nebenwirkungen zeigt.
* Der Artikel ist erstmals unter dem Title: Genome Editing mit CRIPR-Cas9" in BIOMAX 35 (Winter 2019/2020) der Max-Planck-Gesellschaft erschienen https://www.max-wissen.de/318686/BIOMAX-35-web.pdf und wurde freundlicherweise von der Autorin ScienceBlog.at zur Verfügung gestellt. Der Artikel wurde praktisch unverändert in den Blog übernommen.
Weiterführende Links
Gen-editing mit CRISPR/Cas9 Video 3:13 min (deutsch) , Max-Planck Gesellschaft (2016) (Standard-YouTube-Lizenz ) https://www.youtube.com/watch?v=ouXrsr7U8WI
Ricki Lewis, 28.11.2019: Wenn das angepeilte Target nicht das tatsächliche Target ist - ein Grund für das klinische Scheitern von Wirkstoffen gegen Krebs. http://scienceblog.at/wenn-das-angepeilte-target-nicht-das-tats%C3%A4chliche-target-ist
Artikel von Christina Beck im ScienceBlog:
Christina Beck, 05.04.2018: Endosymbiose - Wie und wann Eukaryonten entstanden http://scienceblog.at/endosymbiose-wie-und-wann-eukaryonten-entstanden#.
Christina Beck, 29.03.2018:Ursprung des Lebens - Wie Einzeller kooperieren lernten. http://scienceblog.at/ursprung-des-lebens-wie-einzeller-kooperieren-lernten#.
- Printer-friendly version
- Log in to post comments