Fr, 04.12.2020 — Redaktion

![]() Antibiotika sind für die Behandlung bakterieller Infektionen unentbehrlich. Ihre Anwendung kann jedoch zur Entwicklung und Übertragung von resistenten Bakterien führen. Infektionen mit solchen Bakterien machen eine Behandlung schwierig oder gar aussichtslos. Angesichts des massiven Problems von akquirierten resistenten Keimen in Krankenhäusern und vor allem in Intensivstationen, ist die Suche nach Wegen zur Verhinderung der Resistenzentstehung vordringlich. In einer eben erschienenen Studie [1] wird eine derartige Strategie vorgestellt, nämlich, dass gleichzeitig mit Antibiotka angewandt Adjuvantien - hier das bereits lange als Cholesterinsenker angewandte Colestyramin - die Entwicklung von Resistenzen - hier gegen das derzeit potenteste Antibiotikum Daptomycin - verhindern können.*
Antibiotika sind für die Behandlung bakterieller Infektionen unentbehrlich. Ihre Anwendung kann jedoch zur Entwicklung und Übertragung von resistenten Bakterien führen. Infektionen mit solchen Bakterien machen eine Behandlung schwierig oder gar aussichtslos. Angesichts des massiven Problems von akquirierten resistenten Keimen in Krankenhäusern und vor allem in Intensivstationen, ist die Suche nach Wegen zur Verhinderung der Resistenzentstehung vordringlich. In einer eben erschienenen Studie [1] wird eine derartige Strategie vorgestellt, nämlich, dass gleichzeitig mit Antibiotka angewandt Adjuvantien - hier das bereits lange als Cholesterinsenker angewandte Colestyramin - die Entwicklung von Resistenzen - hier gegen das derzeit potenteste Antibiotikum Daptomycin - verhindern können.*
Der erste Globale Sepsis-Report der WHO
Im September d.J. ist der erste Globale Sepsis Report "On the Epidemiology and Burden of Sepsis" der Weltgesundheitsorganisation (WHO) erschienen. Sepsis ("Blutvergiftung") wird dabei als eine lebensbedrohende Fehlfunktion von Organen definiert, die durch eine fehlregulierte Antwort des Wirtes auf eine Infektion ausgelöst wird. Erste Abschätzungen der weltweiten Sepsis-Erkrankungen und -Todesfälle wurden für das Jahr 2017 erstellt und bieten ein erschreckendes Bild: etwa 49 Millionen Menschen (davon 40 % Kinder und Jugendliche) waren in diesem Jahr an Sepsis erkrankt, etwa 11 Millionen starben daran. Mit rund 20 % aller Todesfälle ist Sepsis damit eine der Haupttodesursachen; nach Ansicht der WHO wären sehr viele dieser Todesfälle vermeidbar. Aus dem Report ist ein globaler Überblick über Inzidenz und Mortalität von Sepsis in Abbildung 1 dargestellt.
Sepsis ist insbesondere für Krankenhäuser und Pflegeeinrichtungen ein sehr ernstes Problem. Eine systematische Analyse der WHO für den Zeitraum 2000 - 2018 zeigt, dass in 1 von 4 aller in den Spitälern behandelten Sepsis-Fällen und in 1 von 2 Fällen in den Intensivstationen, diese dort selbst akquiriert wurden [2]. Bis zu ein Drittel der Infektionen wurden durch Antibiotika-resistente Bakterien verursacht. Die Mortalität auf Grund solcher erworbenen Infektionen lag insgesamt bei 24 %, auf den Intensivstationen bei 52,3 %.
Zur Entwicklung resistenter Bakterien im Darm
Antibiotika sind das Um und Auf in der Behandlung bakterieller Infektionen. Allerdings kann ihre Verwendung - ohne dass man es will - zur Entwicklung von Bakterien führen, die nicht mehr auf Antibiotika ansprechen, die dagegen resistent geworden sind. Infektionen mit solchen Bakterien machen eine Behandlung schwierig oder gar aussichtslos. Um die Wirksamkeit von Antibiotika bewahren zu können, muss man daher nach Wegen suchen die Entstehung von Resistenzen gegen Antibiotika zu verhindern.
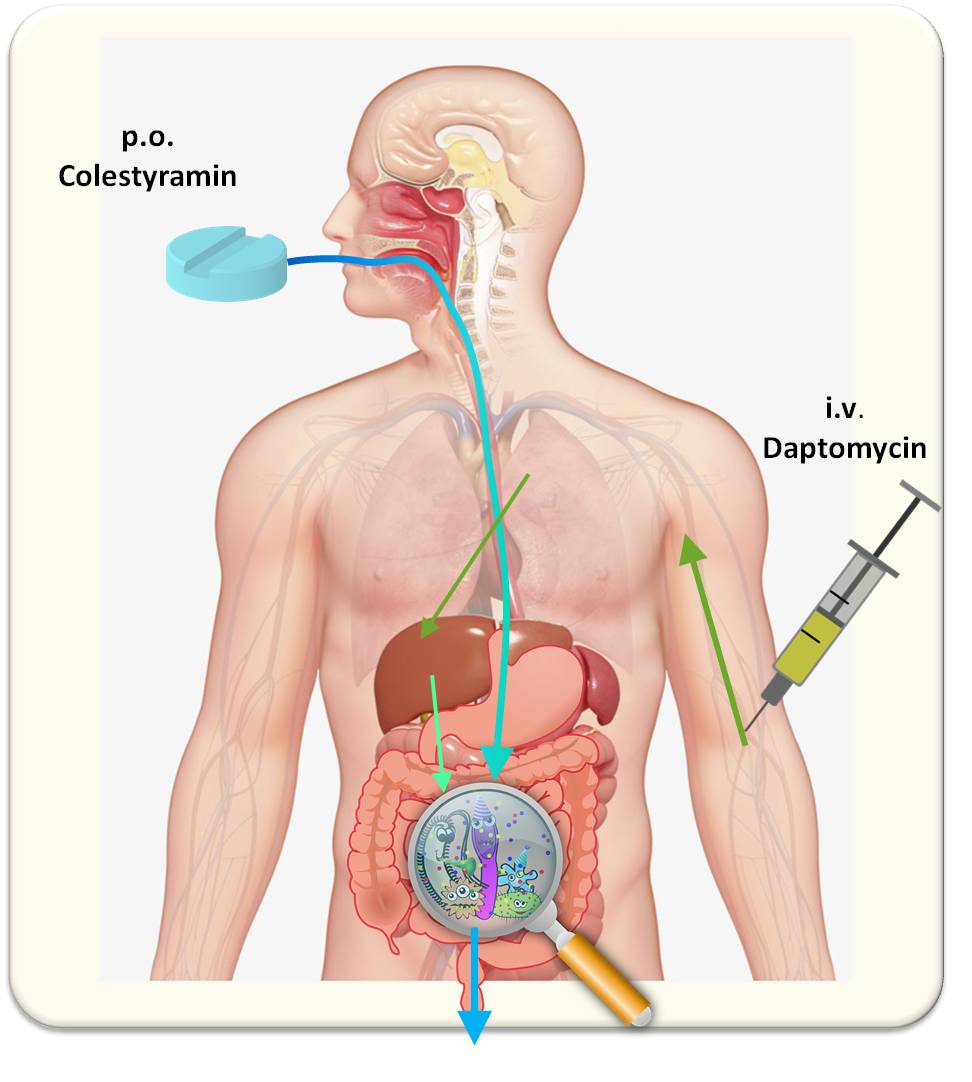
Viele Bakterienstämme, die in Krankenhäusern Infektionen verursachen, leben im Darm, wo sie an sich harmlos sind. Gelangen diese Bakterien allerdings in den Blutkreislauf, so können sie lebensbedrohliche Infektionen verursachen. Wenn an Sepsis-Patienten nun Antibiotika verabreicht werden - intravenös, intramuskulär, topisch oder auch peroral -, so sind auch die Bakterien in ihrem Darm diesen Medikamenten ausgesetzt. Die Antibiotika können dort dann alle Bakterien, die für diese Antibiotika sensitiv sind, abtöten und nur solche zurücklassen, welche auf Grund von Mutationen die Medikamente überleben. Solche arzneimittelresistenten Bakterien können sich dann (u.a. durch fäkale Schmierinfektionen; Anm. Redn.) auf andere Patienten ausbreiten und in Folge schwerst behandelbare Infektionen verursachen.
Ein wichtiger Erreger von Antibiotika-resistenten Infektionen in Krankenhäusern ist der bereits gegen das Antibiotikum Vancomycin resistente Keim Enterococcus faecium (VR E. faecium). Das derzeit potenteste Antibiotikum Daptomycin (Abbildung 2, oben) ist eine der wenigen verbleibenden Primärtherapien bei VRE-Infektionen. Allerdings beginnt sich auch Resistenz gegen Daptomycin in Enterococcus-Populationen auszubreiten; wesentlicher Treiber dafür dürfte dessen derzeitige therapeutische Anwendung sein.
E. faecium ist ein opportunistischer Erreger, der den menschlichen Verdauungstrakt besiedelt ohne dabei Symptome hervorzurufen; er kann sich aber auch über eine fäkal-orale Übertragung ausbreiten und symptomatische Infektionen verursachen, wenn er beispielsweise an Stellen des Blutkreislaufs oder der Harnwege Eingang in Gewebe/Organe findet. Zur Behandlung von Infektionen mit Krankheitserregern wie VRE und Staphylococcus aureus wird Daptomycin intravenös verabreicht. Das im Darm sitzende E. faecium kann während einer solchen Therapie dem Daptomycin ausgesetzt sein, was möglicherweise zur Übertragung von Daptomycin-resistentem E. faecium beiträgt. Dies lässt sich auf Grund der Pharmakokinetik (d.i. dem Schicksal eines Wirkstoffs im Organismus) von Daptomycin erklären: Daptomycin wird vorwiegend in unveränderter Form hauptsächlich über die Nieren ausgeschieden, 5–10% der Dosis gelangen aber über die Gallenausscheidung in den Darm. Es ist dies eine therapeutisch völlig unnötige Daptomycin-Exposition des Darms, welche dort die Resistenzentwicklung von E. faecium treiben könnte; diese Keime werden dann zu Quellen für nosokomiale Infektionen (im Zuge des Aufenthalts oder der Behandlung in einem Krankenhaus erworbene Infektionen) und für eine Übertragung von Patient zu Patient.
Ein Anti-Antibiotikum kann die Resistenzentwicklung im Darm blockieren
Wenn eine unvorhergesehene Daptomycin-Exposition des Darms die Resistenzentwicklung bei E. faecium antreibt, so bietet dies die Chance hier einzugreifen. Es ist eine Chance, die aus einem wesentlichen Merkmal dieses Systems resultiert: Die Bakterien, die eine Infektion (im Blutkreislauf) verursachen, sind physisch von der Population im Darm separiert, die zur Übertragung beiträgt. Könnte man also das in den Darm gelangende Daptomycin inaktivieren ohne die erforderlichen, antibiotisch wirksamen Konzentrationen im Blutkreislauf zu verändern, so könnte Daptomycin verwendet werden, um Bakterien an dem Zielort der Infektion abzutöten, ohne dabei die Entstehung von Resistenz in Populationen außerhalb dieser Stellen zu erhöhen. Die Verhinderung der Resistenzentwicklung in diesen Reservoirpopulationen könnte Patienten vor dem Akquirieren resistenter Infektionen schützen und die Verbreitung resistenter Stämme und damit die Übertragung auf andere Patienten limitieren.
Ein Forscherteam der Penn-State University und der University Michigan hat nun die Hypothese aufgestellt, dass die Entstehung von Daptomycin-Resistenz verhindert werden kann, wenn während der intravenösen Behandlung mit Daptomycin gleichzeitig ein orales Adjuvans gegeben wird, welches die Wirksamkeit des Antibiotikums im Darm verringert [1]. Unter Verwendung von Colestyramin (Abbildung 2, unten ) als Adjuvans haben die Forscher diese Hypothese in einem E. faecium Darm-Kolonisierungsmodel an der Maus getestet.
Colestyramin ("Cubicin") ist ein altes, bereits vor mehr als 50 Jahren eingeführtes Agens zur Senkung hoher Cholesterinspiegel, das vor dem Aufkommen der Statine viel verwendet wurde. Colestyramin ist ein stark basisches Polymeres aus Styrolketten mit eingefügten Aminogruppen, das zahlreiche Biomoleküle (u.a. Cholesterin, Gallensäuren Vitamine A und D) bindet und auf Grund seiner Größe (Molekulargewicht um 1 000 kD) und seines hydrophilen Charakters aus dem Darm nicht in den Organismus aufgenommen werden kann. Wie in vitro Untersuchungen im Labor ergeben hatten, bindet Colestyramin auch das Antibiotikum Daptomycin sehr fest und kann dessen Konzentration und Wirksamkeit enorm verringern [1].
Vorerst haben die Forscher nun an der Maus die Resistenzentwicklung von E. faecium gegen Daptomycin untersucht. Dazu haben sie die Substanz in unterschiedlichen Dosierungen den Tieren subcutan injiziert. Wie Analysen des ausgeschiedenen Kots zeigten, gelangte Daptomycin in ausreichenden Konzentrationen in den Darm, um dort die Bildung resistenter Formen von E. faecium auszulösen. Wachstum und entsprechende Ausscheidung der resistenten E. faecium Keime konnten nur durch enorm hohe Dosen Daptomycin unterdrückt werden. Wurde jedoch Colestyramin (oral) und Daptomycin (subcutan) gleichzeitig an die Mäuse appliziert, so konnte das Wachstum von Antibiotika-resistenten Bakterien im Darm der Mäuse (gemessen an resistenten Keimen im Kot) um das 80-fache reduziert werden ohne die wirksamen Konzentrationen des Antibiotikums im Blut zu beeinflussen. Diese Ergebnisse sind eine vorläufige Bestätigung, dass Colestyramin als eine Art Anti-Antibiotikum eingesetzt werden könnte. Bei gleichzeitiger Gabe mit einem Antibiotikum (nicht nur von Daptomycin) könnte es dazu beitragen die Entstehung von Arzneimittelresistenzen im Mikrobiom des Darms zu verhindern/reduzieren und damit deren Verbreitung über fäkale Kontaminationen. Abbildung 3.
Natürlich sind weitere Studien erforderlich, um festzustellen, ob Colestyramin Darmbakterien vor systemisch applizierten Antibiotika schützen und auch bei Menschen Antibiotikaresistenzen verhindern kann. Für Colestyramin, das bereits seit Jahrzehnten therapeutisch zur Senkung des Cholesterinspiegels bei Menschen eingesetzt wird, wäre dies eine Neuanwendung, ein sogenanntes "drug repurposing": ohne zahlreiche präklinische Studien und Verträglichkeitsstudien könnte eine Zulassung in der neuen Indikation in verkürzter Entwicklungszeit und mit reduzierten Kosten erfolgen.
[1] Valerie J. Morley et al., "An adjunctive therapy administered with an antibiotic prevents enrichment of antibiotic-resistant clones of a colonizing opportunistic pathogen" eLife 2020;9:e58147. DOI: https://doi.org/10.7554/eLife.58147
[2] WHO: GLOBAL REPORT ON THE EPIDEMIOLOGY AND BURDEN OF SEPSIS (September 2020) https://www.who.int/publications/i/item/9789240010789
* Dem Artikel liegt die von Valerie J. Morley et al., stammende Publikation "An adjunctive therapy administered with an antibiotic prevents enrichment of antibiotic-resistant clones of a colonizing opportunistic pathogen" zugrunde, die am 1. Dezember 2020 in eLife 2020;9:e58147. DOI: https://doi.org/10.7554/eLife.58147 erschienen ist. Der Digest, Teile der Einleitung und der Ergebnisse wurden von der Redaktion ins Deutsche übersetzt und für ScienceBlog.at adaptiert (Untertitel, Abbildungen).Zusätzlich wurde ein Abschnitt über den im September erschienenen Globalen Sepsis Report der WHO von der Redaktion eingefügt. eLife ist ein open access Journal, alle Inhalte stehen unter einer cc-by Lizenz.
Weiterführende Links
Wachsende Bedrohung durch Keime und gleichzeitig steigende Antibiotika-Resistenzen? Video 7:18 min (aus der Uniklinik Bonn - stimmt auch für Österreich) Standard YouTube Lizenz. https://www.youtube.com/watch?v=lEoLh0ZBt34
Zahlreiche ScienceBlog-Artikel beschäftigen sich mit resistenten Keimen, u.a:
- Inge Schuster, 27.02.2020 Neue Anwendungen für existierende Wirkstoffe: Künstliche Intelligenz entdeckt potentielle Breitbandantibiotika
- Bill & Melinda Gates Foundation, 23.01.2020: Der Kampf gegen die erfolgreichste Infektionskrankheit der Geschichte
- und
- Bill & Melinda Gates Foundation, 09.05.2014: Der Kampf gegen Tuberkulose
- Francis S. Collins, 29.11.2018: Krankenhausinfektionen – Keime können auch aus dem Mikrobiom des Patienten stammen
- Redaktion, 22.11.2018: Eurobarometer 478: zum Wissenstand der EU-Bürger über Antibiotika, deren Anwendung und Vermeidung von Resistenzentstehung
- Inge Schuster, 23.09.2016: Gehen wir auf eine Post-Antibiotika Ära zu?
- Gottfried Schatz, 30.05.2013: Planet der Mikroben — Warum wir Infektionskrankheiten nie endgültig besiegen werden
- Peter Palese, 10.05.2013: Influenza-Viren – Pandemien: sind universell wirksame Impfstoffe in Reichweite?
- Printer-friendly version
- Log in to post comments