Fr, 06.05.2016 - 11:39 — Manuela Schmidt
Schmerz ist ein Hauptsymptom vieler Krankheiten und weltweit der häufigste Grund für Menschen, medizinische Hilfe zu suchen. Während akuter Schmerz ein Warnsignal darstellt, bergen chronische Schmerzen große Herausforderungen sowohl für Patienten als auch für behandelnde Ärzte. Für die Entwicklung nebenwirkungsarmer und effizienter Schmerztherapien wäre die Entzifferung von Proteinen, die ausschließlich an chronischen Schmerzen beteiligt sind, von enormer Bedeutung. Die Neurowissenschafterin Manuela Schmidt ( Max-Planck Institut für experimentelle Medizin, Göttingen) arbeitet an den molekularen Grundlagen der Schmerzentstehung und -weiterleitung.*
Stellen Sie sich vor Sie begegneten einer guten Fee, die Ihnen verspricht, dass Sie von heute an schmerzfrei leben könnten. Sie würden sicher, ohne mit der Wimper zu zucken, der Erfüllung dieser Verheißung zustimmen. Wie würde allerdings Ihr Leben ohne Schmerzen in Alltagssituationen aussehen? Sie stehen morgens auf, trinken Ihren Kaffee und würden nicht bemerken, dass er zu heiß ist und sich daher die Zunge verbrennen; im Sportverein würden Sie der Knieverletzung keine Beachtung schenken, weiterspielen und dadurch möglicherweise langanhaltende Gewebeschäden hervorrufen; die Entzündung des Blinddarms würden Sie aufgrund fehlender Schmerzen erst sehr spät bemerken, was potenziell lebensgefährliche Konsequenzen nach sich zöge ... Dies sind nur wenige Beispiele, die die enorme Schutzfunktion von Schmerzen als Warnsignal widerspiegeln. Besonders prägnante Beispiele liefert die Betrachtung von Menschen, deren Schmerzempfindung durch Mutationen in ihrem Erbgut beeinträchtigt ist. Deren Alltag ist gezeichnet von zahlreichen, oft schwerwiegenden Verletzungen und Entzündungen, welche im Allgemeinen zu einer verringerten Lebenserwartung führen.
Während allerdings dieser akute oder sogenannte nozizeptive Schmerz als überlebenswichtiges Warnsignal für schädliche Bedingungen fungiert, stellen chronische Schmerzen eine Fehlanpassung des Nervensystems dar. Chronische Schmerzen bergen essenzielle Herausforderungen, weil sie mit heute bekannten Schmerzmedikamenten nicht adäquat therapierbar sind. Patienten mit chronischen Schmerzen sind aus diesem Grund hohem Leiden und überdies starken Nebenwirkungen der Therapien ausgesetzt. Letzteres resultiert größtenteils daraus, dass heutige Schmerztherapeutika Proteine angreifen, die im gesamten Organismus vorkommen.
Um also die positive Seite der Verheißung auf ein schmerzfreies Leben genießen zu können, müsste man von der guten Fee verlangen, nur chronische Schmerzen zu verhindern. Zur Erfüllung dieses Wunsches ist ein besseres Verständnis der molekularen Mechanismen, die spezifisch für chronische Schmerzen sind, unabdingbar.
Schmerz und Membranproteine
Schmerz ist ein Hauptsymptom vieler Krankheiten und weltweit der häufigste Grund für Menschen, medizinische Hilfe zu suchen. Wirbeltiere, einschließlich des Menschen, besitzen spezialisierte somatosensorische Nerven, deren Zellkörper in den Hinterwurzelganglien parallel zum Rückenmark gruppiert sind. Mittels dünner zellulärer Fortsätze innervieren diese somatosensorischen Nervenzellen die Haut und innere Organe. Um sowohl normale als auch schmerzhafte Reize unterschiedlicher Qualität (mechanisch, thermisch und chemisch) zu erkennen, sind diese Nervenzellen mit Proteinen ausgestattet, welche als primäre molekulare Signaldetektoren fungieren. Dabei handelt es sich um Membranproteine (d.h. sie sind in der Plasmamembran der Nervenzellen exprimiert), welche die einzigartige Fähigkeit zur Erkennung und Weiterleitung normaler und schädlicher Reize besitzen – von einer sanften Berührung bis zur schmerzhaften Wahrnehmung eines spitzen Nagels.
Bahnbrechende Forschungsergebnisse haben vor erst 15 bis 20 Jahren die molekulare Identität wichtiger Signaldetektoren entschlüsselt und damit die Erforschung der molekularen Grundlagen von Schmerzentstehung maßgeblich vorangebracht. Eine prominente Gruppe dieser Signaldetektoren bilden sogenannte Transient Receptor Potential (TRP)-Ionenkanäle. Vertreter der TRP-Ionenkanalfamilie werden durch verschiedenste pflanzliche Substanzen aktiviert, wie z. B. die „brennende“ Substanz aus feurigen Chilischoten, das Capsaicin. Arbeiten aus dem Labor von David Julius (UCSF, USA) konnten an Mäusen zeigen, dass Capsaicin einen bestimmten TRP-Ionenkanal (sogenannte TRPV1-Kanäle) in sensorischen Nervenfasern aktiviert. Dieser Prozess löst das feurig-brennende Gefühl aus, welches wir auch mit dem Essen von Chilischoten verbinden. Interessanterweise wird derselbe Ionenkanal auch durch noxische Hitze, also Temperaturen über 42°C, aktiviert, was gleichermaßen zu einem feurig-brennenden Hitzegefühl führt. Im Gegensatz dazu wurde im Labor von Ardem Patapoutian (Scripps Research Institute, USA) ein anderer TRP-Kanal, TRPA1, kloniert und charakterisiert, der sowohl durch noxische Kälte (Temperaturen unter 15°C), als auch durch verschiedenste pflanzliche und chemische irritierende Substanzen aktiviert wird, wie z. B. Senföle, die sich in Senf- und Wasabi-Produkten finden, aber auch Tränengase, die Atemwegsirritationen auslösen.
Diese Beispiele zeigen, dass molekulare Sensoren ein unglaubliches Repertoire von schmerzhaften Reizen detektieren können, wobei diese sowohl exogener als auch endogener Natur (z. B. Substanzen, die während Entzündungen freigesetzt werden) sein können. Die Aktivierung der Signaldetektoren erzeugt einen elektrischen Impuls, der durch weitere Membranproteine in ein sogenanntes Aktionspotenzial in der Nervenzelle umgewandelt wird. Wiederum mittels bestimmter Membranproteine löst das Aktionspotenzial komplexe Signalweiterleitungskaskaden im Rückenmark und daraufhin in verschiedenen Gehirnarealen aus, die letztendlich für die Empfindung von Schmerz verantwortlich sind (Abbildung 1).
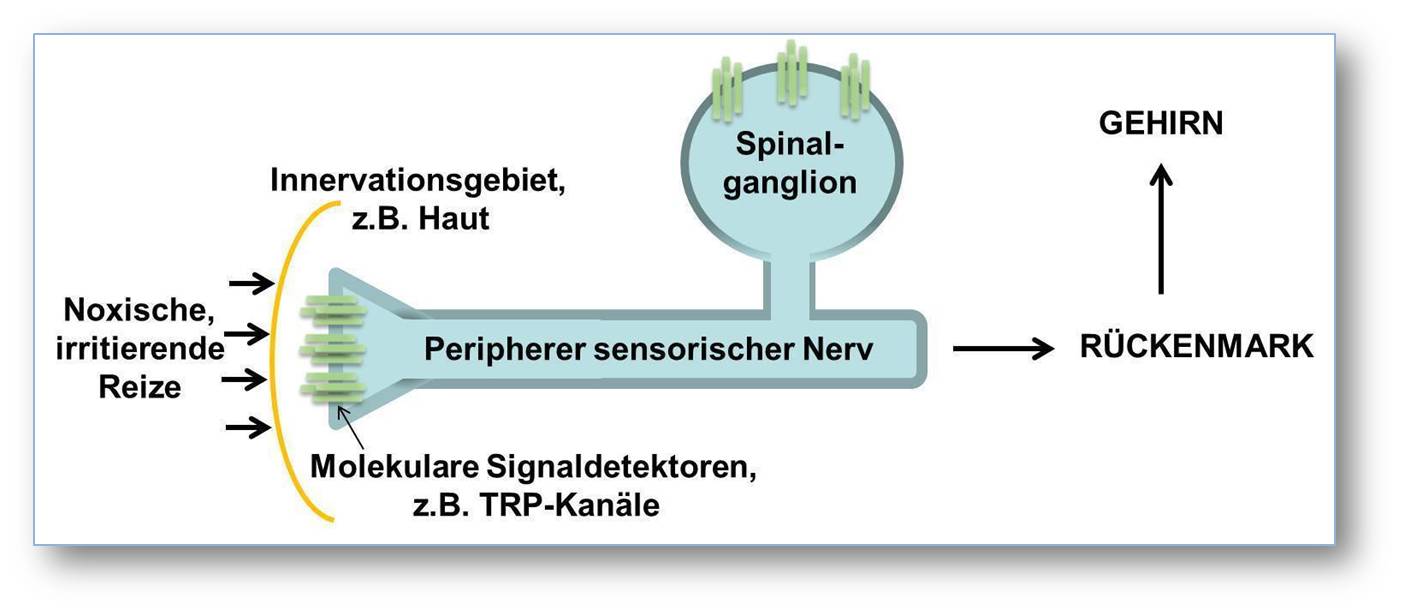 Abbildung1: Schematische und stark vereinfachte Darstellung der „Schmerzachse“ in Wirbeltieren. Die Aktivierung molekularer Signaldetektoren wie z. B. TRP-Kanäle in der Membran peripherer sensorischer Nerven durch noxische oder irritierende Reize erzeugt einen elektrischen Impuls, der in ein sogenanntes Aktionspotenzial in der Nervenzelle umgewandelt wird. Wiederum mittels bestimmter Membranproteine löst das Aktionspotenzial komplexe Signaltransduktionskaskaden im Spinalganglion und daraus folgend im Rückenmark aus. Daraufhin wird die Information zu verschiedenen Gehirnarealen weitergeleitet, die letztendlich für die Empfindung von Schmerz verantwortlich sind.© Max-Planck-Institut für experimentelle Medizin/Schmidt
Abbildung1: Schematische und stark vereinfachte Darstellung der „Schmerzachse“ in Wirbeltieren. Die Aktivierung molekularer Signaldetektoren wie z. B. TRP-Kanäle in der Membran peripherer sensorischer Nerven durch noxische oder irritierende Reize erzeugt einen elektrischen Impuls, der in ein sogenanntes Aktionspotenzial in der Nervenzelle umgewandelt wird. Wiederum mittels bestimmter Membranproteine löst das Aktionspotenzial komplexe Signaltransduktionskaskaden im Spinalganglion und daraus folgend im Rückenmark aus. Daraufhin wird die Information zu verschiedenen Gehirnarealen weitergeleitet, die letztendlich für die Empfindung von Schmerz verantwortlich sind.© Max-Planck-Institut für experimentelle Medizin/Schmidt
Das Konzept der „molekularen Maschinen“
Bereits diese kurze Beschreibung der generellen Grundlagen zur Schmerzdetektion, -weiterleitung und -empfindung veranschaulicht die enorme Bedeutung von Membranproteinen, welche in der „Schmerzachse“ exprimiert werden. Gemeint sind damit die Regionen des peripheren (PNS) und des zentralen Nervensystems (ZNS), die an der Verarbeitung von Schmerzsignalen beteiligt sind. Aufgrund vieler technischer Hürden in der Analyse von Membranproteinen wissen wir bisher nur relativ wenig darüber, welche Membranproteine für bestimmte Schmerzformen relevant sind und vor allem wie diese im Detail reguliert sind. Würde man allerdings Membranproteine oder deren Regulationsmechanismen identifizieren, die selektiv nur während chronischer Schmerzen zum Einsatz kämen, könnte man diese als Angriffspunkte für zukünftige Therapien heranziehen, um Schmerzbehandlungen wirksamer zu machen und Nebenwirkungen zu reduzieren .
Allerdings erfolgte die Erforschung der Pathomechanismen chronischer Schmerzen bisher vor allem auf der genomischen oder der Transkriptom-Ebene, das heißt vor der Umsetzung der Nukleinsäuren in Proteine. Da Proteine die funktionellen Einheiten einer Zelle bilden und nur bedingt vom Trankriptom auf das Proteom, also die Gesamtheit der Proteine einer Zelle, geschlossen werden kann, ist eine detaillierte Proteomanalyse unverzichtbar. Auf welche Art und Weise wird die Aktivität von Membranproteinen während der Schmerzen gesteuert? Um die Frage zu beantworten, ist es wichtig, assoziierte oder auch interagierende Proteine zu identifizieren. Kern dieses Denkansatzes ist das Konzept der „molekularen Maschinen“, welches besagt, dass die Funktion einzelner Proteine durch deren Interaktion mit anderen Proteinen in sogenannten Multi-Proteinkomplexen dynamisch moduliert werden kann. Konsequenterweise sollte die Aufklärung der Komponenten solcher Proteinkomplexe Aufschluss über die Funktion und Regulation eines Proteins geben können. Die Gültigkeit dieses Konzepts wurde bereits anhand vieler Beispiele gezeigt, allerdings wurde es nur spärlich zur Erforschung der molekularen Grundlagen von Schmerzen angewandt.
Das erklärte Ziel der Max-Planck-Forscher ist es daher, die Regulation von Membranproteinen und assoziierten Proteinnetzwerken während nozizeptiver und chronischer Schmerzen vergleichend zu untersuchen. Mit diesem Ansatz konnte die Forschungsgruppe um Manuela Schmidt bereits zeigen, dass die Aktivität von TRPA1-Kanälen in Mäusen durch ein interagierendes Protein, Annexin A2, sowohl während nozizeptiver als auch chronischer Schmerzen gebremst wird. Diese Arbeit wurde mit dem Förderpreis für Schmerzforschung der Deutschen Schmerzgesellschaft e. V. ausgezeichnet. In einem nächsten Schritt weiteten die Max-Planck-Forscher Ihre Arbeit auf die ungleich schwierigere Aufgabe aus: Sie suchten mithilfe modernster quantitativer Massenspektrometrie nach solchen Proteinkomplexen, die spezifisch während chronischer Schmerzen mit TRPA1-Kanälen assoziiert sind (in Kollaboration mit Dr. Olaf Jahn, MPIem, und Dr. Henning Urlaub, MPIbpc). Tatsächlich lassen die daraus resultierenden Ergebnisse darauf schließen, dass TRPA1-Kanäle mit unterschiedlichen Proteinen einen Komplex bilden, je nach angewandten Schmerzparadigmen, d. h. je nachdem, ob zuvor im Mausmodell nozizeptive oder chronische Schmerzen ausgelöst wurden (Abbildung 2). Ähnliche Ergebnisse haben die Forscher auch für die eingangs erwähnten TRPV1-Kanäle erhalten.
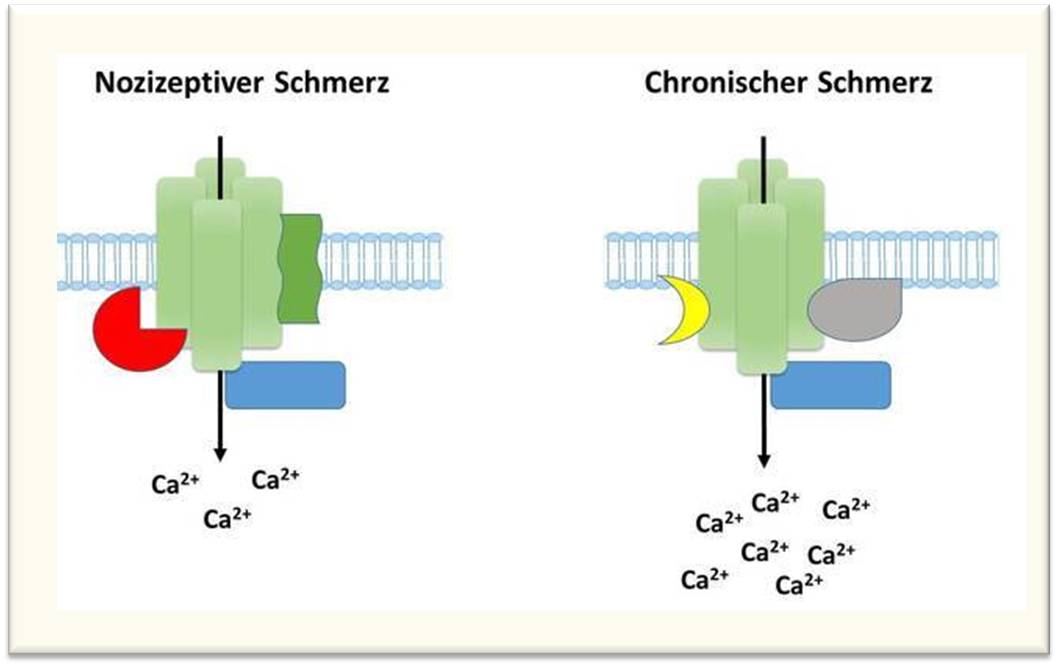 Abbildung 2: Schematische und stark vereinfachte Darstellung der Regulation von TRPA1-Kanälen (hellgrün) in der neuronalen Membran durch assoziierte Proteine (farbige Formen) in Abhängigkeit vom Schmerzparadigma. Diese Unterschiede können unter anderem zu erhöhter Aktivität von TRPA1 während chronischer Schmerzen führen (dargestellt durch erhöhte Anzahl von Kalziumionen (Ca+2). © Max-Planck-Institut für experimentelle Medizin/Schmidt
Abbildung 2: Schematische und stark vereinfachte Darstellung der Regulation von TRPA1-Kanälen (hellgrün) in der neuronalen Membran durch assoziierte Proteine (farbige Formen) in Abhängigkeit vom Schmerzparadigma. Diese Unterschiede können unter anderem zu erhöhter Aktivität von TRPA1 während chronischer Schmerzen führen (dargestellt durch erhöhte Anzahl von Kalziumionen (Ca+2). © Max-Planck-Institut für experimentelle Medizin/Schmidt
Ausblick
Aktuelle Projekte in der Forschungsgruppe "Somatosensorische Signaltransduktion und Systembiologie" am Max-Planck-Institut für experimentelle Medizin beschäftigen sich nun mit der Charakterisierung der neuen und bisher unbeschriebenen Komponenten dieser TRP-Kanal-Proteinkomplexe sowie ihrer pathologischen Relevanz für chronische Schmerzen am Mausmodell. Zusätzlich zu dem hier dargestellten Kandidaten-fokussierten Ansatz, d. h. Studien, die sich mit bestimmten TRP-Kanälen beschäftigen, untersucht die Forschungsgruppe nun auch die differenzielle Regulation mehrerer tausend Proteine während verschiedener Schmerzformen in einem systembiologischen Ansatz. Diese Arbeit wurde mit dem Max von Frey-Preis 2015 der Deutschen Schmerzgesellschaft e. V. ausgezeichnet. Möglich wurde dieser Fortschritt durch die Kombination von Mausmodellen, biochemischen Arbeiten und neuesten Entwicklungen in der massenspektrometrischen Proteomanalyse.
Derartige Studien gewähren neue Einblicke in die molekulare Signatur der Schmerzentstehung auf Proteinebene – Wissen, das unabdingbar für die Entwicklung effizienter und spezifischer Schmerztherapien ist.
*Der gleichnamige, aus dem eben erscheinenden Jahrbuch der Max-Planck Gesellschaft 2016 entnommene Artikel ist aufrufbar unter: Forschungsbericht 2016 (DOI 10.17617/1.E) h https://www.mpg.de/9873897/MPIEM_JB_2016. Der Artikel wurde mit freundlicher Zustimmung der Autorin und der MPG-Pressestelle ScienceBlog.at zur Verfügung gestellt. Er erscheint hier ungekürzt aber ohne die zugrundeliegenden, nicht frei zugänglichen Literaturstellen. Diese können im Forschungsbericht nachgelesen und auf Anfrage zugesandt werden.
Weiterführende Links
Arvid Leyh: Reiz und Rezeptor. Interaktive Darstellung : Schmerz, Temperatur, Berührung – Reize wie diese werden von unterschiedlichen Rezeptoren der Haut verarbeitet. Von dort aus geht es über das Rückenmark ins Gehirn, ein langer Weg, der doch nur drei Neurone umfasst. https://www.dasgehirn.info/wahrnehmen/fuehlen-koerper/reiz-und-rezeptor/(Lizenz: cc-by-nc)
Christian Büchel: Schmerz und Schmerzwahrnehmung. Vorlesung Video 55:26 min. (© 2013 www.dasGehirn.info; Lizenz: cc-by-nc)
Artikel im ScienceBlog
Gottfried Schatz (30.08.2012): Grausamer Hüter — Wie uns Schmerz schützt – oder sinnlos quält. http://bit.ly/1SPdpr5
- Printer-friendly version
- Log in to post comments

