Fr, 10.06.2016 - 10:45 — Knut Drescher

![]() Viele bakterielle Spezies besiedeln Oberflächen und bilden dicht gepackte Gemeinschaften, die als Biofilme bezeichnet werden. Solche Biofilme sind resistent gegen Antibiotika und machen einen Großteil der globalen bakteriellen Biomasse aus. Der Biophysiker Knut Drescher (Univ. Prof. und Forschungsgruppenleiter am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg) untersucht den Entstehungsprozess von Biofilmen, über den bisher nur wenig bekannt ist. Dieser Prozess beginnt mit der Oberflächenhaftung einer einzigen Zelle und führt nach vielen Zellteilungen zur Bildung von turmförmigen Strukturen. Wie kürzlich entdeckt wurde, ändert sich dabei die Biofilmarchitektur in einigen kritischen Phasen dramatisch.
Viele bakterielle Spezies besiedeln Oberflächen und bilden dicht gepackte Gemeinschaften, die als Biofilme bezeichnet werden. Solche Biofilme sind resistent gegen Antibiotika und machen einen Großteil der globalen bakteriellen Biomasse aus. Der Biophysiker Knut Drescher (Univ. Prof. und Forschungsgruppenleiter am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg) untersucht den Entstehungsprozess von Biofilmen, über den bisher nur wenig bekannt ist. Dieser Prozess beginnt mit der Oberflächenhaftung einer einzigen Zelle und führt nach vielen Zellteilungen zur Bildung von turmförmigen Strukturen. Wie kürzlich entdeckt wurde, ändert sich dabei die Biofilmarchitektur in einigen kritischen Phasen dramatisch.
Bakterielle Biofilme
Bakterien können Gemeinschaften bilden, in denen die Zellen von einer Polymermatrix umschlossen und eingebettet sind. Diese dreidimensionalen bakteriellen Gemeinschaften werden als Biofilme bezeichnet. Biofilme beschichten häufig die Oberflächen zwischen harten Materialien und wässrigen Lösungen sowie die Oberflächen zwischen wässrigen Lösungen und Luft.
Einige Biofilmgemeinschaften sind vorteilhaft für die menschliche Gesundheit, zum Beispiel als Teil der gesunden Haut- und Darmflora. Andere können jedoch dramatische Probleme in der Mundhöhle als Plaque hervorrufen, chronische Infektionen auslösen oder Katheter und Prothesen besiedeln. Zusätzlich können Biofilme erhebliche Kosten durch das Verfaulen von industriellen Flusssystemen und Rohren verursachen. In allen diesen Bereichen, von der Industrie bis zur Klinik, ist das Biofilmwachstum sehr schwer zu kontrollieren oder zu verhindern, da Biofilme resistent gegen diverse Arten von chemischen und physikalischen Stressen sowie gegen Antibiotikabehandlung sind.
Seitdem in den 1980er Jahren erkannt wurde, dass Biofilme allgegenwärtig sind, wird das Biofilmwachstum intensiv erforscht, wobei besonders die essentiellen Gene und die genregulatorischen Mechanismen viel Aufmerksamkeit der Forscher auf sich gezogen haben. Diese Arbeiten haben zu der Entdeckung von neuen regulatorischen Schaltkreisen und wichtigen Matrixkomponenten geführt, die beim Biofilmwachstum zentrale Rollen übernehmen. Dennoch sind viele grundlegende physikalische, chemische und biologische Faktoren, die während des dynamischen Selbstorganisationsprozesses der Biofilmentwicklung mitwirken, noch unbekannt.
Die interne und externe Architektur von Biofilmen ist vermutlich das Resultat von Wechselwirkungen zwischen dem Wachstum von einzelnen Zellen, physiologischer Differenzierung der Zellen, sekretierten Proteinen, Botenstoffen und Heterogenität in der mikroskopischen Umgebung einzelner Zellen. Versuche, diese einzelnen Faktoren und deren Interaktionen zu untersuchen, stützen sich zunehmend darauf, bakterielle Gemeinschaften in mikrofluidischen Kanälen ("haarfeine", transparente Kanäle, Anm. Red.) mikrosopisch zu untersuchen, in denen zentrale Eigenschaften der natürlichen Habitate von Biofilmen nachgebildet werden können. Seitdem ausgereifte Methoden für die Herstellung von mikrofluidischen Kanälen durch Fortschritte in der Lithographieforschung nun auch der biologischen Forschung zur Verfügung stehen, ist die größte methodische Hürde für die Erforschung der Biofilmentstehung, dass bislang keine Methoden verfügbar waren, um einzelne Zellen und deren Genexpression in Biofilmen zu untersuchen. Die meisten Biofilmstudien konnten bisher Biofilme nur als dreidimensionale „Wolken“ aus bakterieller Biomasse untersuchen – mit Ausnahme wiederum von elektronenmikroskopischen Studien, die fixierte, aber nur tote Biofilme mit hoher Auflösung beschreiben konnten. Eine Auflösung einzelner lebender Zellen innerhalb der Bakteriengemeinschaft war dadurch nicht möglich und daher ist bisher wenig über die Prinzipien der zellulären Organisation bekannt, die am Ende aus dem Wachstum von einzelnen bakteriellen Zellen makroskopische Biofilme entstehen lassen.
Globale und interne Biofilmarchitektur
Um die Architektur der Biofilme während ihrer Entstehung zu verstehen, wird eine neuartige mikroskopische Methode benötigt, um alle einzelnen Zellen in Biofilmen zu beobachten. Daher wurde für diese Aufgabe vom Leiter der Forschungsgruppe ein an die speziellen Bedürfnisse der Biofilmforschung angepasstes Mikroskop (ein konfokales Spinning-Disk Mikroskop) entwickelt, das die Einzelzellauflösung in Biofilmen und gleichzeitig nur eine schwache Photobleichung der Fluoreszenzfarbstoffe (mit denen die Zellen markiert wurden, Anm.Red.) hervorruft.
Abbildung 1 zeigt Bilder, in denen die einzelnen Zellen von Vibrio cholerae (Erreger der Cholera) Biofilmen zu sehen sind, die auf Glasoberflächen gewachsen und einem permanenten Strom von Nährmedium für 24 Stunden ausgesetzt worden sind.
 Abbildung 1:Die mikroskopische Auflösung von allen einzelnen Zellen in Vibrio cholerae Biofilmen zeigt eine charakteristische interne Architektur, in der Zellen, wie bei einer Asternblüte, eine hohen Grad an Ordnung in der Orientierung aufweisen.© Max-Planck-Institut für terrestrische Mikrobiologie/Drescher
Abbildung 1:Die mikroskopische Auflösung von allen einzelnen Zellen in Vibrio cholerae Biofilmen zeigt eine charakteristische interne Architektur, in der Zellen, wie bei einer Asternblüte, eine hohen Grad an Ordnung in der Orientierung aufweisen.© Max-Planck-Institut für terrestrische Mikrobiologie/Drescher
Um alle einzelnen Zellen automatisch zu erkennen und Merkmale wie Position, Größe, Form und Genexpression zu messen, wurde eine Bildverarbeitungssoftware entwickelt, deren Resultat eine automatisierte Zellsegmentierung darstellt (Abbildung 2).
Wachstum des Biofilms durch Zellteilung
Nach Anwendung der neuartigen Mikroskopietechnik wurde in Untersuchungen von einzelnen Zellen, die sich an Oberflächen angeheftet hatten und verschiedenfarbige Fluoreszenzproteine produzierten, entdeckt, dass sich Biofilmwachstum von V. cholerae hauptsächlich durch Zellteilung vollzieht und nicht durch das Zusammenkommen und Anheften von externen Zellen an schon existierende Biofilme. Dieses Resultat steht im Einklang mit Studien von V. cholerae Infektionen, die zur Cholera-Erkrankung führen können. In diesen wurde gezeigt, dass wenn die Versuchstiere - junge Hasen - mit V. cholerae Zellen, die verschiedene Fluoreszenzproteine exprimieren, infiziert wurden, die infektionsverursachenden Biofilme im Tierdarm hauptsächlich aus Zellen mit jeweils dem gleichen Fluoreszenzprotein bestehen.
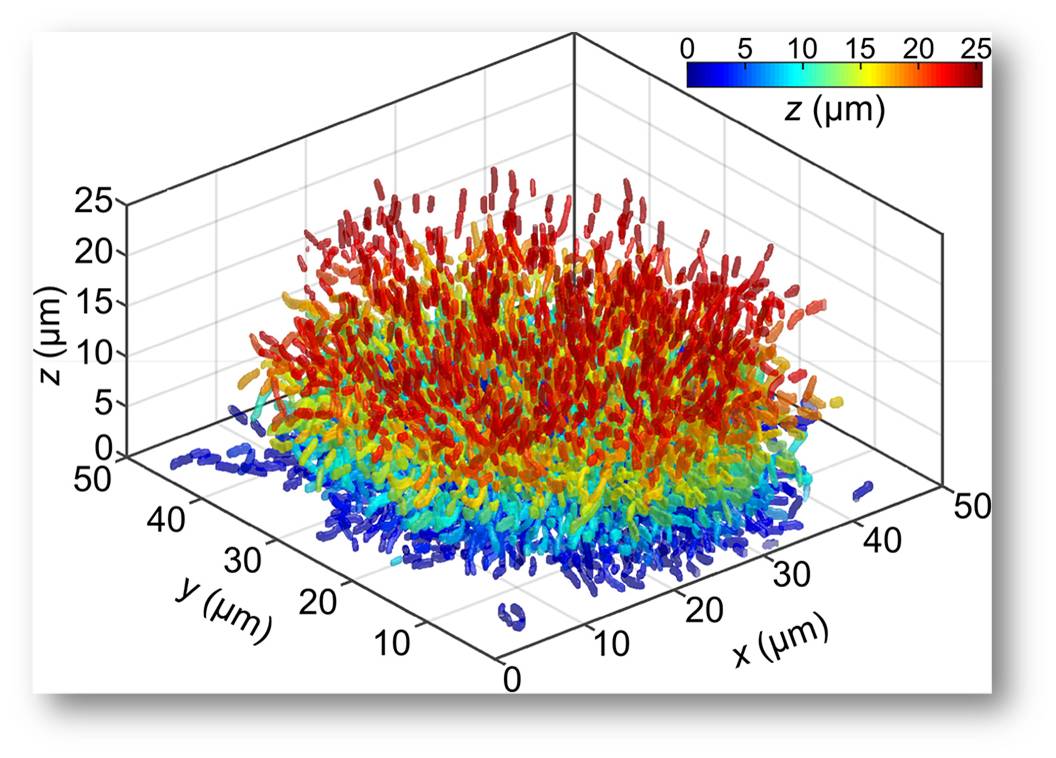 Abbildung 2: Segmentierung und Rekonstruktion von allen einzelnen Zellen des Biofilms aus Abbildung 1. Jede Zelle ist mit einer Farbe koloriert, die die Höhe des Zellzentrums (z: in micrometer) über der Glasoberfläche, auf der der Biofilm wächst, widerspiegelt.© Max-Planck-Institut für terrestrische Mikrobiologie/Drescher
Abbildung 2: Segmentierung und Rekonstruktion von allen einzelnen Zellen des Biofilms aus Abbildung 1. Jede Zelle ist mit einer Farbe koloriert, die die Höhe des Zellzentrums (z: in micrometer) über der Glasoberfläche, auf der der Biofilm wächst, widerspiegelt.© Max-Planck-Institut für terrestrische Mikrobiologie/Drescher
Dank der mikroskopischen Einzelzellauflösung und Bilderkennungssoftware konnten auch grundlegende Prozesse während des Biofilmwachstums untersucht werden. Für V. cholerae wurde entdeckt, dass das Wachstum von einzelnen Biofilmkolonien einen sehr heterogenen Zeitverlauf aufweist, obwohl eine Konstanz der mikroskopischen Umgebung innerhalb der bereits erwähnten mikrofluidischer Kanäle gewährleistet werden konnte. Anstelle der Wachstumszeit als Kontrollparameter für Biofilmdynamik konnte eine sehr genaue Korrelation der Biofilmarchitektur mit der Anzahl der Zellen in Biofilmen nachgewiesen werden. Die Zellzahl in Biofilmen erscheint also der natürliche Kontrollparameter der Biofilmdynamik zu sein.
Phasen des Biofilmwachstums von Vibrio cholerae
Durch die Erkennung und Vermessung von allen einzelnen Zellen in V. cholerae Biofilmen in verschiedenen Entwicklungsstadien konnten die grundlegenden Phasen des Biofilmwachstums entdeckt werden (Abbildung 3). Zwischen diesen Phasen erfolgen teils dramatische architektonische Veränderungen.
In Phase I wachsen die Zellen in einer eindimensionalen Linie durch Zellwachstum an den jeweiligen Zellpolen und darauffolgender mittiger Zellteilung.
Dieses eindimensionale Wachstum geht anschließend, wenn die Oberflächenadhäsion der Zellen stärker wird als die Zellpol-zu-Zellpol-Adhäsion, in ein zweidimensionales Wachstum (Phase II) über. In Phase II wachsen dann alle Zellen in einer ungeordneten zweidimensionalen Schicht.
Wenn die Oberflächenadhäsion der Zellen kleiner wird als die Kraft, die die Zellen durch ihr Wachstum aufeinander ausüben, faltet sich die zweidimensionale Zellschicht, was zu einem dreidimensionalen Wachstum des Biofilms mit zueinander ungeordneten Zellen führt. Diese Phase wird als Phase III bezeichnet.
Durch Zellwachstum innerhalb der Polymermatrix erhöht sich die Zellkonzentration erheblich und bewirkt bei Biofilmen mit mehr als 2000 Zellen einen Übergang zu einem Zustand mit hoher Ordnung in der Zellorientierung. Diese Ordnung der Zellen innerhalb größerer V. cholerae Biofilme ist in Abbildung 3, Phase IV, zu sehen: Die Zellen sind radial orientiert, zeigen in der untersten Ebene des Biofilms horizontal nach außen und im Zentrum des Biofilms vertikal nach oben. 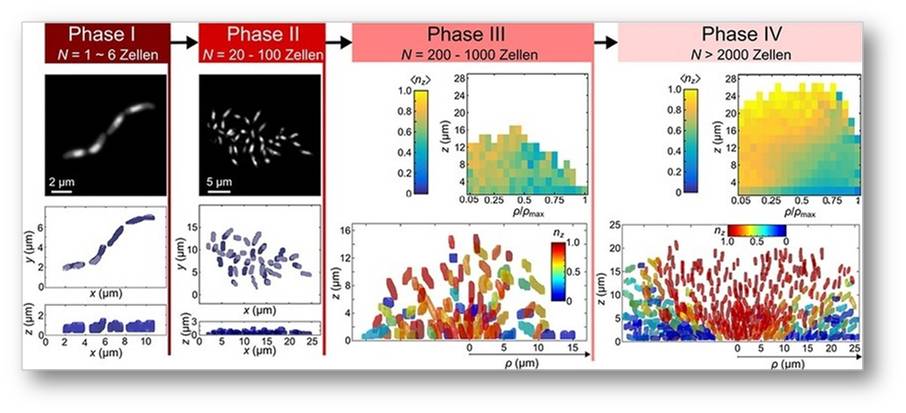
Abbildung 3: Die vier verschiedenen Wachstumsphasen von Vibrio cholerae Biofilmen. Phase I erfolgt wenn Biofilme von einer Zellzahl N = 1 bis ca. N = 6 wachsen. Phase II beschreibt das räumlich zweidimensionale Wachstum von Biofilmen mit Zellzahlen zwischen 20 und 100. Phase III beschreibt Biofilme mit 200-1000 Zellen und in Phase IV befinden sich Biofilme mit mehr als 2000 Zellen. Die räumlichen Koordinaten werden durch x, y, z dargestellt, wobei z die Höhe über der Glasoberfläche (in Mikrometer) angibt. Die Orientierung jeder Zelle wird durch die z-Komponente des Einheitsorientierungsvektors dargestellt und als nz bezeichnet. Der Mittelwert von nz von vielen Zellen an der gleichen räumlichen Position in verschiedenen Biofilmen wird als (nz) bezeichnet. Der Radius eines Biofilms in der xy-Ebene wird als ρ bezeichnet.© Max-Planck-Institut für terrestrische Mikrobiologie/Drescher
Schlussfolgerung
Die äußeren und inneren Biofilmarchitekturen durchlaufen starke Veränderungen während des Entwicklungsprozesses von einzelnen Zellen zu großen und reifen Biofilmgemeinschaften. Physikalische Mechanismen, die auf Wachstumsmechanik und Adhäsion basieren, können die architektonischen Veränderungen teilweise erklären. Wie sich jedoch die Biofilmmatrix, in der die Zellen während des Biofilmwachstums eingebettet sind, im Laufe des Entwicklungsprozesses verändert und welchen Einfluss die sich ändernde zelluläre Architektur und Matrix auf die Wirksamkeit beispielsweise von verschiedenen Antibiotikabehandlungen haben, werden zukünftige Experimente zeigen. Deren Ergebnisse versprechen die bessere Behandlung von durch Biofilmen hervorgerufenen Krankheiten.
*Der gleichnamige, aus dem eben erscheinenden Jahrbuch der Max-Planck Gesellschaft 2016 entnommene Artikel ist aufrufbar unter: Forschungsbericht 2016, https://www.mpg.de/9864442/mpi_terr_Mikro_JB_2016?c=10583665 . Der Artikel wurde mit freundlicher Zustimmung des Autors und der MPG-Pressestelle ScienceBlog.at zur Verfügung gestellt. Er erscheint hier ungekürzt aber ohne die zugrundeliegenden, nicht frei zugänglichen Literaturstellen. Diese können im Forschungsbericht nachgelesen und auf Anfrage zugesandt werden.
Weiterführende Links
Max Planck Institute for Terrestrial Microbiology, Forschungsgruppe: Bakterielle Biofilme (Knut Drescher) http://www.mpi-marburg.mpg.de/drescher
Science Action: How is bacterial quorum sensing influenced by microfluidics? (Drescher) Video (englisch) 4:46 min. https://www.youtube.com/watch?v=vKwQceN4qDE (1st Place "Science Mechanic" prize: Discover how the cell-to-cell communication between bacteria can be studied with unprecedented detail inside microfluidic chambers, in order to inhibit formation of sticky biofilms on medical devices such as catheters and stents. Produced by Team Microfluidics: Zach Donnell, David Harris, and Carey Nadell)
How bacteria form a biofilm. Video (englisch) 2:35 min. https://vimeo.com/30571458 (Andrew Dopheide , animations produced for the Centre for Microbial Innovation, at the University of Auckland, New Zealand.
Biofilm formation. Video (englisch) 4:36 min. (Banu Prakash, GIMS; (Standard YouTube Lizenz) https://www.youtube.com/watch?v=FfY19rpnbew
Microfluidics: The laboratory in the palm of your hand. Video (englisch) 3:22 min (Standard YouTube Lizenz) https://www.youtube.com/watch?v=e9eKZ3lNK-E
- Printer-friendly version
- Log in to post comments
