Fr, 07.10.2016 - 08:57 — Redaktion

![]() Der diesjährige Nobelpreis für Physiologie oder Medizin [1] geht an Yoshinori Ohsumi, der die Grundlagen zum Verständnis der Autophagie geschaffen hat. Autophagie - ein fundamentaler Mechanismus in eukaryotischen Zellen - ist ein Selbstverdauungsprozess: wenn Zellen hungern oder gestresst werden, bauen sie überschüssige und/oder beschädigte Proteine und Zellorganellen ab und erzeugen daraus neue Bausteine, die für ihr Überleben essentiell sind.
Der diesjährige Nobelpreis für Physiologie oder Medizin [1] geht an Yoshinori Ohsumi, der die Grundlagen zum Verständnis der Autophagie geschaffen hat. Autophagie - ein fundamentaler Mechanismus in eukaryotischen Zellen - ist ein Selbstverdauungsprozess: wenn Zellen hungern oder gestresst werden, bauen sie überschüssige und/oder beschädigte Proteine und Zellorganellen ab und erzeugen daraus neue Bausteine, die für ihr Überleben essentiell sind.
"The one who is finally awarded the Prize has made a discovery that has changed the paradigm in an area of physiology or medicine, one who has changed our understanding of life or the practice of medicine." Göran Hansson, Sekretär des Nobelkomitees für Physiologie oder Medizin.
Abbildung 1. Yoshinori Ohsumi (Jg.1945) , Tokyo Institute of Technology, Tokyo, Japan. http://www.ohsumilab.aro.iri.titech.ac.jp/english.html
Es kommt nicht allzu häufig vor, dass der Nobelpreis einem einzelnen Wissenschafter verliehen wird. Yoshinori Ohsumi (Tokyo Institute of Technology), der diesjährige Laureat für Physiologie oder Medizin, ist einer von gerade einmal sieben Forschern, die in diesem überaus weitem Forschungsfeld in den letzten 50 Jahren allein ausgezeichnet wurden. Abbildung 1. Ohsumis Arbeiten waren bahnbrechend: sie haben geholfen einen fundamentalen Prozess höherer Organismen - d.i. von Pilzen, Pflanzen, Tieren - aufzuklären, nämlich wie deren Zellen (eukaryotische Zellen) ihre Organellen abbauen und recyceln.
Aufbau - Abbau - Recycling
Intakte, lebende Zellen befinden sich in einem dynamischen Gleichgewichtszustand (der Homöostase), in welchem Aufbau und Abbau diverser molekularer Komponenten und subzellulärer Organellen sich die Waage halten müssen. Wie diese Komponenten - Proteine, Lipide, Zucker und diverse im Stoffwechsel aktive Moleküle - und Organellen aufgebaut werden, war ein prioritäres Forschungsgebiet des 20. Jahrhunderts und bleibt es auch weiterhin. Was aber mit diesen nun einmal aufgebauten Zellkomponenten geschieht - wenn sie Beschädigungen aufweisen, altern oder einfach nicht mehr gebraucht werden - stieß lange Zeit auf wesentlich geringeres Interesse.
Wohin also mit dem Abfall
und - in Anbetracht begrenzter Ressourcen - inwieweit kann, muss dieser wieder verwertet, recycelt werden?
Es ist dies ja ein ganz allgemeines Problem. Es gilt in gleicher Weise auch für unsere modernen Gesellschaften, die mehr und mehr Güter produzieren, für die aber das Entsorgen von unbrauchbaren und/oder überschüssigen Produkten zu einem gravierenden Problem geworden ist.
Eukaryotische Organismen haben hier eine generelle Lösung gefunden: es ist dies ein hochkonservierter Prozess, der in allen Zellen abläuft und in dessen Verlauf Strukturen in effizienter Weise abgebaut und recycelt werden.
Ab der Mitte des 20. Jahrhunderts konnte man sich daran machen zu untersuchen, wo Abbau-/Umbau-Prozesse in den Zellen stattfinden. Es standen nun geeignete Verfahren zur Verfügung, um die Strukturen im Zellinneren (Organellen) isolieren zu können und enorm verbesserte mikroskopische und analytisch-chemische Methoden zu deren Detektion und Charakterisierung. Ein Höhepunkt dieser Forschungen war die Entdeckung eines neuen Typus von Zellorganellen, den sogenannten Lysosomen, durch den belgischen Biochemiker Christian de Duve (der für diese Entdeckung 1974 den Nobelpreis erhielt). Lysosomen sind von einer Lipidmembran umgebene Kompartimente (Vesikel), die beträchtliche Teile des Cytosols (d.i. des Zellinhalts ohne Zellorganellen) einschließen und überdies eine breite Palette an Verdauungsenzymen enthalten, welche das cytosolische Material (Proteine, Lipide und Kohlehydrate) in kleine (d.h. niedermolekulare) Bruchstücke zerlegen. Diese Abbauprodukte werden aus den Lysosomen ins Cytoplasma transportiert und stehen dort als Bausteine zur Synthese benötigter neuer Moleküle zur Verfügung.
Selbstverdauung – der Begriff Autophagie wird geprägt
Etwas später wurde entdeckt, dass Lysosomen auch ganze, offensichtlich zum Abbau bestimmte Zellorganellen (beispielsweise Mitochondrien, endoplasmatisches Retikulum, Peroxisomen) enthalten können und dass ein anderer Typ von Vesikeln sich derartige Organellen einverleibt und als Fracht zum Lysosom befördert. Den Vorgang, der zur "Verdauung" und Verwertung der zelleigenen Strukturen führt, hat de Duve mit Autophagie (griechisch von "autos" - selbst und "phagein" - essen) bezeichnet, den neuen Vesikeltyp entsprechend Autophagosomen. Abbildung 2.
 Abbildung 2. Ein passendes Symbol für Autophagie/Recyceln: die Schlange, die sich selbst vom Schwanz her auffrisst ("Ouroboros"). Der Ouroboros ist ein bereits im Altertum bekanntes Symbol. Die hier gezeigte Darstellung stammt von Theodoros Pelecanos aus Synosius, einem alchemistischen Traktat (1648).
Abbildung 2. Ein passendes Symbol für Autophagie/Recyceln: die Schlange, die sich selbst vom Schwanz her auffrisst ("Ouroboros"). Der Ouroboros ist ein bereits im Altertum bekanntes Symbol. Die hier gezeigte Darstellung stammt von Theodoros Pelecanos aus Synosius, einem alchemistischen Traktat (1648).
Wie aber dieser Vorgang startet, wie er abläuft, welche Rolle die Autophagie in intakten Zellen spielt und inwieweit Störungen der Autophagie Erkrankungen hervorrufen können, an Erkrankungen beteiligt sein können, blieb bis zu den Arbeiten Yoshinori Ohsumis ein Rätsel.
Die Autophagie wird entschlüsselt
"Ich glaube, dass es grundlegende Funktionen von Zellen gibt, die von der Hefe bis hin zu den Säugetieren konserviert sein sollten. Natürlich unterscheidet sich eine Vakuole von einem Lysosom, ich dachte aber, dass fundamentale Mechanismen erhalten bleiben mussten." (Yoshinori Ohsumi [2])
Yoshinori Ohsumi hat vor rund 28 Jahren begonnen den Prozess der Autophagie zu erforschen. Als Modell dienten ihm Hefezellen, deren Vakuolen das funktionelle Äquivalent zu den Lysosomen tierischer Zellen darstellen. Hefe war für ihn ein ideales System: zur Isolierung der Vakuolen hatte er bereits als Postdoc in Gery Edelmanns Labor (an der Rockefeller-University) eine einfache Methode entwickelt und diese Vakuolen waren groß genug, um sie unter dem Lichtmikroskop untersuchen und morphologische Änderungen erkennen zu können. Für den Forscher, der nur ungern in einem hochkompetitiven Gebiet arbeiten wollte, kam hinzu, dass Hefe-Vakuolen damals als wenig interessant galten, bloß als Müllcontainer der Hefezellen gesehen wurden. Man musste also kaum mit Konkurrenz rechnen.
Dass Autophagie in Hefezellen eine Rolle spielt, konnte Ohsumi in ebenso eleganten wie einfachen Versuchen nachweisen [3] (Abbildung 3): Er induzierte den Autophagieprozess durch Nahrungsentzug, wodurch - wie er annahm - mehr und mehr abzubauendes Zellmaterial via Autophagosomen in der Vakuole landen sollte, blockierte dort aber gleichzeitig Protein-abbauende Enzyme (Proteasen). Tatsächlich kam es nun in der Vakuole zu einer hohen Anhäufung von Autophagosomen (autophagic bodies, s.u.) gefüllt mit unzerlegbarem Zellmaterial.
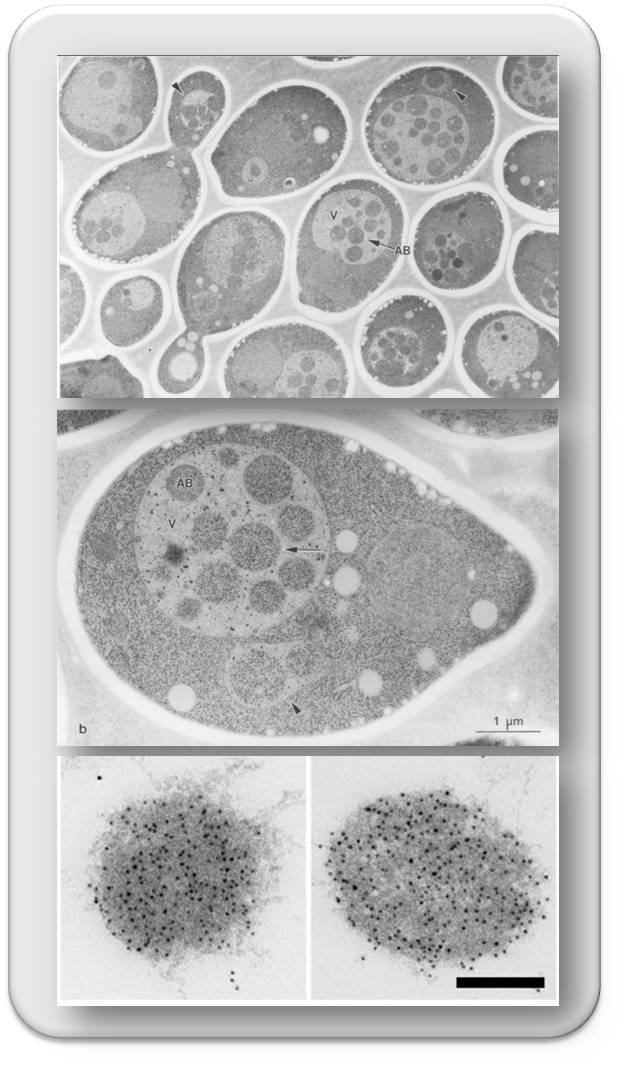 Abbildung 3. Autophagosomen in Hefezellen. Oben: Zellen unter Nährstoff(Stickstoff)mangel, deren Proteasen ausgeschaltet wurden. In den großen runden Vakuolen (V) haben sich Autophagosomen (AB - "autophagic body") angesammelt. Mitte: vergrößerte Hefezelle, wie oben (Balken: 1 micrometer). Unten: intakte Autophagosomen aus Hefezell-lysaten, die mittels eines spezifischen Fluoreszenzmarkers detektiert wurden (Balken: 0,2 micrometer). (Bilder: Oben und Mitte stammen aus: Takeshige, K. et al., (1992) [3] und stehen unter cc-by-nc-sa lizenz, Unten stammt aus Suzuku et al., [5] und steht unter cc-by Lizenz. )
Abbildung 3. Autophagosomen in Hefezellen. Oben: Zellen unter Nährstoff(Stickstoff)mangel, deren Proteasen ausgeschaltet wurden. In den großen runden Vakuolen (V) haben sich Autophagosomen (AB - "autophagic body") angesammelt. Mitte: vergrößerte Hefezelle, wie oben (Balken: 1 micrometer). Unten: intakte Autophagosomen aus Hefezell-lysaten, die mittels eines spezifischen Fluoreszenzmarkers detektiert wurden (Balken: 0,2 micrometer). (Bilder: Oben und Mitte stammen aus: Takeshige, K. et al., (1992) [3] und stehen unter cc-by-nc-sa lizenz, Unten stammt aus Suzuku et al., [5] und steht unter cc-by Lizenz. )
Sehr wichtig war auch, dass das Hefe-Genom zu dieser Zeit entschlüsselt wurde und damit die Möglichkeit gegeben war durch Mutation und Ausschalten von Genen solche Gene zu identifizieren, die eine essentielle Rolle im Autophagie Prozess spielen.
Bereits 1992/93 erschienen bahnbrechende Ergebnisse: Ohsumi und sein Team hatten 15 Gene identifiziert (Autophagie-related proteins - Atg 1 - 15), die für die Aktivierung des Autophagie-Prozesses in eukaryotischen Zellen essentiell sind [3, 4]. In den folgenden Jahren konnten dann molekulare und mechanistische Details geklärt werden, wie der Prozess aktiviert wird und welche Proteine in welcher Weise in den Prozess eingreifen und diesen regulieren.
Untersuchungen, die in der Folge auch an tierischen und pflanzlichen Zellen ausgeführt wurden, bestätigten, dass der Autophagieprozess über die Evolution hin konserviert blieb, für alle eukaryotischen Zellen gilt.
Wie läuft der Autophagieprozess ab?
Autophagie ist in allen eukaryotischen Zellen immer existent (konstitutive Autophagie), allerdings läuft der Prozess auf einem niedrigen Level . Bei Stress - verursacht etwa durch Nahrungsknappheit, Strahlen, Hitze, aber auch durch infektiöse Partikel - wird der Prozess aktiviert. Er erfordert eine weitreichende Umstrukturierung von Lipidmembranen. Abbildung 4.
 Abbildung 4. Der Autophagieprozess. Stark vereinfachtes Schema. Zellorganellen (hier Mitochondrien und endoplasmatisches Retikulum) und Proteine werden abgebaut und recycelt.
Abbildung 4. Der Autophagieprozess. Stark vereinfachtes Schema. Zellorganellen (hier Mitochondrien und endoplasmatisches Retikulum) und Proteine werden abgebaut und recycelt.
- Eine anfänglich tassenförmige Doppel-Membran (Phagophor) beginnt sich um das abzubauende Zellmaterial zu bilden und dieses in Form des sogenannten Autophagosom vom Rest der Zelle zu isolieren.
- Die äußere Membran des Autophagosoms fusioniert mit der Membran des Lysosoms/der Vakuole (oder auch des Endosoms - d.i. ein Vesikel, das durch Einstülpung der Zellmembran entsteht).
- Von der inneren Membran umgeben liegt das Autophagosom ("autophagic body") in der Vakuole. Seine Membran wird dort von Abbauenzymen angegriffen.
- Das anfänglich vom Autophagosom umschlossene Zellmaterial ist nun nicht mehr durch die Membran geschützt und wird durch die Enzyme der Vakuole/des Lysosoms abgebaut. Die Abbauprodukte werden ins Cytosol transportiert.
Was bedeutet Autophagie für die Zelle?
Autophagie ist das einzige System, das ganze Zellorganellen - wie Mitochondrien, Peroxisomen, endoplasmatisches Retikulum - und darüber hinaus langlebige Proteine abbauen kann. Da das System bei unterschiedlichsten Stresszuständen sehr rasch anspringt, kann es beschädigte Proteine und Organellen (zumeist) ausschalten, bevor diese für die Zelle toxisch werden. Autophagie ist aber auch Bestandteil physiologischer Prozesse: die Differenzierung von Zellen oder auch die Embryogenese erfordern ja weitgehendste Umstrukturierung ihrer Komponenten.
Im finalen Schritt der Autophagie entstehen Abbauprodukte, die ins Cytosol abgegeben werden und dort als Nährstoffe dienen. Sie können aber auch zu neuen Strukturen zusammengesetzt werden - etwa in der erwähnten Differenzierung, der Embryogenese oder auch um eine verbesserte Anpassung an die Umgebung zu ermöglichen.
Autophagie erhält Zellen also funktionsfähig: beschädigte und/oder nicht mehr (dringend) gebrauchte Strukturen werden abgebaut und zu Nährstoffen recycelt. Damit können Zellen auch magere Zeiten überstehen.
Wie bei allen physiologischen Vorgängen, gibt es auch Störungen des Autophagieprozesses. Diese können zu Krankheiten beitragen/diese hervorrufen, aber ebenso auch den normalen Alterungsprozess betreffen. Es funktionieren dann weder die "Müllabfuhr" noch das Recycling wichtiger Bausteine zur Zellregeneration. Derartige Störungen werden insbesondere mit verschiedenen neurodegenerativen Erkrankungen - von Parkinson, Alzheimer bis zu Huntington - assoziiert. Neuronen leben ja sehr, sehr lange und sind für die laufende Synthese ihrer im Vergleich dazu kurzlebigen Bestandteile von einer effizienten Müllabfuhr und Versorgung mit Nährstoffen abhängig. Auch an unterschiedlichsten anderen Erkrankungen von Infektionskrankheiten über Stoffwechselkrankeheiten (u.a. Diabetes) bis hin zu Krebserkrankungen dürften Anomalitäten der Autophagie beteiligt sein. Beispielsweise haben rezente Untersuchungen einen Zusammenhang zwischen Mutationen eines Autophagie-Gens und der Inzidenz von Brust- und Eierstockkrebs gezeigt.
Ausblick
Als Ohsumi vor 28 Jahren über Autophagie zu arbeiten begann, hat er ein neues Forschungsgebiet eröffnet. Von der Zeit der ersten Erwähnung durch de Duve bis dahin gab es zu diesem Thema nur einige wenige Veröffentlichungen im Jahr. Ohsumis Erfolge haben Hunderte Wissenschafter inspiriert in die Autophagie-Forschung einzusteigen: aktuell verzeichnet die Datenbank PubMed unter dem Schlagwort "Autophagy" 25 980 Publikationen in Fachzeitschriften, wobei in den letzten Jahre jeweils bis zu 4000 Arbeiten veröffentlicht wurden.
Es ist unbestritten, dass Autophagie essentiell ist, um Zellen gesund zu erhalten, dass Stresszustände Autophagie ankurbeln, dass Mutationen in Autophagie-Genen Krankheiten verursachen können. Sowohl akademische Institutionen als auch die Pharmaindustrie bemühen sich dieses Wissen therapeutisch zu nutzen, um Arzneimittel zu entwickeln, die Störungen im Autophagieprozess entgegenwirken.
[1] The Nobel Prize in Physiology or Medicine 2016. Nobelprize.org. Nobel Media AB 2014. Web. 6 Oct 2016. http://www.nobelprize.org/nobel_prizes/medicine/laureates/2016/
[2]Caitlin Sedwick (2012) Yoshinori Ohsumi: Autophagy from beginning to end. JCB 197 (2):164-5. http://jcb.rupress.org/content/197/2/164
[3] Takeshige, K., Baba, M., Tsuboi, S., Noda, T. and Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
[4] Tsukada, M. and Ohsumi, Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cervisiae. FEBS Letters 333, 169-174
[5] Suzuki K., Nakamura S., Morimoto M, Fujii K, Noda N.N., Inagaki F, Ohsumi Y, (2014) Proteomic Profiling of Autophagosome Cargo in Saccharomyces cerevisiae. Published: March 13, 2014, http://dx.doi.org/10.1371/journal.pone.0091651
Weiterführende Links
- Scientific Background Discoveries of Mechanisms for Autophagy
- Cell Death, Autophagy and CVD - BCVS 2011. Interview with Yoshimori Ohsumi . Video 4:02 min. Standard-YouTube-Lizenz
- Katie Parzych: Autophagy: How Cells Recycle to Survive Video 5:38 min (englisch, leicht verständlich) Standard-YouTube-Lizenz
- Printer-friendly version
- Log in to post comments

