Do, 23.02.2017 - 22:01 — Gero Miesenböck 
![]()
Optogenetik ist eine neue Technologie, die Licht und genetisch modifizierte, lichtempfindliche Proteine als Schaltsystem benutzt, um gezielt komplexe molekulare Vorgänge in lebenden Zellen und Zellverbänden bis hin zu lebenden Tieren sichtbar zu machen und zu steuern. Diese, von der Zeitschrift Nature als Methode des Jahres 2010 gefeierte Strategie revolutioniert (nicht nur) die Neurowissenschaften und verspricht bahnbrechende Erkenntnisse und Anwendungen in der Medizin. Gero Miesenböck, aus Österreich stammender Neurophysiologe (Professor an der Oxford University), hat diese Technologie entwickelt und zeigt hier auf, wie mit Hilfe der Optogenetik die neuronale Steuerung des Schlafes erforscht werden kann.*
Wenn Sie Puzzles wie Sudoku mögen, haben Sie wahrscheinlich die Erfahrung gemacht, dass die bloße Betrachtung eines schwierigen Problems nicht immer zur Lösung führt. Häufig ist es aussichtsreicher das Problem spielerisch anzugehen, verschiedene Lösungsansätze auszuprobieren, um dann eventuell ein Muster zu finden, das in allen Punkten genügt. Dies gilt ebenso für den Neurowissenschafter, der das Gehirn besser verstehen möchte.
Invasive Eingriffe in das Nervensystem
In der Vergangenheit haben Neurowissenschafter das Gehirn vor allem beobachtet, aber nicht damit "gespielt". Der Grund, dass es so viele Betrachtungen und so wenig invasive Eingriffe gegeben hat, liegt in der enormen Komplexität der Nervensysteme (Abbildung 1). Sogar das Hirn der kleinen Fruchtfliegen, mit denen wir arbeiten, enthält an die 100 000 Nervenzellen und Millionen von Verbindungen zwischen diesen Zellen.
 Abbildung 1. Das zentrale Nervensystem: ein undurchdringliches Dickicht aus Zellen und Verbindungen zwischen diesen Zellen.
Abbildung 1. Das zentrale Nervensystem: ein undurchdringliches Dickicht aus Zellen und Verbindungen zwischen diesen Zellen.
Wo kann man aber in einem so undurchdringlichen Dickicht zu untersuchen beginnen?
Eines der frühesten und berühmtesten invasiven Experimente steht am Beginn der Neurowissenschaften undstammt von Luigi Galvani. Galvani berichtete 1791 darüber, wie er den Schenkelnerv eines präparierten Frosches durch elektrische Impulse erregte und dabei beobachtete, dass der Schenkel zuckte. Dieses Experiment hat erstmals unwiderlegbar gezeigt, dass elektrische Impulse die Träger der Information im Gehirn sind, und dass man die Funktion des Gehirns durch Einführen von elektrischen Impulsen steuern kann. Allerdings hat das Experiment von dem Frosch nicht viel übrig gelassen. Die unserem intelligenten Verhalten zugrundeliegenden neuronalen Vorgänge wird man nur schwerlich verstehen, wenn man das ganze System auseinandernehmen muss (bottom-up Ansatz), um es untersuchen zu können.
Untersucht man die Funktion von Schaltkreisen mit Hilfe von Elektroden, die man in einem "Meer an erregbarem Gewebe" platziert, so zeigen sich viele Schwachstellen.
- Erstens ist es ein Herumstochern. Man weiß oft nicht, was sich unter der stimulierten Stelle befindet, was genau stimuliert wird.
- Für die Zahl der Elektroden, die man gleichzeitig verwenden kann,gibt es eine physikalische Grenze – bestenfalls wird man eine Handvoll Stellen steuern können. Man geht heute davon aus, dass die Rechenleistung des Gehirns auf parallelgeschalteten Prozessen vieler Nervenzellverbände beruht: diese über verschiedene Hirnregionen verteilten Systeme gleichzeitig zu kontrollieren, erscheint praktisch unmöglich.
- Ein wesentlicher Nachteil ist, dass die Spezifität des Stimulus einzig darauf beruht, wo die Elektrode sitzt. Wenn sich diese Position experimentell-bedingt verschiebt, ändert sich natürlich die Art des Einflusses. Das macht Untersuchungen an Tieren, die sich frei bewegen können, sehr schwierig.
- Ein massives Problem ist auch, dass die Versuchsanordnung keine biologische Spezifität ermöglicht. Das heißt, man kann sich nicht aussuchen, zu welcher bestimmten Klasse von Neuronen man "spricht". Man weiß nicht einmal, wie weit das Signal reicht, wie viele Zellen in der Umgebung aktiviert werden.
Die Optogenetik hat diese Schwierigkeiten überwunden: anstatt ein Signal exakt zu positionieren, versucht man definierte Nervenzellen durch genetische Manipulation für eine Stimulation sensibilisierbar zu machen.
Was ist überhaupt Optogenetik?
Zwei Bestandteile – Gene und Photonen – haben dem Gebiet den Namen Optogenetik gegeben. Allerdings nicht ganz zutreffend, da wir ja eigentlich nicht die Funktion von Genen kontrollieren, sondern die Funktion von deren Genprodukten, also von Proteinen, die in den betreffenden Zellen erzeugt werden.
Die Nervenzellen des Gehirns besitzen unterschiedliche genetische Signaturen – unterschiedliche Expressionsmuster einer Gruppe von Genen, die für bestimmte Zellpopulationen charakteristisch sind. Die Optogenetik bedient sich nun dieser Signaturen und spricht selektiv Nervenzellen an, die ein Markergen einer solchen Signatur exprimieren. Mit molekularbiologischen Methoden werden in derartige Zellen dann Ionenkanäle eingefügt, welche den Kanälen ähnlich sind, die allen elektrischen Signalen in unserem Nervensystem zugrundeliegen, mit einer wichtigen Ausnahme: Die Kanäle sind an Photorezeptoren gekoppelt (Abildung 2). Diese Photorezeptoren entsprechen in groben Zügen jenen, welche uns in unseren Augen zum Sehen befähigen. Trifft Licht auf einen solchen Rezeptor, so verändert er seine Gestalt, die Formänderung überträgt sich auf die Pore des Ionenkanals und diese öffnet sich: Ein schwacher elektrischer Strom fließt, und das Neuron feuert ein elektrisches Signal.
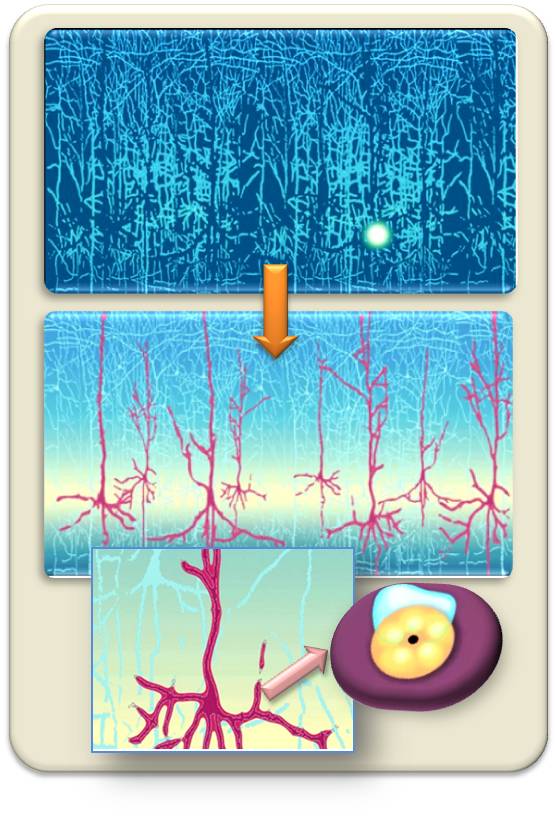 Abbildung 2. In einem Dickicht von Nervenzellen (oben) wird eine Zellpopulation anhand eines charakteristischen Markergens selektiert (pinkfarbene Neuronen, Mitte). In diese wird gentechnisch ein Ionenkanal eingefügt, der an einen Photorezeptor gekoppelt ist (unten rechts).
Abbildung 2. In einem Dickicht von Nervenzellen (oben) wird eine Zellpopulation anhand eines charakteristischen Markergens selektiert (pinkfarbene Neuronen, Mitte). In diese wird gentechnisch ein Ionenkanal eingefügt, der an einen Photorezeptor gekoppelt ist (unten rechts).
Mittels optischer Fernsteuerung lassen sich so Nachrichten an Zellpopulationen senden und lesen, auch, wenn die Zellen im Nervensystem weit von einander entfernt liegen und sich deren Positionen verändern, wenn sich ein Versuchstier bewegt. Die Zellen wissen ja, dass sie selbst die Zielobjekte der Stimulation sind; sie decodieren die Signale und wandeln sie in elektrische Energie um.
Optogenetik öffnet drei bisher versperrte experimentelle Zugänge zum Verständnis des Gehirns
Auffinden der Ursachen des Verhaltens
Optogenetik macht es möglich die Ursachen festzustellen, die intelligentem Verhalten zugrundeliegen. In der Biologie gilt die Rekonstitution eines Systems häufig als strengster Beweis einer Kausalität. Will man als Biochemiker demonstrieren, dass ein bestimmtes Molekül kausal in einem bestimmten Prozess involviert ist, so stellt man dieses Molekül rein her, fügt es dem Testsystem zu und beobachtet, ob man so den Prozess ablaufen lassen kann.
Die Optogenetik ist für den Neurobiologen das Äquivalent der Rekonstitution. Optogenetik erlaubt es – metaphorisch gesprochen – Erregungsmuster, die normalerweise Lebensvorgängen zugrundeliegen, "rein darzustellen", sie ins Hirn zurückzuspielen und zu sehen, ob man auf diese Weise Wahrnehmung, Handeln, Emotion, Gedanken und Gedächtnis rekonstruieren kann.
Gelingt dies, kann man plausibel argumentieren, die unseren Verhaltensweisen zugrundeliegenden Informationsmuster verstanden zu haben.
Auffinden von interneuronalen Verbindungen
Ein zweiter bisher verschlossener Zugang befähigt uns, Verbindungen zwischen den Neuronen zu kartographieren – eine Voraussetzung für die Entschlüsselung der Schaltkreise im Gehirn. Die klassische Methode, nach verknüpften Partnern mittels zweier einzeln platzierter Elektroden zu suchen, ist äußerst mühsam, die Wahrscheinlichkeit solche Zellen aufzufinden sehr gering. Wird nun eine der Elektroden durch einen Lichtstrahl ersetzt, der über das Gewebe rastert und – wann immer er auf einen verbundenen Partner trifft – einen Impuls auslöst, so werden Durchsatz und Spezifität der Suche um Größenordnungen erhöht.
Auffinden von neuronalen Mechanismen
Der dritte Zugang, den wir mit Hilfe der Optogenetik öffnen konnten, ermöglicht die Suche nach neuronalen Mechanismen. Wenn man eine Idee hat, wie ein neuronales System arbeiten könnte, dann kann eine gezielte Manipulation des Systems zeigen, ob man recht oder unrecht hat.
Was dank der technologischen Fortschritte heute bereits möglich ist, möchte ich im Folgenden an Hand eines Beispiels aus unserer rezenten Forschung darstellen, das alle drei Fortschritte veranschaulicht:
Die neuronale Steuerung des Schlafes
Schlaf ist eines der großen biologischen Rätsel. Jede Nacht melden wir uns für 7 - 8 Stunden von der Außenwelt ab - ein Zustand, der uns verwundbar und handlungsunfähig macht, also Risiken und Kosten mit sich bringt. Stellen Sie sich vor, die Evolution hätte ein Tier hervorgebracht, das ohne Schlaf auskommt. Dieses Tier würde alle anderen übertreffen: während die anderen schlafen, könnte es jede Ressource aufstöbern und Feinde außer Gefecht setzten. Die Tatsache, dass es kein derartiges Tier gibt, sagt uns, dass Schlaf etwas Lebenswichtiges ist. Was dieses lebenswichtige Etwas ist, wissen wir jedoch nicht.
Wir versuchen an dieses Problem heranzugehen, indem wir die neuronalen Mechanismen verstehen möchten, die normalerweise Schlafen und Wachen steuern. In allen mit Gehirnen ausgestatteten Lebewesen gibt es dafür zwei Steuerungssysteme, die in unterschiedlicher Weise oszillieren. Abbildung 3.
- Eine Sinuskurve charakterisiert die zirkadiane Uhr – die innere Uhr –, die synchron mit den vorhersehbaren, durch die Erdrotation verursachten Änderungen der Umwelt oszilliert. Als solcher ist dies ein adaptiver Mechanismus, der uns schlafen lässt, wenn es am wenigsten problematisch ist. Er löst er aber nicht das Rätsel, warum wir überhaupt schlafen müssen, um zu überleben..
- Die Lösung dieses Rätsels wird wahrscheinlich kommen, wenn wir das zweite Kontrollsystem – den Schlafhomöostat – verstehen, der dem zirkadianen System überlagert ist. Während der Wachphase geschieht etwas (wir wissen nicht, was es ist) in unserem Gehirn oder unserem Körper, und wenn dieses Etwas einen Schwellwert erreicht, schlafen wir ein. Während des Schlafes erfolgt ein Zurückstellen des Systems, und der Zyklus beginnt von Neuem, wenn wir erwachen.
 Abbildung 3. Schlaf und Wachen werden in allen Lebewesen durch zwei oszillierende Steuerungssysteme- die zirkadiane Uhr (untere Sinuskurve) und den Schlafhomöostat (überlagerte Kurve) – reguliert.
Abbildung 3. Schlaf und Wachen werden in allen Lebewesen durch zwei oszillierende Steuerungssysteme- die zirkadiane Uhr (untere Sinuskurve) und den Schlafhomöostat (überlagerte Kurve) – reguliert.
Unter normalen Bedingungen wird uns nicht bewusst, dass wir diese beiden Kontrollsysteme in uns haben, da sie synchron verlaufen. Ein Interkontinentalflug oder eine durchwachte Nacht können aber eine Phasenverschiebung induzieren, und dann stoßen zirkadiane Uhr, die uns wachhält, und Schlafhomöstat, der uns einschlafen lassen will, zusammen und ergeben eine unerfreuliche Mischung von extremer Müdigkeit und Schlaflosigkeit.
Nach mehr als vier Jahrzehnten Forschung ist die Funktionsweise der zirkadianen Uhr auf der molekularen, sowie der zellulären und Systemebene bereits gut verstanden. Im Gegensatz dazu war bis vor Kurzem über den Schlafhomöostat praktisch nichts bekannt.
Steuerung von Schlafen und Wachen am Modell der Fruchtfliege
Vor einigen Jahren hat Jeff Donlea Nervenzellen im Gehirn der Fliege entdeckt, die den Schlaf steuern. Mittels Optogenetik konnten wir zeigen, dass diese Zellen die Outputfunktion des Schlafhomöostaten darstellen (Abbildung 4). Überraschend ist die kleine Zahl der Zellen: von insgesamt 100 000 Neuronen sind es bloß 24. Dennoch, wenn man diese Zellen (wie oben beschrieben) mit Licht stimuliert, schlafen die Fliegen sehr schnell ein.
Wir untersuchen dies auf folgende Weise: wir fixieren eine Fruchtfliege an ihrem Kopf, unter ihren Beinen ist eine drehbare Styroporkugel, auf der sie läuft, solange sie wach ist (Abbildung 4, oben links) die Rotationen der Kugel zeichnen wir optisch auf. Gleichzeitig messen wir die elektrische Aktivität des Gehirns: bei geöffneter Kopfkapsel haben wir in eine der 24 schlafsteuernden Zellen eine Messelektrode platziert; zusätzlich haben wir in alle 24 Zellen die Licht-sensitiven Ionenkanäle eingebaut (Abbildung 4, oben rechts). Solange wir das Licht nicht einschalten, produzieren diese Ionenkanäle keine elektrischen Ströme, und die Fliege läuft munter dahin. Sobald das Licht angeschaltet wird, beginnen die Zellen elektrische Impulse auszusenden, und die Bewegungen des Tieres hören sehr schnell auf – das Tier schläft (Abbildung 4, unten). Schalten wir das Licht wieder aus, so stoppt die elektrische Aktivität,die Fliege erwacht und läuft, schalten wir es ein, schläft die Fliege. Wir haben also einen Schalter gefunden, der es uns erlaubt, mittels optogenetischer Steuerung das Tier zwischen Schlaf und Wachen hin- und herzuschalten.
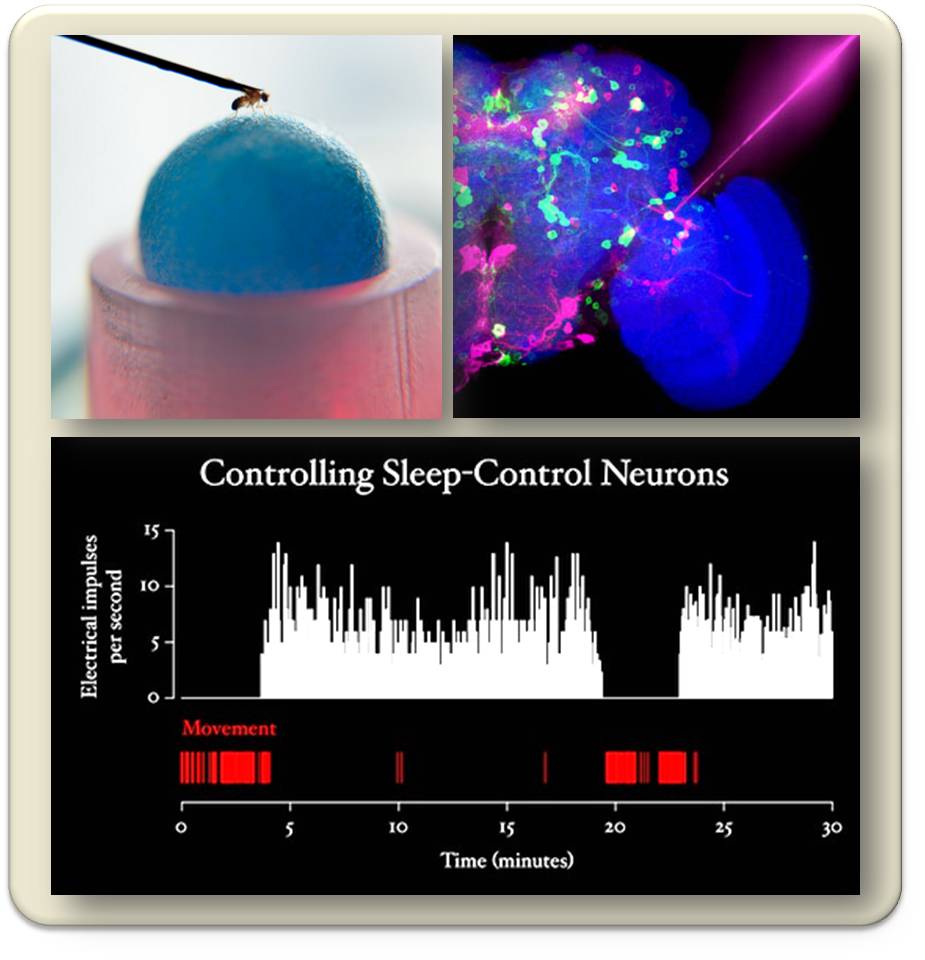 Abbildung 4. Optogenetische Fernsteuerung von Schlaf- und Wachphasen der Fruchtfliege. In denschlafsteuernden Neuronen (oben rechts, pinkfarben) sind die Licht sensitiven Ionenkanäle exprimiert, Solange diese Zellen nicht stimuliert werden, läuft das Tier auf der Kugel (oben links), deren Rotation aufgezeichnet wird (rote Linien, unten). Durch Licht werden die Zellen sofort aktiviert, senden elektrische Impulse aus und die Rotation hört schlagartig auf - das Tier schläft (unten).
Abbildung 4. Optogenetische Fernsteuerung von Schlaf- und Wachphasen der Fruchtfliege. In denschlafsteuernden Neuronen (oben rechts, pinkfarben) sind die Licht sensitiven Ionenkanäle exprimiert, Solange diese Zellen nicht stimuliert werden, läuft das Tier auf der Kugel (oben links), deren Rotation aufgezeichnet wird (rote Linien, unten). Durch Licht werden die Zellen sofort aktiviert, senden elektrische Impulse aus und die Rotation hört schlagartig auf - das Tier schläft (unten).
In weiteren Untersuchungen haben wir entdeckt, dass die schlafsteuernden Nervenzellen auch unter natürlichen Bedingungen in zwei Zuständen vorliegen: im aktiven Zustand senden sie elektrische Impulse aus, im anderen Zustand sind sie elektrisch inaktiv. Da diese Zustände exakt mit Schlaf und Wachen der Tiere korrelierten, erschien es wahrscheinlich, dass dieses Schalten zwischen den beiden Zuständen – ein rein biophysikalischer Vorgang – der Mechanismus der homöostatischen Schlafsteuerung sein könnte. Was ist aber das Signal, das ein Umschalten auslöst?
Dopamin – Schalter zwischen Schlaf und Wachen
Ein Hinweis, was dieses Signal sein könnte, kam aus bereits länger zurückliegenden Experimenten, in denen erstmals (von meiner Studentin Susana Lima) das Verhalten eines Lebewesens optogenetisch kontrolliert wurde. Susana untersuchte unter anderem die Funktion des Neurotransmitters Dopamin. Dopamin führte zu hoher Erregung der Tiere; sobald die dopaminproduzierenden Zellen optogenetisch eingeschaltet wurden, liefen Fruchtfliegen wie verrückt im Kreis. Dies entspricht auch der erregenden Wirkung von Dopamin in unserem Gehirn: Psychostimulantien, die uns wach halten, wie beispielsweise Kokain oder Amphetamin, wirken, indem sie die Wiederaufnahme von Dopamin in den Synapsen blockieren (und damit länger aktivierende Wirkung auf die Dopaminrezeptoren erzielen; Anm. Red.)
Falls Dopamin ein auf den Schlafschalter wirkendes Erregungssignal ist,so sollte seine Zufuhr die schlafinduzierenden Zellen abschalten und zum Erwachen führen. Anatomisch gesehen ist das plausibel: Dopaminerge Neuronen, die Dopamin liefern könnten, finden sich in derselben Hirnregion wie die schlafproduzierenden Zellen, und beide Neuronentypen liegen so dicht beieinander, dass man den Eindruck gewinnt, sie seien miteinander verbunden. Die Optogenetik ermöglicht uns dies zu prüfen, indem wir die Aktivität der schlafproduzierenden Zellen aufzeichnen, während wir die dopaminergen Zellen mittels Licht erregen. Eine synaptische Signalübertragung von der dopaminergen auf die schlafproduzierende Zelle sollte deren elektrische Aktivität stilllegen und zum Erwachen führen.
Dies ist tatsächlich der Fall. Fliegen, die am Beginn des Experiments schlafen, werden durch das Lichtsignal auf die dopaminerge Zelle sofort geweckt, beginnen zu laufen und verharren auch nach dem Stop des Lichtsignals über längere Zeit - bis zu einigen Stunden - im Wachzustand. Das System hat also ein Gedächtnis.
Welcher Mechanismus ist dabei am Werk?
Der Sandmann kommt
Kurzgesagt: wir haben einen neuen Kanal für Kaliumionen entdeckt, den wir Sandmann getauft haben. Ist die schlafproduzierende Zelle im elektrisch aktiven Zustand, befindet sich der Kanal im Inneren der Zelle, in den Membranen von Vesikeln. Wenn Dopamin ausgeschüttet wird und an seinen Rezeptor in der Zellmembran bindet, fusionieren die Vesikel mit der Zellmembran, Sandmann wird in die Zellmembran integriert und erzeugt einen Kurzschluss, der die Zellen abschaltet. (Abbildung 5).
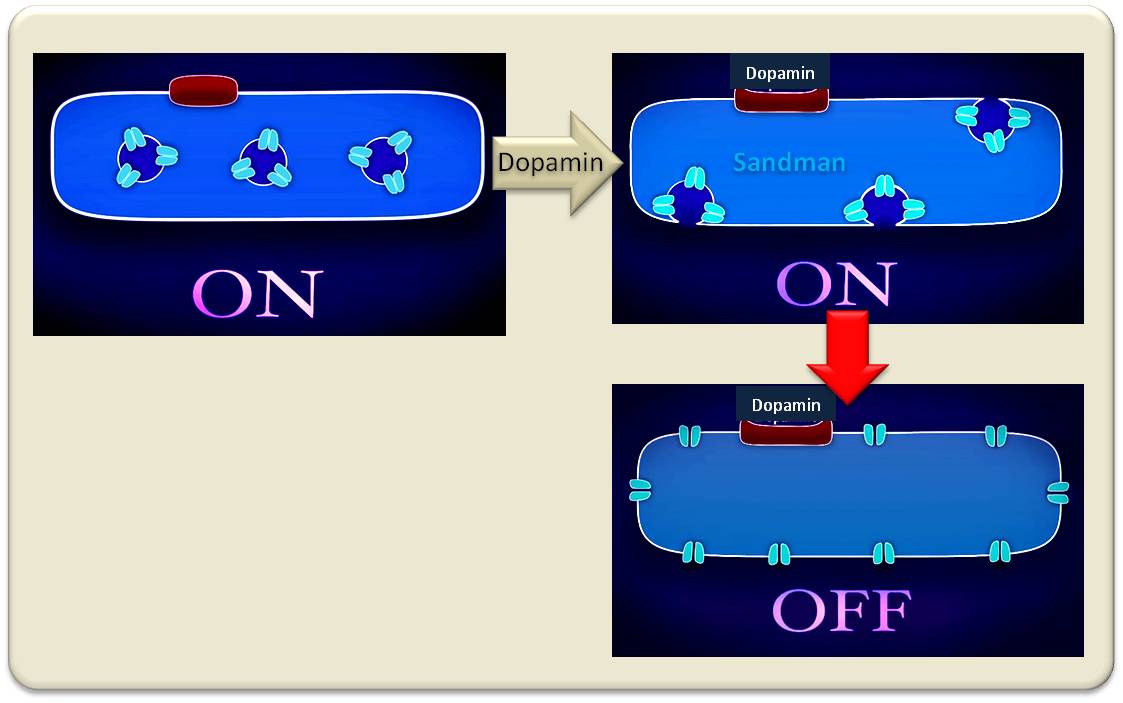 Abbildung 5. Der Sandmann kommt. Ein biophysikalisch erklärbarer Mechanismus schaltet vom Schlaf- zum Wachzustand
Abbildung 5. Der Sandmann kommt. Ein biophysikalisch erklärbarer Mechanismus schaltet vom Schlaf- zum Wachzustand
Es ist der Mechanismus, der dem Aufwachen zugrundeliegt.
Was ich hier beschrieben habe, gleicht einer bekannten Vorrichtung an der Wohnzimmerwand, dem Thermostaten. Es wird hier aber nicht die Temperatur gemessen und die Heizung angeschaltet, wenn es kalt ist. Der Schlafhomöostat misst Etwas, und wenn dieses Etwas einen Schwellenwert erreicht, schaltet er auf Schlaf (Abbildung 6).
 Abbildung 6. Der Schlafhomöostat. Die rote Linie zeigt die Schlafphase, in der die Neuronen elektrische Impulse aussenden,und die Wachphase, in der die Zellen ruhig gestellt sind.
Abbildung 6. Der Schlafhomöostat. Die rote Linie zeigt die Schlafphase, in der die Neuronen elektrische Impulse aussenden,und die Wachphase, in der die Zellen ruhig gestellt sind.
Was dieses Etwas ist, wissen wir noch nicht.
Zumindest wissen wir aber, wo wir suchen müssen, um das Rätsel zu lösen.
*Eine ausführlichere Darstellung des Themas findet sich in dem Vortrag "Lighting up the Brain",den der Autor im November 2016 anlässlich der Verleihung des Wilhelm-Exner Preises an ihn gehalten hat: Gero Miesenböcks Exner LectureVideo (englisch) 31:09 min .
Method of the Year 2010, Nature Methods 8,1(2011) doi:10.1038/nmeth.f.321 http://www.nature.com/nmeth/journal/v8/n1/full/nmeth.f.321.html
Weiterführende Links
Gero Miesenböck homepage: http://www.cncb.ox.ac.uk/people/gero-miesenboeck/
Was ist Optogenetik? DFG: SPP 1926 http://www.spp1926.org/public-outreach-deutsch/
PNAS Journal Club: “Sandman” molecule controls when fruit flies wake up. (26.08.2016) http://blog.pnas.org/2016/08/journal-club-sandman-molecule-controls-when-fruit-flies-wake-up/
Videos:
Re-engineering the Brain. TED-Talk (07.2010) Video 17:27 min. http://www.ted.com/talks/gero_miesenboeck
Lights out! An optogenetic sleep switch, Prof. Gero Miesenböck. In a decade and a half, optogenetic control of neuronal activity has developed from a far-fetched idea to a widely used technique. Prof. Miesenböck explains how this happened, drawing on the earliest and latest results from his lab. Video (17.06.2016; SwissTech Convention Center, Lausanne, Switzerland), 16:53 min.
- Printer-friendly version
- Log in to post comments
