Fr.29.12.2023 — Inge Schuster
Hämoglobin, der in den Erythrozyten zirkulierende Transporter von Sauerstoff, wird offensichtlich auch in anderen Zelltypen produziert. Eine neue Untersuchung zeigt erstmals, dass Hämoglobin in den obersten Schichten der Epidermis und auch in den Haarfollikeln gebildet wird. Es wird als Antwort auf oxidativen Stress - wie er beispielweise durch UV-Bestrahlung entsteht - in den Keratinozyten hochreguliert und kann dort die Generierung von reaktiven Sauerstoff-Spezies hemmen und die Zellen vor deren Folgen schützen. Die Expression von Hämoglobin ist somit eine neue Facette in der Barrierefunktion der Epidermis.
Mit Hämoglobin verbindet wohl jeder sofort den Blutfarbstoff in den roten Blutkörperchen, den Erythrozyten, der den in der Lunge eingeatmeten Sauerstoff (O2) über den Blutkreislauf zu den Zellen unserer Gewebe und Organe transportiert. Die ununterbrochene Versorgung mit Sauerstoff ist unabdingbar, um die zur Instandhaltung und zum Funktionieren unserer Körperzellen nötige Energie in den Mitochondrien (über Zellatmung und oxydative Phosphorylierung) zu erzeugen; Sauerstoff ist aber auch unentbehrlich, um die zahllosen Oxydationsvorgänge im Stoffwechsel - zu Synthese und Metabolismus von körpereigenen Substanzen und zum Abbau von Fremdstoffen - zu ermöglichen. Für den Sauerstofftransport steht dabei eine sehr hohe Kapazität zur Verfügung: Erythrozyten bestehen zu etwa 90 % (ihres Trockengewichts) aus Hämoglobin und machen bis zu 50 % des Blutvolumens aus; das entspricht 120 bis 180 Gramm Hämoglobin pro Liter (von insgesamt 5 Liter) Blut, wobei ein Gramm Hämoglobin 1,34 ml Sauerstoff binden kann, und ein Erwachsener bei körperlicher Ruhe rund 280 ml Sauerstoff pro Minute einatmet. Im Gegenzug zur Abgabe von Sauerstoff bindet Hämoglobin einen Teil (rund 23 %) des bei der Zellatmung freiwerdenden CO2, das dann über das Blut in die Lunge transportiert und dort abgeatmet wird.
Zur Charakterisierung von Hämoglobin
Seine lebensnotwendige Rolle und hohe Verfügbarkeit haben Hämoglobin zu einem der meistuntersuchten Proteine der letzten 150 Jahre gemacht. Dazu gehört auch, dass die ersten Röntgenkristall-Analysen von 3D-Proteinstrukturen an Hämoglobin (durch Max Perutz) und dem strukturverwandten, einfacher aufgebauten Myoglobin - dem Sauerstoff-Speicher in der Muskulatur - (durch John Kendrew) stattfanden und 1962 mit dem Nobelpreis ausgezeichnet wurden.
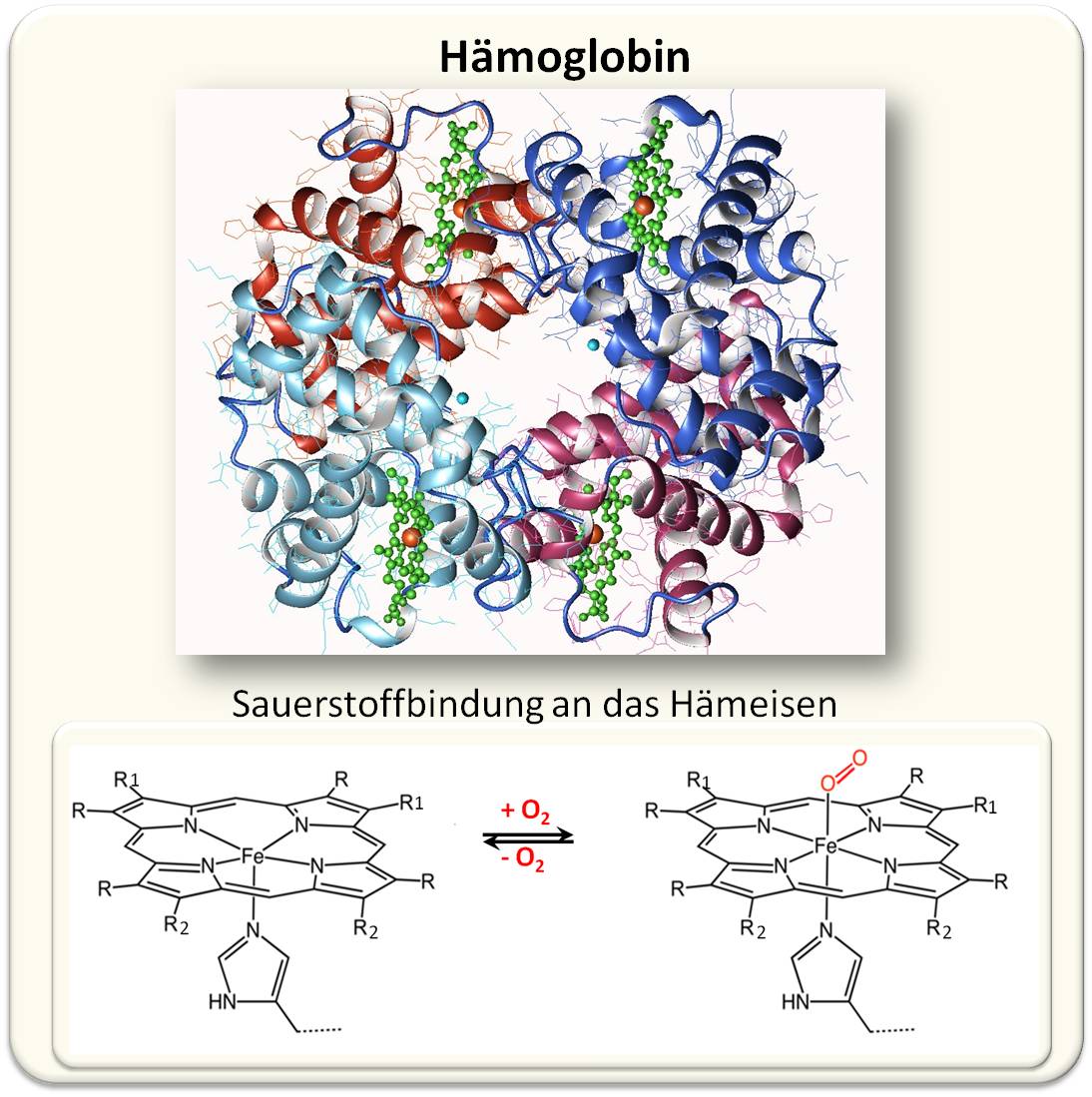
| Abbildung 1. Hämoglobin A (adulte Form - HbA) als Sauerstofftransporter. Das Bändermodell zeigt ein Tetramer aus je 2 αund 2 β Untereinheiten (Rot- und Blautöne), in die jeweils eine Hämgruppe - ein Protoporphyrin (grün) mit zentralem Eisenatom (rot) - über einen Histidinrest des Globins gebunden vorliegt. Sauerstoff bindet reversibel in der O2-Form an die 6. Koordinationsstelle des Hämeisens. (Bild: Fermi, G., Perutz, M.F. https://www.rcsb.org/structure/3hhb Lizenz: cc-by-sa) |
Demnach ist Hämoglobin aus 4 Untereinheiten aufgebaut; beim erwachsenen Menschen sind das jeweils 2 Hb α und 2 Hb β Globine. Jede dieser Untereinheiten besteht aus 142 bis 146 Aminosäuren langen Peptidketten, die jeweils 8 Helices bilden mit einer Tasche, in der das Häm - ein Porphyrin-Molekül mit einem Eisen Fe2+ als Zentralatom - eingebettet ist. Abbildung 1.
An Hämoglobin wurde in den 1960er-Jahren auch erstmals das Phänomen einer kooperativen Bindung entdeckt; im konkreten Fall: Wenn Sauerstoff als O2-Molekül an das Hämeisen einer Untereinheit bindet, induziert es darin eine Konformationsänderung, die sich auf die anderen 3 Untereinheiten überträgt und dort eine erleichterte Bindung der anderen 3 Sauerstoffmolküle zur Folge hat.
Hämoglobin kann auch andere chemische Gruppen binden und transportieren: Direkt an das Hämeisen binden beispielsweise Kohlenmonoxid (CO), Cyanid (CN-) oder Sulfid (S2-), hemmen dadurch die Bindung von Sauerstoff mit schwerwiegenden Folgen. An Aminogruppen der Globine binden Moleküle wie CO2 und das Signalmolekül Stickstoffmonoxid (NO), ein gefäßerweiterndes Gas.
Hämoglobin fungiert nicht nur als Transporter
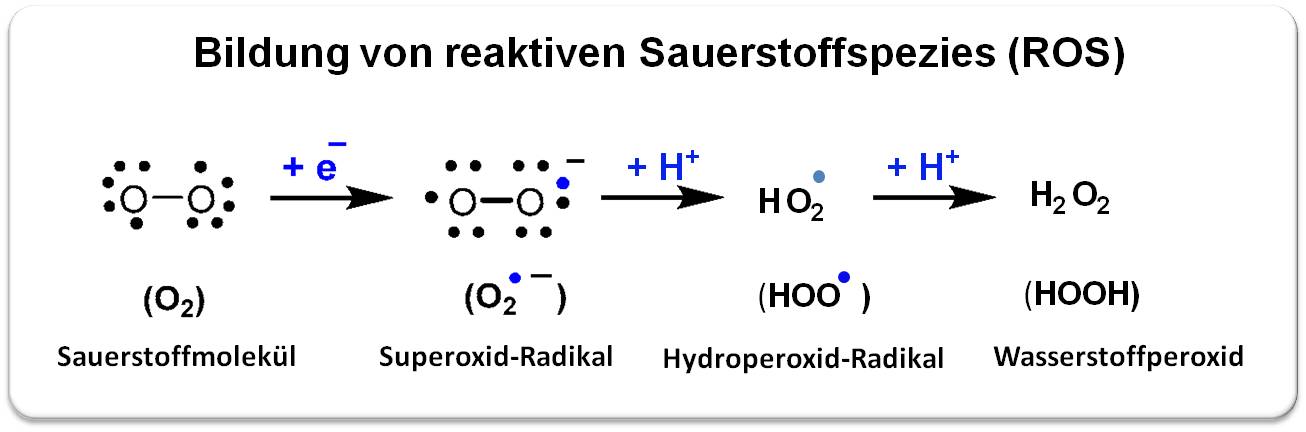
Es generiert auch reaktive Sauerstoffspezies. Bei der Bindung von Sauerstoff kommt es häufig zur Autooxidation von Hämoglobin: dabei wird das Hämeisen Fe2+ zu Fe3+ oxidiert (Methämoglobin) und gleichzeitig Sauerstoff zum Superoxid-Radikal reduziert, aus dem dann das Hydroperoxid-Radikal und in weiterer Folge Wasserstoffperoxid entstehen. Abbildung 2.
| Abbildung 2. Die Bindung von Sauerstoff an das Hämeisen führt häufig zur Generierung von reaktiven Sauerstoffspezies (ROS). Vereinfachte Darstellung. |
Die reaktiven Sauerstoffspezies reagieren (nicht nur) mit Hämoglobin und lösen eine Kaskade oxidativer Reaktionen aus, die zum Abbau des Häms, Freisetzung des Hämeisens (das freie Radikalreaktionen katalysiert), irreversiblen Vernetzungen der Globinketten und schlussendlich zum Abbau von Hämoglobin führen. Diese Reaktionen treten auch auf, wenn Hämoglobin oder Erythrocyten mit exogenem Wasserstoffperoxid reagieren, wie er bei anderen metabolischen Vorgängen (beispielsweise in den Mitochondrien) produziert wird und sogar, wenn Erythrozyten gelagert werden. Allerdings - solange Hämoglobin eingeschlossen in den Erythrozyten zirkuliert, schützt ein äußerst wirksames antioxidatives Abwehrsystem aus diversen Enzymen und endogenen niedermolekularen Substanzen wie Glutathion, Vitamin C, Coenzym Q10, etc. vor den kontinuierlich entstehenden reaktiven Sauerstoffspezies. Übersteigt die ROS-Produktion die Kapazität des Abwehrsystems, kommt es zu einer Beeinträchtigung der Sauerstoffzufuhr, Schädigung der Erythrozytenmembran verbunden mit dem Austritt von (geschädigtem) Hämoglobin und anderen Biomolekülen sowie ROS, die Entzündungsprozesse auslösen können.
Die Reaktion von Hämoglobin mit H2O2, die zur Zerstörung des Proteins führt, bedeutet gleichzeitig ein hochwirksame Neutralisierung von ROS und Schutz vor deren schädlichen Auswirkungen.
Hämoglobin wird auch außerhalb der Erythrozyten produziert.....
Dass Hämoglobin außerhalb der im Blutkreislauf zirkulierenden Erythrozyten eine Rolle spielt, war lange unbekannt. Erst in den letzten beiden Jahrzehnten zeigen mehr und mehr Untersuchungen, dass Hämoglobin in vielen, nicht den Erythrozyten oder ihren Vorläuferzellen angehörenden Zelltypen exprimiert wird [1]. Detektiert wurde Hämoglobin oder seine Untereinheiten Hb α und Hb β u.a. in Makrophagen, in Epithelzellen der Alveolen in der Lunge, im Pigmentepithel der Retina, in den Mesangialzellen der Niere, in Leberzellen, in Neuronen und Gliazellen, in der Schleimhaut der Gebärmutter und des Gebärmutterhalses, in den Chondrozyten des Knorpelgewebes und nun kürzlich in den Keratinozyten der obersten Hautschichten der Epidermis [2].
Die Funktion, die Hämoglobin in den einzelnen Zelltypen ausüben dürfte, reicht von Speicherung und Abgabe von Sauerstoff in spärlich durchbluteten Geweben (z.B. durch Hämoglobinkondensate in den Chondrozyten der Knorpelsubstanz [3]) über die Inaktivierung von reaktiven Sauerstoffmolekülen (H2O2, Hydroxyl-Radikal, Superoxid-Anion) bei oxidativem Stress (z.B: in Hepatozyten [1]) und von Stickoxiden (z.B. in der Lunge [4]) bis hin zu antibiotischen und antiviralen Eigenschaften von Peptiden, die durch Proteasen vom Hämoglobin abgespalten werden [5]. Je nach Zellstatus kann das Ausmaß der Hämoglobin-Expression variieren und bei erhöhtem Sauerstoffbedarf oder als Antwort auf oxidativen Stress/Entzündung hochreguliert werden.
... in Keratinozyten trägt es zur epidermalen Barriere gegen Umweltbelastungen bei....
Unsere Haut bildet eine hochwirksame Barriere gegen Umweltbelastungen - von Trockenheit, hoher Sauerstoffbelastung über Fremdstoffe, Mikroorganismen bis hin zur UV-Bestrahlung. Anpassung an diese Gegebenheiten haben im Laufe der Evolution die ausgeprägte mehrschichtige Struktur der obersten Hautschichte, der Epidermis geschaffen. Dieses hauptsächlich aus Keratinozyten bestehende Epithel, das bei uns Menschen unglaublich - im Mittel nur rund 0,1 mm - dünn ist [6], ist die eigentliche Barriere - die epidermale Barriere - gegen die Außenwelt. Die tiefste einzellige Schicht, das Stratum basale, besteht aus Keratinozyten, die sich aus Stammzellen heraus kontinuierlich und rasch teilen. Dadurch werden Zellen laufend nach außen in obere Schichten gedrängt, wobei sie aufhören sich zu teilen und einen Differenzierungsprozess durchlaufen, der sie innerhalb von rund einem Monat von Zellen des Stratum spinosum über Zellen des Stratum granulosum schließlich zu abgestorbenen verhornten Zellen im Stratum corneum umwandelt, die als Schuppen abgeschiefert werden (siehe dazu Abbildung 3 und auch [7]). Seit mehr als 50 Jahren wird über das Differenzierungsprogramm, die darin vom Stratum basale weg bis hin zur Verhornung involvierten Gene und die sich daraus entwickelnden Barrierefunktionen der epidermalen Schichten geforscht - viele Gene sind jedoch noch nicht entdeckt, weil es schwierig war terminal differenzierte Keratinozyten in ausreichender Menge für die Transkriptomanalyse zu erhalten.
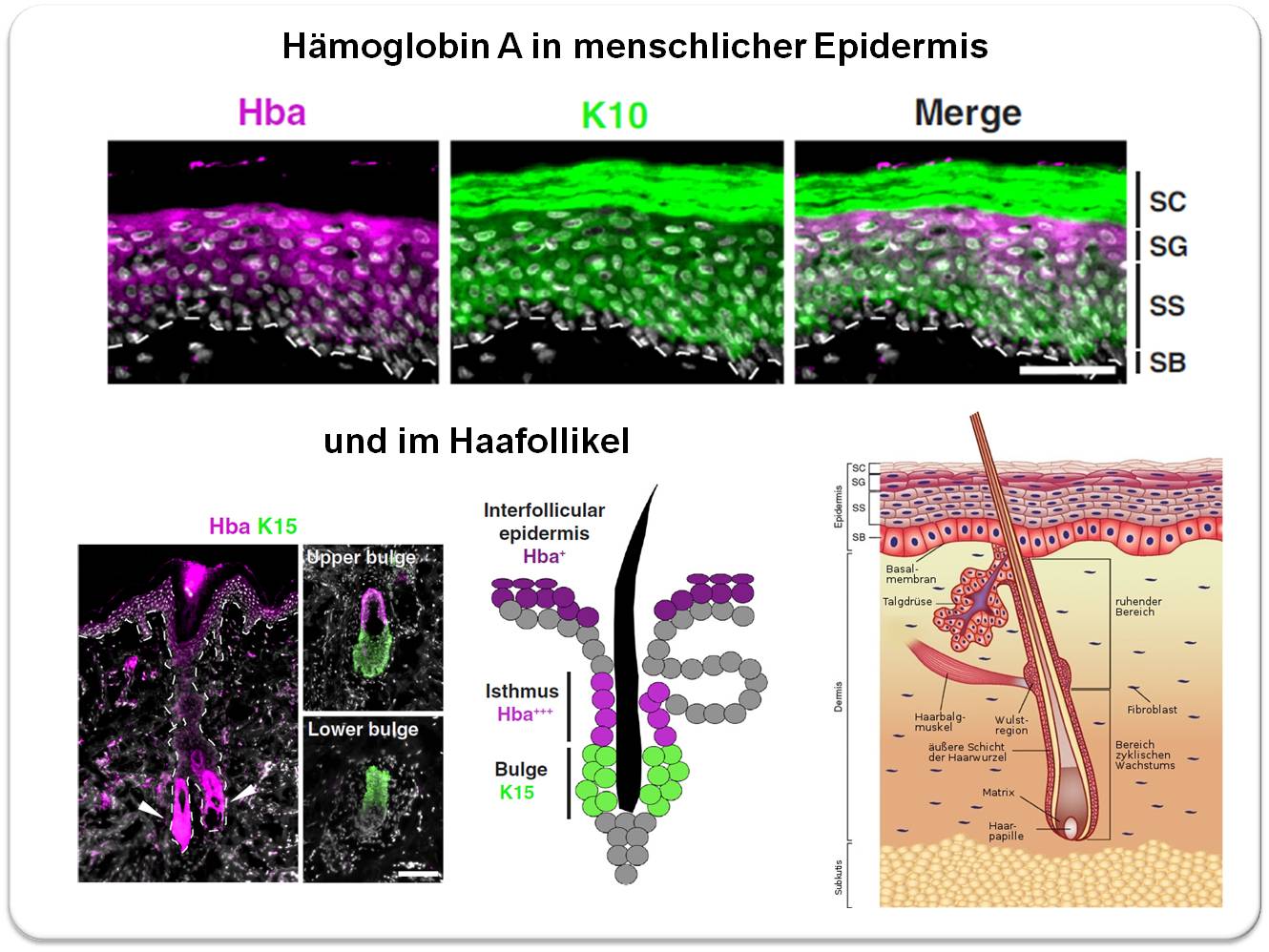
Ein japanisches Team um Masayuki Amagai (RIKEN Center for Integrative Medical Sciences, Yokohama) hat kürzlich über eine umfassende Untersuchung der Gene, die in den zunehmend differenzierten Schichten der oberen Epidermis exprimiert werden, berichtet [2]. Die Forscher haben dabei eine vergleichende Analyse der transkribierten Gene in der gesamten Epidermis und in ihren abgetrennten oberen Schichten aus Hautproben von Menschen und Mäusen durchgeführt. Ein unerwartetes Ergebnis war die Expression des Hämoglobin A Gens in der Epidermis, das in der oberen Epidermis im Vergleich zur gesamten Epidermis angereichert war. Mit immunhistochemischen Methoden wurde auch eine hohe, vom Stratum spinosum zum Stratum granulosum zunehmende Konzentration des Hämoglobin Proteins (HbA) bei Mensch und Maus nachgewiesen. Auch in den Keratinozyten von Haarfollikeln wird HbA produziert, insbesondere in der Isthmusregion, nicht aber in der Wulstregion, die Stammzellen (Marker Keratin 15) und prolifierende Keratinozyten enthält. Abbildung 3.
|
Abbildung 3. Lokalisierung von Hämoglobin A in Keratinozyten der menschlichen Epidermis und des Haarfollikels (Die Haut stammte von der Hüfte einer 62 jährigen Frau).Oben: Das lila angefärbte HbA-Protein wird mit zunehmender Differenzierung in den Zellen der oberen Schichten zunehmend stärker exprimiert, fehlt jedoch in den toten Zellen des verhornten Stratum corneum. Im Vergleich dazu wird Keratin 10 (K10) gezeigt (grün), das als Marker der Differenzierung in allen Zellen ab dem Stratum spinosum (SS) aufscheint und im toten verhornten Stratum corneum akkumuliert. Der weiße Balken entspricht einer Distanz von 0,05 mm. Unten: Im Haarfollikel ist HbA besonders stark in den Keratinozyten der Isthmus Region (d.i, zwischen Talgdrüse und Haarbalgmuskel) exprimiert, dagegen nicht im unteren Bereich der Wulstregion, der Stammzellen und proliferierende Keratinozyten (Indikator Keratin 15, grün) enthält. (Bilder aus Tahara U., et al. 2023; [2. Lizenz cc-by]). Rechts unten: Schematische Darstellung eines Haarfollikels in der Haut (Bild: A. Friedrich, https://de.wikipedia.org/wiki/Haar#/media/Datei:Anatomy_of_the_skin_de.jpg. Lizenz cc-by) SB, Stratum basale; SS, Stratum spinosum, SG, Stratum granulosum; SC, Stratum corneum. |
Wie früher erwähnt können von HbA abgespaltene Peptide antimikrobielle Aktivitäten aufweisen [5]. In Hinblick auf die ausgeprägte HbA-Expression im Isthmus des Haarfollikels könnte dies - nach Meinung der Autoren - auf den Bedarf an Stammzellschutz gegen die Invasion der Hautmikrobiota an der Follikelöffnung zurückzuführen sein.
...... und schützt vor allem gegen durch UV-Strahlung generierte reaktive Sauerstoffspezies
Die auf unsere Haut auftreffende UV-Strahlung des Sonnenlichts, besteht zu etwa 95 % aus UVA (350-400 nm) Strahlung, der Rest aus UVB (290-320 nm) Strahlung. Die energiereichere UVB-Strahlung verursacht direkte DNA-Schäden, UVA kann dagegen in viel stärkerem Maße als UVB ROS erzeugen.
In Primärkulturen menschlicher Keratinozyten und auch in einem 3D-Epidermis Modell haben die Forscher gesehen, das UVA-Bestrahlungen bereits bei der minimalen erythematischen Dosis, aber nicht UVB-Bestrahlungen die Expression von Hämoglobin hochregulierten. Gleichzeitig wurden durch die UVA-Bestrahlung Wasserstoffperoxid und andere ROS generiert, offensichtlich aber zum Großteil von Hämoglobin abgefangen/neutralisiert. Dies ging aus Versuchen hervor, in denen die Expression von Hämoglobin ausgeschaltet (mittels knockdown) war und die UV-induzierten ROS um ein Vielfaches anstiegen.
Diese Ergebnisse deuten darauf hin, dass die epidermale HbA-Expression durch oxidativen Stress induziert wird und als Antioxidans zur Barrierefunktion der Haut beiträgt; nach Meinung der Autoren stellt dies einen körpereigenen Schutzmechanismus gegen Hautalterung und Hautkrebs dar.
[1] Saha D., et al. Hemoglobin Expression in Nonerythroid Cells: Novel or Ubiquitous? International Journal of Inflammation, vol. 2014, Article ID 803237, https://doi.org/10.1155/2014/803237.
[2] Tahara U., et al. Keratinocytes of the Upper Epidermis and Isthmus of Hair Follicles Express Hemoglobin mRNA and Protein. J Invest. Dermatol. 143 (12) 2023, DOI: https://doi.org/10.1016/j.jid.2023.08.008.
[3] Zhang, F., et al. An extra-erythrocyte role of haemoglobin body in chondrocyte hypoxia adaption. Nature 622, 834–841 (2023). https://doi.org/10.1038/s41586-023-06611-6
[4] M.P.Sumi et al.,Hemoglobin resident in the lung epithelium is protective for smooth muscle soluble guanylate cyclase function. Redox Biology, 07,2023, 63, https://doi.org/10.1016/j.redox.2023.102717
[5] Olari L-R., et al., The C‑terminal 32‑mer fragment of hemoglobin alpha is an amyloidogenic peptide with antimicrobial properties. Cellular and Molecular Life Sciences (2023) 80:151. https://doi.org/10.1007/s00018-023-04795-8
[6] Lintzeri D.A. et al., Epidermal thickness in healthy humans: a systematic review and meta-analysis (2022) J. Eur.Acad.Dermatol. Venereol. 36: 1191 -1200. https://doi.org/10.1111/jdv.18123
[7] Inge Schuster, 17.07.2015: Unsere Haut - mehr als eine Hülle. Ein Überblick.
Verwandte Themen im ScienceBlog
Gottfried Schatz, 23.01.2015: Der besondere Saft
Inge Schuster, 06.09.2018: Freund und Feind - Die Sonne auf unserer Haut
- Printer-friendly version
- Log in to post comments