Do, 23.09.2021 — Irina Dudanova
Neurodegenerative Erkrankungen sind verheerende Krankheiten, deren grundlegende Mechanismen noch nicht ausreichend erforscht sind. Ein gemeinsames Merkmal sind Eiweißablagerungen im Gehirn. Fehlgefaltete Proteine, die vom Qualtitätskontrollsystem gesunder Zellen korrigiert oder entsorgt werden, überfordern dieses bei neurodegenerativen Erkrankungen. Dr. Irina Dudanova, Leiterin der Forschungsgruppe "Molekulare Neurodegeneration" am Max-Planck-Institut für Neurobiologie (Martinsried, D), untersucht mit ihrem Team die Auswirkungen dieser Eiweißablagerungen auf Nervenzellen. Dabei kommen histologische und biochemische Methoden, Verhaltensanalysen sowie mikroskopische Untersuchungen an lebenden Organismen (Invitralmikroskopie) zum Einsatz. Mit einem neuen Mausmodell kann das Team erstmals den Zustand der kontrollierten Funktion der Proteine - der Proteostase - in Säugetier-Nervenzellen sichtbar machen. Diese Studien sollen dabei helfen, die Entstehung neurodegenerativer Erkrankungen besser zu verstehen, um in Zukunft effiziente Therapien entwickeln zu können.*
Manche Gehirnerkrankungen wie die Alzheimer-Krankheit, die Parkinson-Krankheit oder Chorea Huntington zeichnen sich durch fortlaufende Schädigung und Tod von Nervenzellen aus und sind als neurodegenerative Erkrankungen bekannt. Im Verlauf der Erkrankung bilden sich Ansammlungen von fehlgefalteten Eiweißen im Gehirn, die man als Einschlusskörperchen oder Plaques bezeichnet. Welche Wirkung haben diese Eiweißablagerungen auf die Nervenzellen, und wie beeinflussen sie die Gehirnfunktion? Um diese Fragen zu beantworten, forschen wir sowohl an Zellkulturen als auch an Mäusen, die als Modelle der humanen Erkrankungen dienen.
Störungen des Abwehrsystems von Eiweißfehlfaltung
Eiweißablagerungen sind eine Folge von Eiweißfehlfaltung, durch die sich die dreidimensionale Struktur der Eiweiße verändert. Jede Zelle ist mit einem Abwehrsystem gegen Eiweißfehlfaltung ausgestattet. Dazu gehören mehrere Faltungshelfer-Moleküle, die geschädigte Proteine erkennen und reparieren bzw. ihren Abbau fördern, um eine stabile Funktion der Proteine („Proteostase“) in der Zelle zu gewährleisten. Es wird angenommen, dass die Fähigkeiten dieses Abwehrsystems mit dem Alter nachlassen, was zu Proteostasestörungen und zur Eiweißablagerung führt und somit neurodegenerative Erkrankungen begünstigt.
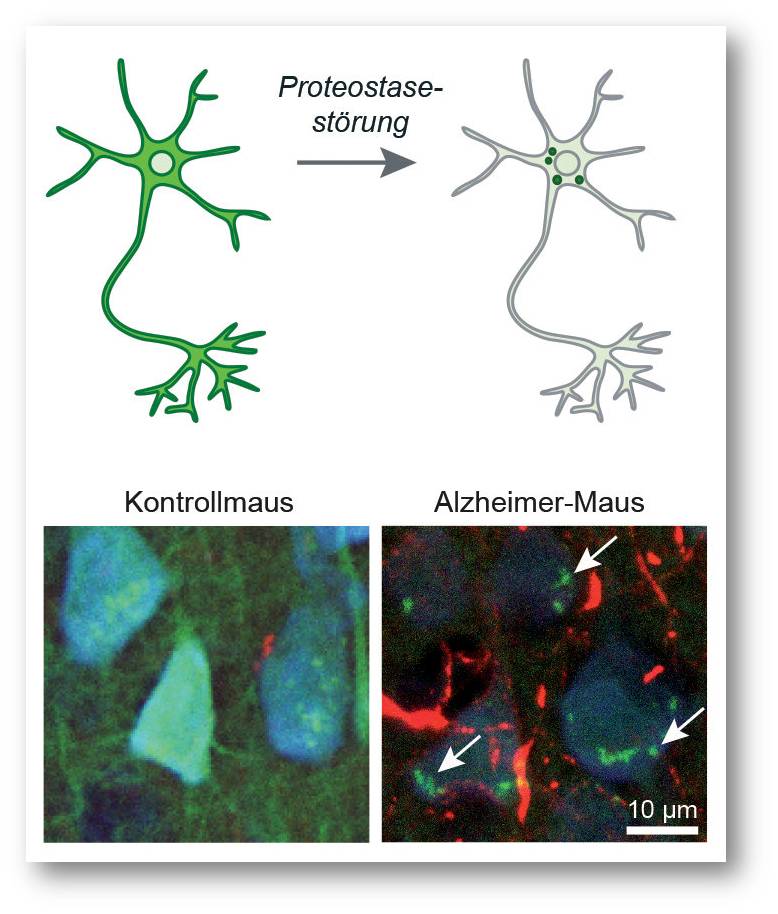
Bisher war es jedoch nicht möglich, diesen Prozess im Mausgehirn im Krankheitsverlauf mikroskopisch zu beobachten. Durch den Einsatz eines fluoreszierenden Sensors ist es uns gelungen, den Proteostase-Zustand in Nervenzellen sichtbar zu machen. Mithilfe dieser Methode kann man nun die Proteostasestörungen bei verschiedenen Krankheiten genauer untersuchen. Wenn das Fehlfaltungsabwehrsystem überfordert ist, bildet der normalerweise diffus verteilte Sensor kleine Punkte innerhalb der Zellen (Abbildung 1). In der Zukunft kann der Sensor dabei helfen, die Wirksamkeit von möglichen Therapien einzuschätzen.
| Abbildung 1: Oben: Funktionsweise des Proteostase-Sensors. In gesunden Nervenzellen (links) ist der Sensor gleichmäßig verteilt. Eine Proteostasestörung erkennt man daran, dass der Sensor sich in der Zelle umverteilt und kleine Punkte bildet (rechts). Unten: Proteostasestörung in einem Mausmodell der Alzheimer-Krankheit, das Ablagerungen des Tau-Eiweißes (rot) aufweist. Die Umverteilung des Sensors (grün) ist mit Pfeilen markiert. Nervenzellen sind blau gefärbt. © MPI für Neurobiologie / Dudanova, Blumenstock |
Defekte Abfallentsorgung in Nervenzellen
Um die allgemeinen Vorgänge bei der Eiweißablagerung in Zellkultur nachzubilden, haben wir in Kooperation mit Kollegen vom Max-Planck-Institut für Biochemie künstlich erzeugte Proteine eingesetzt, die spontan Einschlusskörperchen bilden. Mithilfe von hochauflösender Elektronenmikroskopie untersuchten wir die Struktur der Nervenzellen mit solchen Ablagerungen im Detail. Dabei fanden wir Veränderungen der Lysosomen, den zellulären Strukturen, die für die Abfallentsorgung zuständig sind. In Anwesenheit von Eiweißablagerungen waren die Lysosomen angeschwollen, sie schienen unverdautes Material zu enthalten. Biochemische Analysen zeigten, dass in den betreffenden Zellen mehrere wichtige Proteine von den Ablagerungen „aufgefangen“ werden und an ihnen kleben bleiben, darunter auch ein Protein, das am Transport struktureller Komponenten der Lysosomen beteiligt ist. Vermutlich führt dies zu unzureichender Funktion der Lysosomen und folglich zu einem Stau im zellulären Entsorgungssystem. Mit unserer gemeinsamen Studie konnten wir somit eine neue Verbindung zwischen Eiweißablagerungen und Beeinträchtigung der Abbauvorgänge in Nervenzellen aufzeigen [1].
Veränderungen der neuronalen Aktivität
Eiweißablagerungen stören auch die Kommunikation der Nervenzellen untereinander innerhalb der neuronalen Netzwerke. Solche funktionellen Veränderungen durch neurodegenerative Erkrankungen sind bisher jedoch nur unzureichend erforscht. Mithilfe intravitaler Mikroskopie, bei der Veränderungen im lebenden Gewebe mikroskopisch sichtbar gemacht werden können, haben wir die Aktivität der Nervenzellen in der motorischen Hirnrinde von Mäusen, die an Chorea Huntington erkrankt waren, über mehrere Wochen hinweg wiederholt gemessen.
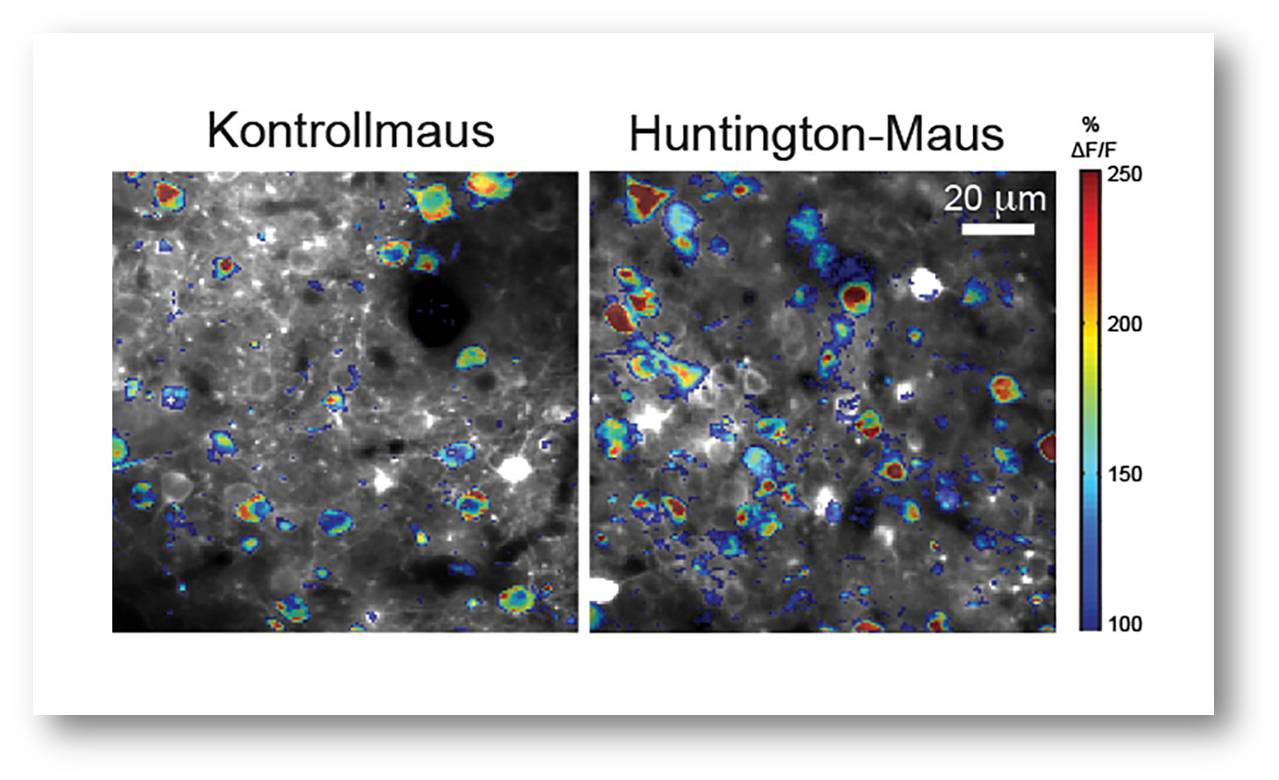
| Abbildung 2: Die maximale Aktivität einzelner Nervenzellen in der motorischen Hirnrinde einer Kontrollmaus (links) und einer Huntington-Maus (rechts) während einer 15-minütigen Mikroskopie-Sitzung ist mithilfe der Farbskala dargestellt.© MPI für Neurobiologie / Dudanova, Burgold |
Überraschenderweise konnten wir bereits vor dem Eintreten der krankheitsbedingten Verhaltensänderungen eine erhöhte Aktivität der Nervenzellen feststellen (Abbildung 2). Histologische Untersuchungen in Chorea Huntington-Mäusen und in humanem Chorea Huntington-Gehirngewebe sowie biochemische Analysen wiesen darauf hin, dass diese Hyperaktivität der Nervenzellen möglicherweise mit unzureichender synaptischer Hemmung im Zusammenhang steht [2]. In zukünftigen Studien wollen wir daher einzelne Typen von hemmenden Nervenzellen genauer unter die Lupe nehmen, die bisher im Kontext der Chorea Huntington-Erkrankung wenig erforscht wurden [3].
Ausblick
Bei jeder neurodegenerativen Erkrankung sind bestimmte Nervenzelltypen besonders früh und stark betroffen, während andere Nervenzellen in ihrer Nähe länger verschont bleiben [4]. Über die Ursachen dieser Unterschiede verbleiben noch viele Fragen. In zukünftigen Untersuchungen wollen wir die molekularen und funktionellen Merkmale der unterschiedlich stark betroffenen Zelltypen in Mausmodellen der Neurodegeneration weiter erforschen. Dies ist wichtig, um zu verstehen, welche von den vielen pathologischen Vorgängen, die im kranken Gehirn stattfinden, bei der Krankheitsentstehung eine entscheidende Rolle spielen.
[1]. Schaefer, T. et al., Amyloid-like aggregates cause lysosomal defects in neurons via gain-of-function toxicity. bioRxiv (2019).https://www.biorxiv.org/content/10.1101/2019.12.16.877431v3
[2]. Burgold, J. et al., Cortical circuit alterations precede motor impairments in Huntington’s disease mice. Scientific Reports 9(1), 6634 (2019). https://www.nature.com/articles/s41598-019-43024-w
[3]. Blumenstock, S.; Dudanova, I. Cortical and striatal circuits in Huntington’s disease. Frontiers in Neuroscience 14, 82 (2020). https://www.frontiersin.org/articles/10.3389/fnins.2020.00082/full
[4]. Fu, H.; Hardy, J.; Duff, K.E. Selective vulnerability in neurodegenerative diseases. Nature Neuroscience 21(10), 1350-1358 (2018). https://www.nature.com/articles/s41593-018-0221-2
* Der vorliegende Artikel von Irina Dudanova ist in dem neuen Jahrbuch 2020 der Max-Planck-Gesellschaft unter dem Titel " Wie Eiweißablagerungen das Gehirn verändern" (https://www.mpg.de/15932560/neuro_jb_2020?c=11659628) erschienen und kann mit freundlicher Zustimmung der MPG-Pressestelle und der Autorin von ScienceBlog.at weiterverbreitet werden. Text und Abbildungen wurden von uns nahezu unverändert übernommen.
Weiterführende Links
Webseite der Irina Dudanova- Forschungsgruppe "Molekulare Neurodegeneration" am Max-Planck-Institut für Neurobiologie (Martinried, D): https://www.neuro.mpg.de/dudanova/de
Fehlerhafte Qualitätskontrolle im Gehirn (19.08.2021): https://www.neuro.mpg.de/news/2021-08-dudanova/de?c=2742
.............................................................................................................
Zur Protein(fehl)faltung aus dem Max-Planck-Institut für Biochemie (Martinsried, D):
F.-Ulrich Hartl:Chaperone - Faltungshelfer in der Zelle.Video 9:11 min. https://www.biochem.mpg.de/4931043/03_Hartl-Chaperone copyright: www.mpg.de/2013
F.-Ulrich Hartl: Die Proteinfaltung. Video 4:38 min.https://www.biochem.mpg.de/4931164/07_Hartl-Proteinfaltung copyright: www.mpg.de/2013
...............................................................................................
Das Gehirn im ScienceBlog:
Rund 10 % aller Artikel - d.i. derzeit mehr als 50 Artikel - befassen sich mit unterschiedlichen Aspekten zu Aufbau, Funktion, Entwicklung und Evolution des Gehirns und - basierend auf dem Verstehen von Gehirnfunktionen - mit Möglichkeiten bisher noch unbehandelbare Gehirnerkrankungen zu therapieren. Ein Themenschwerpunkt Gehirn fasst diese Artikel zusammen.
- Printer-friendly version
- Log in to post comments