Fr, 12.07.2013 - 04:20 — Peter Schuster

 Themenschwerpunkt Synthetische Biologie
Themenschwerpunkt Synthetische Biologie
Können wir mit der Synthetischen Biologie etwas Besseres bewirken, als das, was Natur und Evolution im Laufe der Jahrmilliarden hervorgebracht haben? Hier erheben sich sofort Fragen wie: „Besser für wen?“, „Besser wofür? oder „Wie kommen Optimierungen überhaupt zustande?“ Der Artikel basiert auf einem Vortrag des Autors anläßlich des Symposiums über Synthetische Biologie, das von der Österreichischen Akademie der Wissenschaften im Mai d.J. veranstaltet wurde; er erscheint auf Grund seiner Länge in zwei aufeinander folgenden Teilen.
Vor weniger als einem Jahr veranstaltete das Jena Life Science Forum eine Tagung unter dem Titel „Designing living matter – Can we do better than evolution?“. Nachdem wir uns nach längerer Diskussion auf diesen Namen geeinigt hatten, waren wir fürs erste zufrieden, aber dann doch über die eigene Frechheit erschrocken: Glaubten wir denn wirklich, dass wir Menschen die Evolution übertreffen können? Nach kurzem Nachdenken trat wieder Beruhigung ein. Solange man nicht präzise sagt, was „better“ oder „übertreffen“ bedeuten soll, ist alles offen. Fast immer kann man die Natur übertreffen, wenn man sich ein einziges Merkmal herausgreift und dann dieses durch menschlichen Eingriff nach Belieben verändert.
Der vorliegende erste Teil dieses Essays schneidet Probleme der Bewertung nach mehreren Kriterien an und geht auf die Frage ein, inwieweit Optimalität in der Natur vorherrscht.
Optimalität und Pareto-Gleichgewicht
Optimalität im täglichen Leben ist leicht definiert: Wir möchten ein genau definiertes Produkt kaufen, sehen bei „Geizhals“ oder einem anderen Kaufinformationsprovider online nach, wo das Produkt am billigsten ist, gehen dort einkaufen und haben unseren Einkauf optimiert. Leider ist eine solche eindeutige Sachlage die Ausnahme! Normalerweise haben wir mehrere Kriterien zu beachten, und dann wird der Vergleich schwierig.
Nehmen wir wieder ein alltägliches Beispiel: Jemand möchte ein ökonomisch günstiges Auto kaufen – d.i. niedriger Anschaffungspreis, geringer Benzinverbrauch und Unterhaltskosten –, das gleichzeitig mit möglichst hoher Spitzengeschwindigkeit fahren können soll. Diese beiden Wunschvorstellungen sind nicht miteinander vereinbar und anstelle eines Optimums gibt es eine ganze Reihe von günstigsten Kompromissen, die nach dem Italiener Vilfredo Frederico Pareto als Pareto-Gleichgewicht oder Pareto-Front bezeichnet wird: Eine besseres Ergebnis für das eine Kriterium lässt sich nur durch eine Verschlechterung beim zweiten Kriterium erzielen. In unserem Beispiel: ein rascheres Auto kostet mehr Geld. Die Pareto-Front trennt die ineffizienten und daher verbesserbaren Lösungen von den unmöglichen, die nicht realisiert werden können (Abbildung 1).
Vilfredo Pareto war in erster Linie Volkswirt und seine Überlegungen zur Optimierung nach mehreren Kriterien fanden daher auch vorwiegend Anwendungen in der Ökonomie. Unter einigen idealisierenden Annahmen kann gezeigt werden, dass sich ein System „freier Märkte“ zu einer Pareto effizienten Volkswirtschaft entwickelt. Die Optimierungsprobleme in anderen Disziplinen sind aber im Wesentlichen die gleichen und natürliche biologische Systeme machen dabei keine Ausnahme.
Optimalität in der Natur
Wie steht es nun mit Optimierung in der Natur?
Seit der Jungsteinzeit gestaltet der Mensch die Natur durch Manipulation von Organismen für seine Zwecke um. Dabei wird durchaus auch ständig in die Genetik der Arten eingegriffen – sonst wären weder Feldfrüchte noch Obstsorten noch Haustiere gezüchtet worden. Die gesamte Geschichte der Menschheitsentwicklung ist auch eine Geschichte solcher Verbesserungen. Diese Eingriffe in die Natur erfolgten bis ins zwanzigste Jahrhundert hinein ohne Wissen um die Mechanismen, die der Veränderung von Organismen und Arten zugrunde liegen. Die explosionsartige, höchst spektakuläre Entwicklung der molekularen Biologie eröffnet völlig neue Zugänge zur Modifikation biologischer Einheiten von Biomolekülen bis zu Gesamtorganismen.
Es fällt im Allgemeinen nicht schwer Einzeleigenschaften von Biomolekülen oder ganzen Organismen zu „verbessern“ im Sinne von „schneller, mehr, größer, kleiner, spezifischer, stabiler“ und so weiter. Proteine wurden nicht nur in diesem Sinne "verbessert", sondern auch an nicht natürliche Bedingungen wie beispielsweise nichtwässrige Lösungsmittel angepasst (siehe den Abschnitt über rationales Design im Teil 2).
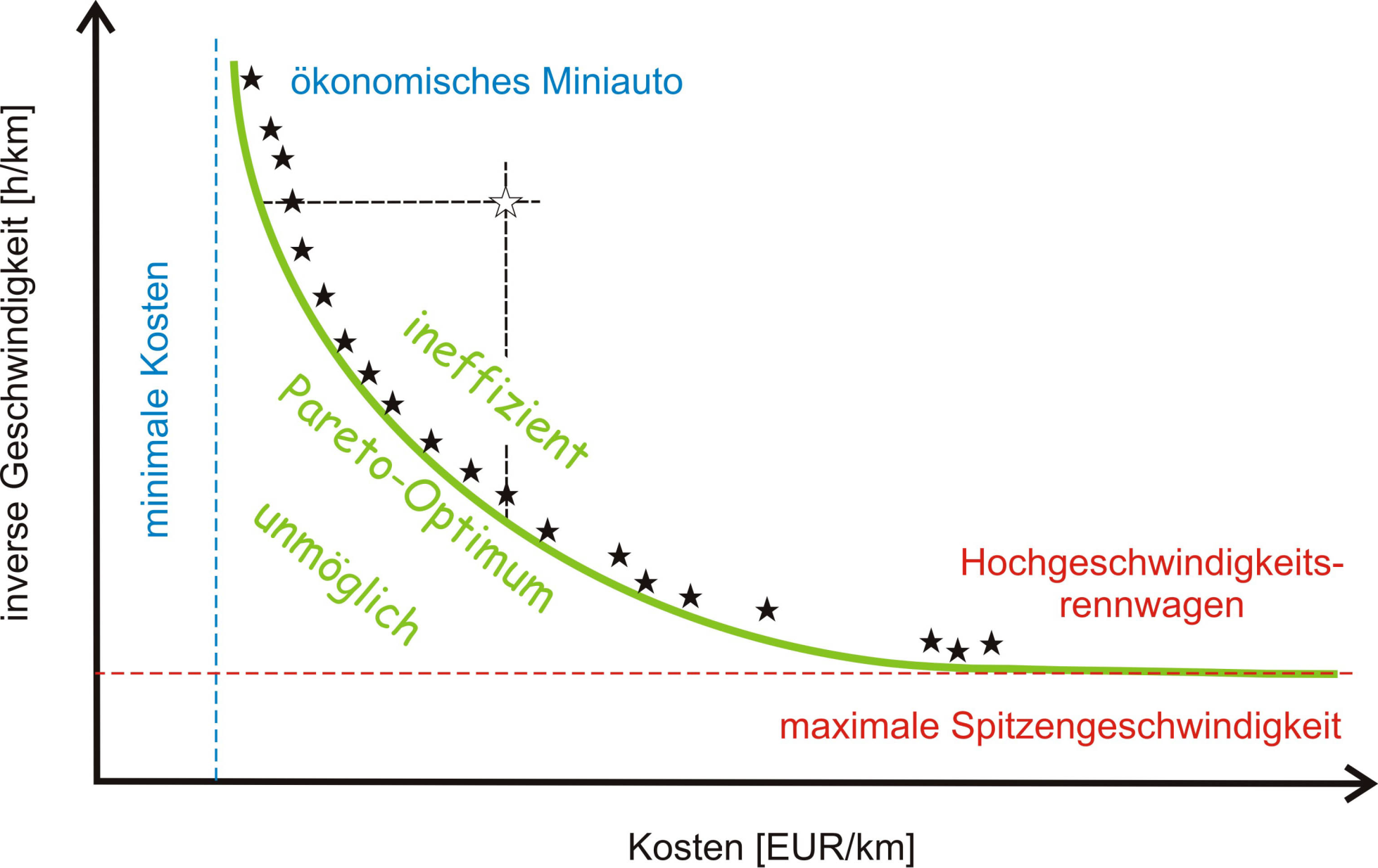 Abbildung 1. Pareto Gleichgewicht: Das Optimieren nach mehreren Kriterien (hier Kosten und Geschwindigkeit eines Autos) führt nicht zu einem Optimum sondern zu einer Reihe von Kompromissen.
Abbildung 1. Pareto Gleichgewicht: Das Optimieren nach mehreren Kriterien (hier Kosten und Geschwindigkeit eines Autos) führt nicht zu einem Optimum sondern zu einer Reihe von Kompromissen.
Die Natur in Form der biologischen Evolution kann es sich nur in Ausnahmefällen leisten Einzelmerkmale zu optimieren – selektiert werden die Gesamtorganismen und das auch nur in Hinblick auf die Zahl ihrer fortpflanzungsfähigen Nachkommen. Dabei muss die Evolution auf Vorhandenem aufbauen und kann nicht wie ein Ingenieur de novo designen, sie arbeitet nach dem Bastelprinzip – „evolutionary tinkering“ oder „bricolage“ genannt [1], denn das einzige, worauf Erfolg in der Natur aufbaut ist Funktionstüchtigkeit.
Suboptimale anatomische Lösungen
Bei den höheren Organismen fehlt es nicht an Beispielen von suboptimalen Lösungen des evolutionären Bastelns. Zwei seien hier stellvertretend für viele andere genannt: (i) beim Wirbeltierauge verlassen die Nervenfasern die Retina auf der Seite, die dem Sehnerv gegenüberliegt und dies bedeutet, dass sie die Retina durchdringen müssen bevor sie gebündelt ins Gehirn weiterlaufen können und dadurch entsteht der bei anderer Faserführung vermeidbare „blinde“ Fleck, und (ii) beim Kehlkopf der Wirbeltiere kreuzen Luft- und Speiseröhre, was vom harmlosen „Verschlucken“ bis zu den tödlichen Verletzungen beim Eindringen von Speisen in die zur Lunge führenden Luftröhre führen kann (Abbildung 2).
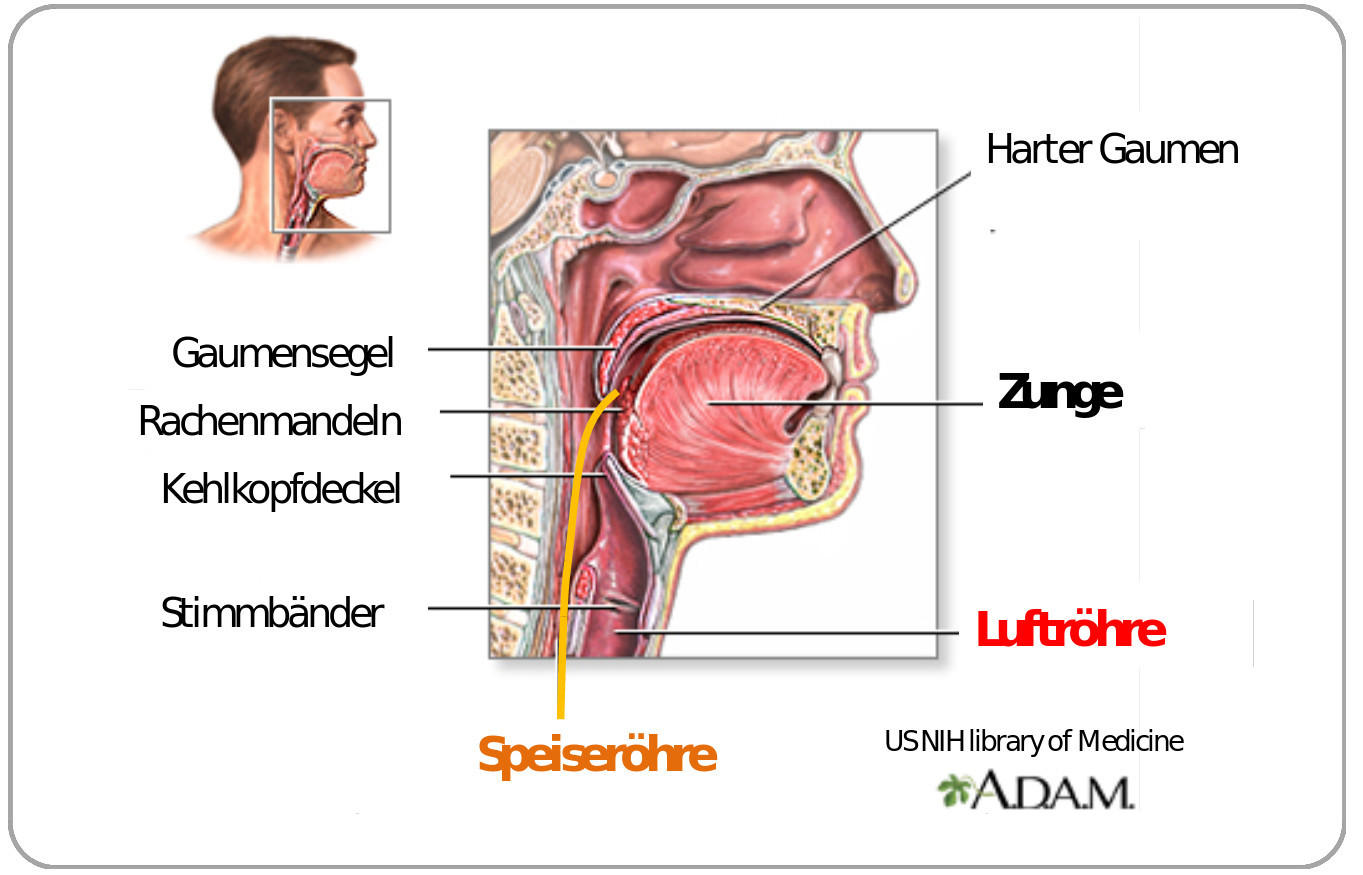 Abbildung 2. Kehlkopf: eine suboptimale Lösung. Der bewegliche Kehlkopfdeckel bewegt sich beim Schlucken reflexartig nach unten und dichtet die Luftröhre ab. Gelegentlich – z.B. bei gleichzeitigem Lachen, Sprechen und Schlucken, tritt der Reflex verzögert ein und man „verschluckt“ sich. (Bild: modifiziert nach US Library of Medicine; public domain)
Abbildung 2. Kehlkopf: eine suboptimale Lösung. Der bewegliche Kehlkopfdeckel bewegt sich beim Schlucken reflexartig nach unten und dichtet die Luftröhre ab. Gelegentlich – z.B. bei gleichzeitigem Lachen, Sprechen und Schlucken, tritt der Reflex verzögert ein und man „verschluckt“ sich. (Bild: modifiziert nach US Library of Medicine; public domain)
Optimalität von Stoffwechselvorgängen?
Wie steht es nun mit dem Stoffwechsel – Metabolismus - von Zellen? Ist dieser optimal oder nur gerade funktionsfähig? Arbeitet der Stoffwechsel von Organismen unter optimalen Bedingungen und wenn ja, nach welchen Kriterien wurde er optimiert?
Biochemiker bemühen sich seit mehr als einhundert Jahren erfolgreich um die Aufklärung des Zell-Stoffwechsels und alle wichtigen Reaktionspfade der berühmten Stoffwechselkarte von Boehringer-Mannheim sind hinsichtlich der Zahl und Art der beteiligten Komponenten aufgeklärt (interaktive Darstellung der hochkomplexen Biochemical Pathways: Metabolic Pathways Map). Dennoch tappt man bei einigen grundlegenden Fragen noch weitestgehend im Dunkeln, nämlich nach der Natur der dominierenden Komponenten des metabolischen Flusses (metabolic flux) – d.i. des Durchsatzes von Molekülen durch einen Stoffwechselweg - und ihrer Optimalität.
Seit etwa zwanzig Jahren steht in Form der „Flux-Balance-Analyse“ (FBA) des Stoffwechsels eine rechnerische, am Computer implementierte Methode zur Verfügung, die eine vereinfachende Untersuchung komplexer metabolischer Netzwerke erlaubt [2]. Einschränkungen der zugänglichen Flusskombinationen entstehen durch die den einzelnen Reaktionsschritten zugrunde liegende Chemie und Thermodynamik: Massenerhalt und Mengenverhältnisse von reagierenden Spezies und Produkten (Stöchiometrie), Energiebilanz und andere Nebenbedingungen beschränken den Raum der Flüsse. Eine Kombination von „Flux-Balance“ und Energiebilanzanalyse (EBA) schafft gleichzeitig eine Basis für die Definition von multikriteriellen Zielfunktionen (= zu optimierende Größen) und erlaubt damit die Berechnung Pareto optimaler Kurven und Flächen (siehe Abbildung 3). Trotz der in sich konsistenten Theorie der metabolischen Flüsse können aber ohne experimentelle Zusatzinformation nur qualitative Aussagen über die Verteilung der Flüsse in den Netzwerken gemacht werden.
Optimalität des Stoffwechsel am Beispiel von Bakterien
Eine Vorstellung von der Komplexität des Stoffwechsels selbst bei Bakterien erhält man an Hand einiger Zahlen zum Bakterium Escherichia coli [3]: Dessen rund 4000 Gene kodieren für etwa 5000 verschiedene Transkripte, von denen sich 6000 bis 10000 Proteine herleiten. Den Proteinen stehen etwa 2000 größtenteils niedrigmolekulare Stoffwechselprodukte (Metabolite) gegenüber. Für das ganze Genom und seine Produkte umfassende Analysen ist es daher unumgänglich die Dimension zu reduzieren und sich auf den Kern des Stoffwechsels zu beschränken. Nichtsdestoweniger ist im vergangenen Jahr eine experimentell gestützte Analyse des Stoffwechsels des Bakteriums Escherichia coli im Wissenschaftsmagazin Science erschienen [4]:
In dieser Untersuchung wurde Glucose - Nahrungsquelle beziehungsweise Ausgangsprodukt des bakteriellen Stoffwechsels –– mit dem stabilen Kohlenstoff-Isotop 13C markiert. Die Analyse der Zeit abhängigen Verteilung dieses Isotops in den Stoffwechselprodukten erlaubte es die metabolischen Flüsse innerhalb der Zellen experimentell zu ermitteln. Die so erhaltene Verteilung der Flüsse wurde dann mit einer berechneten Verteilung verglichen, wobei ein Reaktionsmodell des zentralen Stoffwechsels von Escherichia coli zugrunde gelegt wurde, welches aus 79 einzelnen Reaktionsschritten und einer Escherichia coli spezifischen Bruttobilanzgleichung für die Biomasseproduktion bestand. Fünf Zielfunktionen erwiesen sich als konsistent mit den in vivo Flüssen: (i) maximale Energieproduktion in Form von Adenosintriphosphat (ATP), (ii) Biomasseproduktion, (iii) Ausbeute an Azetat, (iv) Kohlendioxydproduktion und (v) die minimale Summe der absoluten Flüsse im Sinne einer möglichst effizienten Nutzung der Ressourcen. Keine einzige der fünf Zielfunktionen war allein in der Lage, alle gemessenen Flüsse adäquat zu beschreiben und ebenso gab es keine zufriedenstellende Wiedergabe der Daten durch Paare von Zielfunktionen. Von allen Dreierkombinationen erwies sich das Tripel (i) ATP-Produktion, (ii) Biomasseproduktion und (v) optimale Aufteilung der Ressourcen in Form der Minimalisierung des Gesamtflusses, als am besten geeignet, das metabolische Geschehen in der Escherichia coli Zelle hinsichtlich einer Analyse der Optimalität zu beschreiben. Dies kommt auch dadurch zum Ausdruck, dass alle (insgesamt 44 berechneten) Flüsse nahe der Pareto-Fläche zu liegen kommen.
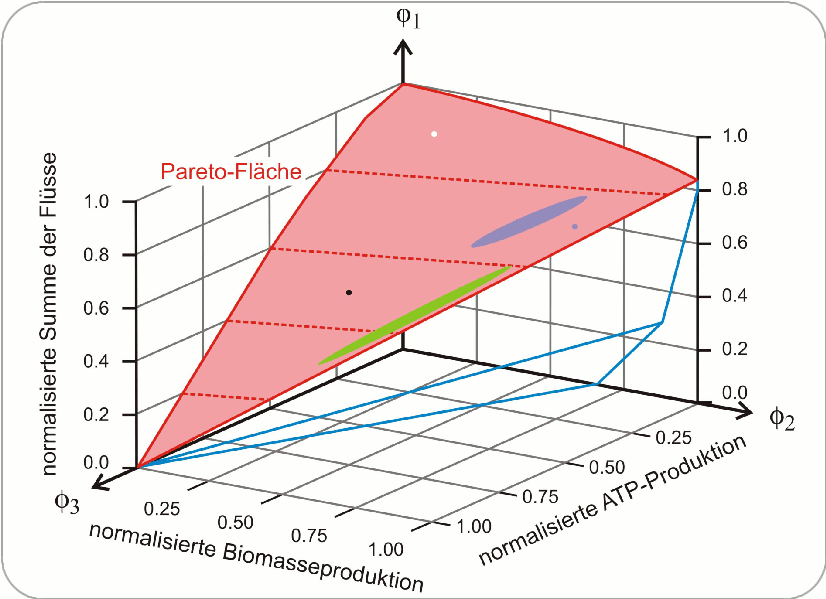 Abbildung 3. Pareto-Fläche (rot) der drei dominierenden Flüsse im Stoffwechsel von Escherichia coli. Die auf der roten Fläche eingezeichneten Punkte und Zonen wurden aus den 13C Bestimmungen der metabolischen Daten von Escherichia coli unter verschiedenen Wachstumsbedingungen ermittelt. Aerobe Kulturen: blau mit Überschuss an Glucose, grün unter Mangel an Glucose, schwarz unter Stickstoffmangel und zum Vergleich eine anaerobe Kultur: weiß. Die in diesem Diagramm aufgetragenen Flüsse sind normalisiert, und daher bedeutet „1“ die unter gegebenen Bedingungen bestmögliche Erfüllung des Kriteriums der Optimalität – Minimum der Summe der Flüsse, Maximum der Biomasse und ATP-Produktion (Quelle: Referenz [3], Bild gezeichnet nach Fig.1A in dieser Arbeit)
Abbildung 3. Pareto-Fläche (rot) der drei dominierenden Flüsse im Stoffwechsel von Escherichia coli. Die auf der roten Fläche eingezeichneten Punkte und Zonen wurden aus den 13C Bestimmungen der metabolischen Daten von Escherichia coli unter verschiedenen Wachstumsbedingungen ermittelt. Aerobe Kulturen: blau mit Überschuss an Glucose, grün unter Mangel an Glucose, schwarz unter Stickstoffmangel und zum Vergleich eine anaerobe Kultur: weiß. Die in diesem Diagramm aufgetragenen Flüsse sind normalisiert, und daher bedeutet „1“ die unter gegebenen Bedingungen bestmögliche Erfüllung des Kriteriums der Optimalität – Minimum der Summe der Flüsse, Maximum der Biomasse und ATP-Produktion (Quelle: Referenz [3], Bild gezeichnet nach Fig.1A in dieser Arbeit)
Abbildung 3 zeigt die Pareto-Fläche im Raum der drei ausgewählten Zielfunktionen i, ii und v: Alle Wachstumsansätze von Bakterienkulturen lagen nahe bei der Pareto-Fläche. Die verschiedenen Bakterienkulturen die aerob (= in Gegenwart von Sauerstoff) bei Glucoseüberschuss gewachsen sind kamen alle im blau markierten Bereich zu liegen, Kulturen unter verschiedenen Graden an Glucosemangel lagen in der grün markierten Zone, eine Kultur unter Stickstoffmangel ergab den schwarzen Punkt und eine unter anaeroben (= in Abwesernheit von Sauerstoff) Bedingungen den weißen Punkt.
Drei Ergebnisse aus der Gruppe von Uwe Sauer [3] an der ETH Zürich und neueste Arbeiten aus demselben Institut sind von allgemeiner Bedeutung: (i) die Punkte für die metabolische Flüsse anderen Bakterienarten – untersucht wurden Bacillus subtilis (mehrere Stämme), Zymomonas mobilis, Pseudomonas flurescens, Rhodobacter sphaeroides, Pseudomonas putida, Agrobacterium tumefaciens, Sinorhizobium meliloti und Paracoccus versutus – liegen ganz in der Nähe der Pareto-Fläche für Escherichia coli, (ii) Bakterien können metabolische Flüsse messen und regulieren und dies wurde am Beispiel des glycolytischen Flusses und der daraus resultierenden Verwendung des Signals für die Regulierung des Stoffwechsels in Escherichia coli gezeigt [5] und (iii) bei genauer Betrachtung liegen alle gemessenen Flüsse etwas unterhalb der Pareto-Fläche, wobei die Differenz zu den Pareto-Werten signifikant ist. Eine Berechnung der Stoffwechselflüsse für verschiedene Nahrungsquellen liefert die Erklärung:
Flusskombinationen am Pareto-Optimum für eine Nahrungsquelle sind relativ weit entfernt von den Pareto optimalen Kombinationen für eine andere Nahrungsquelle. Es dauert dementsprechend relativ lange, um von der optimalen Lösung für eine Nahrungsquelle zur optimalen Lösung für eine andere Nahrungsquelle zu kommen. In einigem Abstand von der Pareto-Fläche finden sich Zustände, bei denen die Flüsse mit nur geringem Aufwand und daher rasch von einer Nahrungsquelle zu einer anderen umschalten können. Die Evolution optimiert daher nicht nur auf Effizienz des Stoffwechsels unter den gegebenen Bedingungen, sondern stellt auch die in variablen Umwelten notwendige Flexibilität in Rechnung. Die eben gegebene Erklärung der natürlichen Flusskombinationen durch Variabilität auf Kosten von Effizienz charakterisiert als minimale Flussjustierung [4] bietet eine plausible Alternative zu der früher gegebenen Interpretation als Anpassung der Mikroorganismen an eine historisch bestimmte Reihenfolge in den Änderungen der Nahrungsquellen [5]. ----------------------------------------------------------------------------------------- [1] siehe dazu im ScienceBlog: Peter Schuster. Gibt es Rezepte für die Bewältigung von Komplexität? Die biologische Evolution schafft komplexe Gebilde und kann damit umgehen. Unzähmbare Neugier, Innovation, Entdeckung und Bastelei - Sind wir dazu verdammt auf dem Weg einer immerzu steigenden Komplexität unserer Welt fortzuschreiten?
[2] Armit Varma, B. Ø. Palsson. Metabolic flux balancing: Basic concepts, scientific and practical use. (Nature) BioTechnology 12:994-998, 1994. [
3] Uwe Sauer. Metabolic networks in motion: 13C-based flux analysis. Molecular Systems Biology 2:e62, 2006 [4] Robert Schuetz, Nicola Zamboni, Mattia Zampieri, Matthias Heinemann, Uwe Sauer. Multidimensional optimality of microbial metabolism. Science 366:601-604, 2012. [5] Amir Mitchell, Gal H. Romano, Bella Groisman, Avihu Yona, Erez Dekel, Martin Kupiec, Orna Dahan, Yitzhak Pilpel. Adaptive prediction of environmental changes by microorganisms. Nature 460:220-224, 2009.
- Printer-friendly version
- Log in to post comments
