Do, 18.11.2021 — Francis S. Collins

![]() Auf der Basis von außerordentlich positiven klinischen Interims-Ergebnissen hat der Pharmagigant Pfizer vorgestern bei der FDA um die Notfallzulassung für sein neues, oral anwendbares COVID-19 Therapeutikum Paxlovid angesucht. Laut Pressemitteilung von Pfizer konnte Paxlovid -innerhalb von 5 Tagen nach Diagnosestellung/Auftreten von Symptomen angewandt - weitestgehend Hospitalisierung und Letalität verhindern. Noch fehlen allerdings Angaben zur Sicherheit einer breiten Anwendung dieses möglichen Game-changers. Wie Paxlovid wirkt und welches Potential dieses neue Therapeutikum haben kann, beschreibt Francis S. Collins - ehem. Leiter des Human Genome Projects, Entdecker mehrerer krankheitsverursachender Gene und seit 2009 Direktor der NIH.*
Auf der Basis von außerordentlich positiven klinischen Interims-Ergebnissen hat der Pharmagigant Pfizer vorgestern bei der FDA um die Notfallzulassung für sein neues, oral anwendbares COVID-19 Therapeutikum Paxlovid angesucht. Laut Pressemitteilung von Pfizer konnte Paxlovid -innerhalb von 5 Tagen nach Diagnosestellung/Auftreten von Symptomen angewandt - weitestgehend Hospitalisierung und Letalität verhindern. Noch fehlen allerdings Angaben zur Sicherheit einer breiten Anwendung dieses möglichen Game-changers. Wie Paxlovid wirkt und welches Potential dieses neue Therapeutikum haben kann, beschreibt Francis S. Collins - ehem. Leiter des Human Genome Projects, Entdecker mehrerer krankheitsverursachender Gene und seit 2009 Direktor der NIH.*
Im Verlauf dieser Pandemie wurden erhebliche Fortschritte bei der Behandlung von COVID-19 und der Rettung von Menschenleben erzielt. Zu diesen Fortschritten gehören die Entwicklung lebenserhaltender monoklonaler Antikörperinfusionen und die Wiederverwendung bestehender Medikamente, zu denen die öffentlich-private Partnerschaft von NIH zur Beschleunigung von COVID-19 therapeutischen Interventionen und Impfstoffen (ACTIV) einen wichtigen Beitrag geleistet hat.
Seit vielen Monaten hegen wir aber die Hoffnung auf ein sicheres und wirksames orales Arzneimittel, welches - kurz nach Erhalt einer COVID-19 -Diagnose verabreicht - das Risiko eines schweren Krankheitsverlaufs verringern kann. Den ersten Anhaltspunkt, dass sich diese Hoffnungen erfüllen könnten, gab es vor gerade einem Monat: es war die Meldung, dass das von Merck und Ridgeback stammende Medikament Molnupiravir Krankenhausaufenthalte um 50 % reduzieren könnte (das Medikament wurde ursprünglich mit NIH-Förderung an der Emory University (Atlanta) entwickelt). Nun kommt die Meldung von einem zweiten Medikament mit einer möglicherweise noch höheren Wirksamkeit: es ist eine antivirale Pille von Pfizer Inc., die auf einen anderen Schritt im Vermehrungszyklus des SARS-CoV-2 Virus abzielt.
Erste Daten zur antiviralen Pfizer-Pille…
Die aufregenden neuesten Nachrichten kamen Anfang dieses Monats heraus, als ein Pfizer-Forschungsteam in der Zeitschrift Science einige vielversprechende erste Daten zur antiviralen Pille und ihrem Wirkstoff veröffentlichte [1]. Einige Tage später gab es dann noch wichtigere Neuigkeiten, als Pfizer Zwischenergebnisse einer großen klinischen Phase 2/3-Studie bekannt gab. Die Studie an Erwachsenen mit hohem Risiko für einen schweren Krankheitsverlauf zeigte, dass die Pille das Risiko eines Krankenhausaufenthalts oder eines letalen Ausgangs um 89 Prozent reduzierte, wenn sie innerhalb von drei Tagen nach Auftreten von COVID-19-Symptomen eingenommen wurde [2].
Auf Empfehlung des unabhängigen Ausschusses, der die klinische Studie überwachte und in Absprache mit der US-amerikanischen Food and Drug Administration (FDA) hat Pfizer die Studie nun aufgrund der großartigen Zwischenergebnisse gestoppt. Pfizer plant, die Daten sehr bald bei der FDA zur eine Notfallzulassung (Emergency Use Authorization - EUA) einzureichen (diese Anmeldung ist am 16.11.2021erfolgt; Anm.Redn.)
…und wie sie gegen SARS-CoV-2 wirkt
Die antivirale Pille von Pfizer enthält einen Protease-Inhibitor, der ursprünglich PF-07321332 oder kurz "332" genannt wurde. Eine Protease ist ein Enzym, das ein Protein an einer bestimmten Sequenz von Aminosäuren spaltet. Das SARS-CoV-2-Virus kodiert für seine eigene Protease, um ein großes, viral kodiertes Polyprotein in kleinere Segmente zu verarbeiten, die es für seinen Vermehrungszyklus benötigt; ein Medikament, das die Protease hemmt, kann dies verhindern. Wenn der Begriff Protease-Hemmer bekannt erscheint, so liegt das daran, dass Medikamente mit diesem Wirkungsmechanismus bereits zur Behandlung anderer Viren verwendet werden, u.a. zur Behandlung des humanen Immunschwächevirus (HIV) und des Hepatitis-C-Virus.
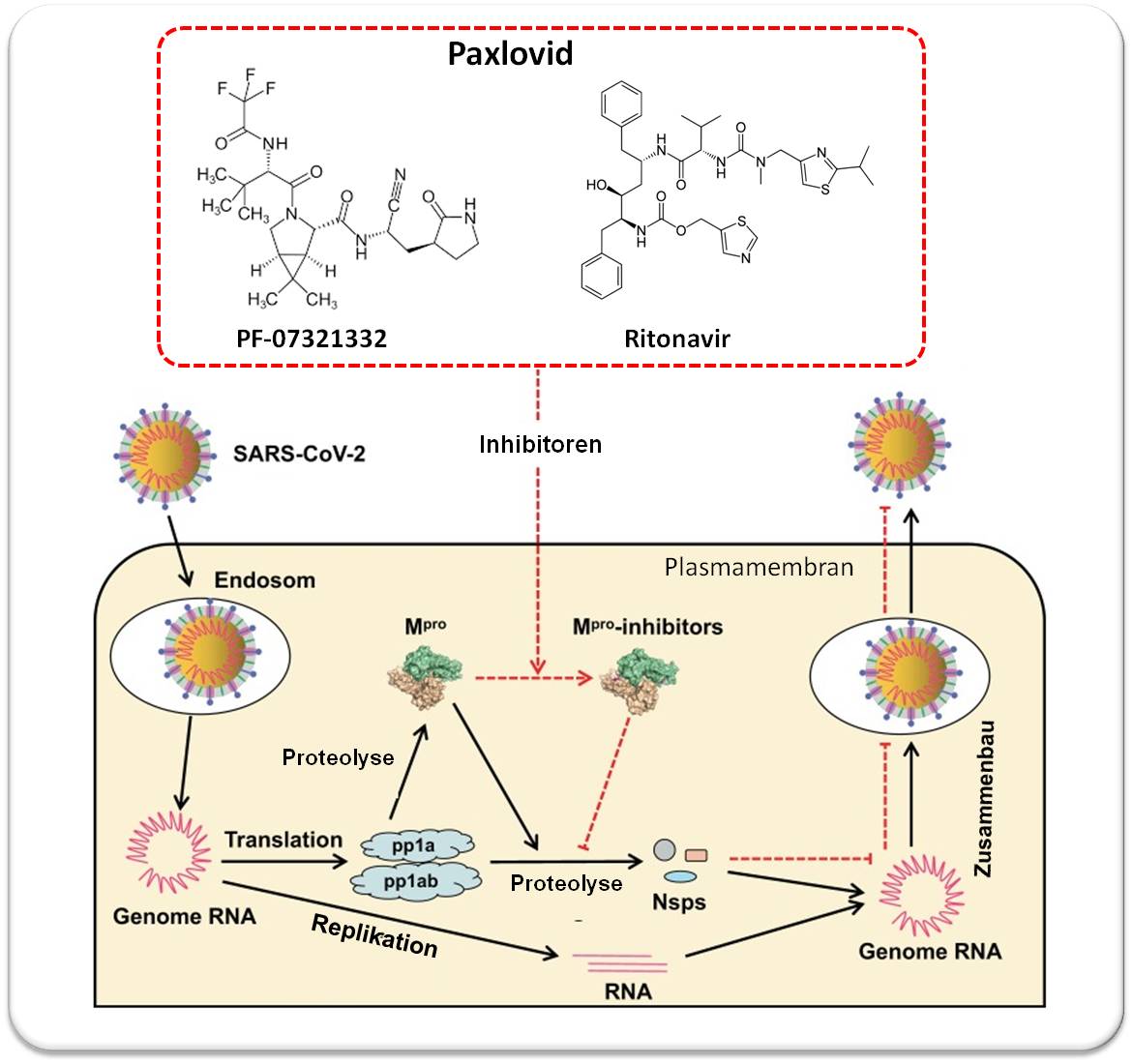
Im Fall von 332 ist eine von SARS-CoV-2 kodierte Protease namens Mpro (auch 3CL-Protease genannt) die Zielstruktur. Das Virus verwendet dieses Enzym, um einige längere virale Proteine in kürzere Abschnitte zu zerschneiden, die es zur Replikation benötigt. Wenn Mpro außer Gefecht gesetzt ist, kann das Coronavirus keine Kopien zur Infektion anderer Zellen mehr produzieren. Abbildung 1.
| Abbildung 1. Wie Paxlovid funktioniert. Wenn das Virus in die Wirtszelle eintritt, beginnt es (unter Verwendung der Wirtssysteme) seine RNA in Polyproteine (pp1a und pp1ab) umzuschreiben (Translation). Daraus entstehen durch Proteolyse die Virusprotease Mpro und einige Nicht-Strukturproteine (Nsps), welche für den Zusammenbau zum aktiven Virus essentiell sind. PF-0731332 ist ein sehr starker Inhibitor von Mpro, Ritonavir blockiert den Abbau von PF-0731332 und verlängert/erhöht ("boostert") so seine Wirksamkeit.(Bild und Beschriftung von Redn. eingefügt; Quelle: adaptiert nach H.M. Mengist et al., Signal Transduction and Targeted Therapy (2020) 5:67, https://doi.org/10.1038/s41392-020-0178-y. Lizenz: cc.by) |
Breite Wirksamkeit gegen andere Coronaviren?
Das Bestechende an diesem therapeutischen Ansatz ist, dass Mutationen an den Oberflächenstrukturen von SARS-CoV-2, wie dem Spike-Protein, die Wirksamkeit eines Protease-Inhibitors nicht beeinträchtigen sollten. Das Medikament zielt auf ein hochkonserviertes, essentielles virales Enzym ab. Ursprünglich hat Pfizer bereits vor Jahren Protease-Inhibitoren synthetisiert und präklinisch als potenzielle Therapeutika für das schwere akute respiratorische Syndrom (SARS) evaluiert, das durch ein mit SARS-CoV-2 nahe verwandtes Coronavirus verursacht wird. Dieses Medikament könnte somit sogar gegen andere Coronaviren wirksam sein, die eine Erkältung (grippalen Infekt) verursachen.
In der Anfang dieses Monats in Science [1] veröffentlichten Studie hat das Pfizer-Team unter der Leitung von Dafydd Owen (Pfizer Worldwide Research, Cambridge, MA) berichtet, dass die neueste Version ihres Mpro-Inhibitors in Labortests nicht nur gegen SARS-CoV-2 eine starke antivirale Aktivität zeigte, sondern auch gegen alle von ihnen getesteten Coronaviren, deren Infektiosität für Menschen bekannt ist. Weitere Studien an menschlichen Zellen und Modellen der SARS-CoV-2-Infektion an der Maus deuteten darauf hin, dass die Behandlung eine Limitierung der Infektion und eine Reduzierung der Schädigung des Lungengewebes bewirken könnte.
In dem Science-Artikel berichteten Owen und Kollegen auch über die Ergebnisse einer klinischen Phase-1-Studie an sechs gesunden Personen [1]. Sie zeigten, dass ihr Protease-Inhibitor bei oraler Einnahme sicher war und zur Bekämpfung des Virus ausreichende Konzentrationen im Blutkreislauf erreichen konnte.
Präliminäre Ergebnisse zu Paxlovid
Aber kann es gelingen, COVID-19 bei einer infizierten Person zu behandeln? Die vorläufigen Ergebnisse der größeren klinischen Studie mit der jetzt als PAXLOVID™ bekannten Pille sehen zweifellos ermutigend aus. PAXLOVID™ ist eine Formulierung, die den neuen Proteasehemmer mit einer niedrigen Dosis eines eingeführten Medikaments namens Ritonavir kombiniert. Ritonavir verlangsamt den Metabolismus einiger Proteasehemmer und hält sie dadurch länger im Körper aktiv (Ritonavir blockiert vor allem CYP3A4, das den Metabolismus und damit die Inaktivierung von 332 dominierende Enzym; Anm. Redn.).
An der klinischen Studie der Phase 2/3 nahmen rund 1.200 Erwachsene aus den USA und der ganzen Welt teil. Um rekrutiert zu werden, mussten die Studienteilnehmer eine in den letzten 5 Tagen bestätigte Diagnose von COVID-19, sowie leichte bis mittelschwere Krankheitssymptome haben. Dazu mussten sie zumindest auch ein Merkmal oder ein Befinden aufweisen, das mit einem erhöhten Risiko für einen schweren Krankheitsverlauf von COVID-19 verbunden ist. Die Studienteilnehmer wurden nach dem Zufallsprinzip ausgewählt, um fünf Tage lang alle 12 Stunden entweder das experimentelle antivirale Mittel oder ein Placebo zu erhalten.
Laut Pfizer-Mitteilung wurden bei Patienten, die innerhalb von drei Tagen nach dem Auftreten von COVID-19-Symptomen behandelt wurden, 0,8 Prozent (3 von 389) der PAXLOVID™ Gruppe innerhalb von 28 Tagen ins Krankenhaus eingeliefert, dagegen 7 Prozent (27 von 385) derjenigen, die das Placebo erhalten hatten. Ähnlich ermutigende Ergebnisse wurden bei denen beobachtet, die innerhalb von fünf Tagen nach Auftreten der Symptome behandelt worden waren. Von den mit dem antiviralen Medikament Behandelten wurde ein Prozent (6 von 607) ins Krankenhaus eingeliefert gegenüber 6,7 Prozent (41 von 612) aus der Placebo-Gruppe. Insgesamt gab es keine Todesfälle bei Personen, die PAXLOVID™ einnahmen; dagegen starben 10 Personen in der Placebogruppe (1,6 Prozent) in weiterer Folge.
Paxlovid - die Pille für zuhause?
Wenn der FDA-Review positiv ausgeht, besteht die Hoffnung, dass PAXLOVID™ als eine Behandlung für zu Hause verschrieben werden könnte, um einen schweren Krankheitsverlauf, Hospitalisierungen und Todesfälle zu verhindern.
Paxlovid würde dann längstens 5 Tage nach COVID-19-Diagnose/Auftreten von Symptomen über 5 Tage lang 2 x täglich in einer Dosierung von 300 mg PF-07321332 und 100 mg Ritonavir angewandt werden (Anm. Redn., [3])
Pfizer hat außerdem zwei zusätzliche Studien mit Paxlovid gestartet: i) eine bei Erwachsenen mit COVID-19, die ein normales Risiko für einen schweren Krankheitsverlauf haben (1140 Personen) und ii) eine andere Studie, die die Eignung von Paxovid zur Vorbeugung einer Infektion bei Erwachsenen untersucht, die dem Coronavirus durch ein Haushaltsmitglied ausgesetzt sind (2634 Teilnehmer).
Mittlerweile hat Großbritannien das andere kürzlich entwickelte antivirale Medikament Molnupiravir zugelassen, welches die Virusreplikation auf andere Weise verlangsamt: es blockiert die Fähigkeit des Virus sein RNA-Genom exakt zu kopieren. Die FDA wird am 30. November zusammentreffen, um den Antrag von Merck und Ridgeback auf eine Notfallzulassung von Molnupiravir zur Behandlung von leichtem bis mittelschwerem COVID-19 bei infizierten Erwachsenen mit hohem Risiko für schwere Erkrankungen zu erörtern [4].
Mit Thanksgiving und den schon nahen Winter- Feiertagen sind diese beiden vielversprechenden antiviralen Medikamente sicherlich weitere Gründe in diesem Jahr dankbar zu sein.
[1 ]An oral SARS-CoV-2 M(pro) inhibitor clinical candidate for the treatment of COVID-19.
Owen DR, Allerton CMN, Anderson AS, Wei L, Yang Q, Zhu Y, et al. Science. 2021 Nov 2: eabl4784.
[2] Pfizer’s novel COVID-19 oral antiviral treatment candidate reduced risk of hospitalization or death by 89% in interim analysis of phase 2/3 EPIC-HR Study. Pfizer. November 5, 2021.
[3] https://www.pfizer.com/news/press-release/press-release-detail/pfizer-seeks-emergency-use-authorization-novel-covid-19 Pfizer. November 16, 2021
[4] FDA to hold advisory committee meeting to Discuss Merck and Ridgeback’s EUA Application for COVID-19 oral treatment. Food and Drug Administration. October 14, 2021.
*Dieser Artikel von NIH-Director Francis S. Collins, M.D., Ph.D. erschien zuerst (am 16. November 2021) im NIH Director’s Blog unter dem Titel: "Early Data Suggest Pfizer Pill May Prevent Severe COVID-19". https://directorsblog.nih.gov/2021/11/16/early-data-suggest-pfizer-pill-may-prevent-severe-covid-19/. Der Artikel wurde von der Redaktion möglichst wortgetreu übersetzt und mit einigen Untertiteln und mit "Anm. Redn." gekennzeichneten Ergänzungen versehen. Zur anschaulichen Erläuterung des Wirkmechanismus von Paxlovid wurde von der Redn. auch eine Abbildung (plus Legende) eingefügt. Reprinted (and translated by ScienceBlog) with permission from the National Institutes of Health (NIH).
Weiterführende Links
National Institutes of Health: https://www.nih.gov/
COVID-19-Research: https:/covid19.nih.gov/
ClinicalTrials.gov: Accelerating COVID-19 Therapeutic Interventions and Vaccines (ACTIV): https://www.nih.gov/research-training/medical-research-initiatives/activ
Artikel von Francis S. Collins über COVID-19 im ScienceBlog
- 27.06.2021: Die Infektion an ihrem Ausgangspunkt stoppen - ein Nasenspray mit Designer-Antikörper gegen SARS-CoV-2
- 18.03.2021: Faszinierende Aussichten: Therapie von COVID-19 und Influenza mittels der CRISPR/Cas13a- Genschere
- 25.02.2021: Ist eine Impfstoffdosis ausreichend, um vor einer Neuinfektion mit COVID-19-zu schützen?
- 11.02.2021: Kartierung von Coronavirus-Mutationen - Virusvarianten entkommen Antikörperbehandlung
- 14.01.2021:Näher betrachtet: Auswirkungen von COVID-19 auf das Gehirn
- 22.10.2020:Schützende Antikörper bleiben nach überstandener SARS-CoV-2-Infektion monatelang bestehen
- 16.07.2020: Fortschritte auf dem Weg zu einem sicheren und wirksamen Coronaimpfstoff - Gepräch mit dem Leiter der NIH-COVID-19 Vakzine Entwicklung
- 07.05.2020: Die wichtigsten zellulären Ziele für das neuartige Coronavirus
- 16.04.2020:Können Smartphone-Apps helfen Pandemien zu besiegen?
- 05.03.2020: Strukturbiologie weist den Weg zu einem Coronavirus-Impfstoff
- Printer-friendly version
- Log in to post comments