Do, 08.10.2021 — Roland Wengenmayr
 Sowohl die Synthesen biologischer Verbindungen in der belebten Natur als auch über neunzig Prozent aller von der industriellen Chemie genutzten Reaktionen benötigen Katalysatoren, um die Prozesse effizient in der gewünschten Weise ablaufen zu lassen. In der Biosphäre vermitteln Enzyme in hochselektiver Weise den Kontakt und die Umsetzung der Ausgangsprodukte, in der Industrie vermitteln meistens Metalloberflächen - in der sogenannten heterogenen Katalyse - das Aufeinandertreffen und die Aktivierung der Reaktanten . Wie im zweiten Fall die einzelnen Schritte auf der molekularen Ebene ablaufen, konnte mit neuen Methoden der exakten Oberflächenforschung untersucht werden. Gerhard Ertl, ehem. Direktor am Fritz Haber Institut der Max-Planck-Gesellschaft, konnte so den Prozess der Ammoniaksynthese aus Stickstoff und Wasserstoff und die Oxydation von Kohlenmonoxid zu Kohlendioxid im Detail aufklären. Der Physiker und Wissenschaftsjournalist DI Roland Wengenmayr beschreibt diese Vorgänge.*
Sowohl die Synthesen biologischer Verbindungen in der belebten Natur als auch über neunzig Prozent aller von der industriellen Chemie genutzten Reaktionen benötigen Katalysatoren, um die Prozesse effizient in der gewünschten Weise ablaufen zu lassen. In der Biosphäre vermitteln Enzyme in hochselektiver Weise den Kontakt und die Umsetzung der Ausgangsprodukte, in der Industrie vermitteln meistens Metalloberflächen - in der sogenannten heterogenen Katalyse - das Aufeinandertreffen und die Aktivierung der Reaktanten . Wie im zweiten Fall die einzelnen Schritte auf der molekularen Ebene ablaufen, konnte mit neuen Methoden der exakten Oberflächenforschung untersucht werden. Gerhard Ertl, ehem. Direktor am Fritz Haber Institut der Max-Planck-Gesellschaft, konnte so den Prozess der Ammoniaksynthese aus Stickstoff und Wasserstoff und die Oxydation von Kohlenmonoxid zu Kohlendioxid im Detail aufklären. Der Physiker und Wissenschaftsjournalist DI Roland Wengenmayr beschreibt diese Vorgänge.*
Im frühen 19. Jahrhundert führten Wohlhabende ihren Gästen gerne ein Tischfeuerzeug vor, das sensationell mühelos eine Flamme produzierte. Erfunden hatte es der Chemieprofessor Johann Wolfgang Döbereiner im Jahr 1823. Es enthielt verdünnte Schwefelsäure und ein Stück Zink an einem Haken. Durch Betätigen des Auslösers wurde das Zink in das Säurebad getaucht und eine chemische Reaktion gestartet, bei der unter Bildung von Zinksulfat (Zinksalz der Schwefelsäure) Wasserstoff frei wurde. Dieser verbrannte mit dem Luftsauerstoff zu Wasser. Normalerweise sind Wasserstoff und Sauerstoff reaktionsträge, weshalb man ihnen durch Anzünden erst Energie zuführen muss. Im Feuerzeug entzündete sich der Wasserstoff jedoch spontan, indem er durch einen kleinen Platinschwamm geleitet wurde: das Platin wirkte als Katalysator.
Katalysatoren reinigen heute nicht nur Abgase. Über neunzig Prozent aller von der industriellen Chemie genutzten Reaktionen benötigen einen Katalysator als quasi „Heiratsvermittler“ der jeweiligen Ausgangsstoffe (Chinesen gebrauchen für beide Funktionen übrigens das gleiche Wort). Ohne Biokatalysatoren, vor allem Enzyme, gäbe es kein Leben. Der dänische Chemiker Jöns Jakob Berzelius leitete den Namen vom altgriechischen Wort katálysis für „Loslösung“ ab, denn offensichtlich nahmen diese Stoffe an der Reaktion nicht teil. Der deutsche Chemiker und Nobelpreisträger Wilhelm Ostwald prägte die heute noch gängige Definition: „Ein Katalysator ist jeder Stoff, der, ohne im Endprodukt einer chemischen Reaktion zu erscheinen, ihre Geschwindigkeit verändert.“ In Lehrbüchern steht allerdings meist, dass der Katalysator beschleunigend wirkt – „Reaktionsbremsen“ sind selten interessant.
Katalysatoren wirken als chemischer „Sesam öffne dich!“: Sie eröffnen einer Reaktion einen günstigen Pfad durch die Energielandschaft, der sonst verschlossen ist. Während einer Reaktion brechen zuerst chemische Bindungen in den Ausgangsmolekülen (Edukte) auf, dann bilden sich neue Bindungen. Dabei entstehen die Moleküle des Endstoffes (Produkt). Den Reaktionsweg verstellt jedoch oft ein mächtiger Energieberg.
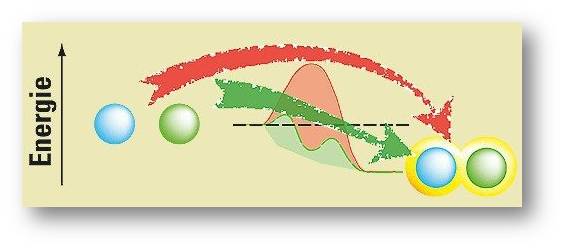
Um diesen zu bezwingen, brauchen die Moleküle Energie. Im Labor führt man sie meist als Wärmeenergie zu, was aber in der industriellen Großproduktion die Energiekosten explodieren lassen kann. Zudem kann starkes Erhitzen die beteiligten Moleküle zerstören. Der Katalysator umgeht diesen hemmenden Energieberg und lässt die Reaktion ohne viel Energiezufuhr ablaufen. Abbildung 1.
|
Abbildung 1: Ein hoher Energieberg (rot) verstellt die Reaktion zweier Mo¬leküle (blaue und grüne Kugel links). Sie kann nur ablaufen, wenn man ihr viel Energie zu¬führt (roter Pfeil). Ein Katalysator eröffnet einen alternativen, ener¬giesparenden Weg (grüner Pfeil): Über dessen Gefälle läuft die Reaktion dann von selbst ab, bis hin zum Endprodukt (rechts) |
Chemiker unterscheiden grundsätzlich zwei Arten von Katalyse: Bei der homogenen Katalyse befinden sich die Reagenzien und der Katalysator in der gleichen Phase, zum Beispiel in einer Lösung. Bei der heterogenen Katalyse dagegen stecken das Hochzeitspärchen und der Heiratsvermittler in verschiedenen Phasen. Bei technischen Anwendungen sind es oft Gase, während das Katalysatormaterial fest ist, zum Beispiel beim Autokat.
Eine dreifach harte Nuss
Einen besonderen Beitrag hat die heterogene Katalyse zur Welternährung geleistet – denn ohne sie gäbe es keine Ammoniaksynthese. Diese bindet den Stickstoff aus der Luft chemisch im Ammoniak, aus dem wiederum Stickstoffdünger produziert wird. Ohne diesen Dünger würden Ackerböden wesentlich weniger Frucht tragen. Nach einer Schätzung von Wissenschaftlern im Fachmagazin Nature müssten vierzig Prozent der Menschheit, also 2,4 Milliarden Menschen, verhungern, gäbe es nicht ausreichend Stickstoffdünger. Als sich Ende des 19. Jahrhunderts der Weltvorrat an natürlichem Salpeter, aus dem Stickstoffdünger produziert wurde, erschöpfte, drohte tatsächlich eine Hungerkatastrophe.
Dass Luft einen riesigen Stickstoffvorrat enthält (sie besteht zu 78 Prozent aus Distickstoffmolekülen), war den Chemikern bekannt. Allerdings verschloss eine chemische Dreifachbindung den Zugang: Sie „klebt“ die zwei Stickstoffatome bombenfest aneinander. Mit diesem Trick füllen die beiden Atome sich gegenseitig ihre lückenhaften Elektronenschalen und sparen viel Energie ein. An der dreifach harten Nuss scheiterten alle Chemiker – bis Fritz Haber sie 1909 knackte. Er entdeckte, dass Osmium als Katalysator unter hohem Druck die Ammoniaksynthese aus dem Distickstoff ermöglicht.
Leider ist Osmium extrem selten, doch der BASF-Chemiker Carl Bosch und sein Assistent Alwin Mittasch fanden Ersatz: Eisen in Form – wie wir heute wissen – winziger Nanopartikel, erwies sich ebenfalls als guter Katalysator. Allerdings benötigte die Reaktion einen Druck von mindestens 200 Atmosphären und Temperaturen zwischen 400 und 500 °C. Boschs Gruppe meisterte die Herausforderung und konstruierte einen Durchflussreaktor, der unter diesen Bedingungen kontinuierlich arbeitete. Schon 1913 startete die industrielle Produktion nach dem Haber-Bosch-Verfahren, das bis heute im Einsatz ist. Haber erhielt den Nobelpreis für Chemie im Jahr 1919, Bosch 1931.
Die chemische Reaktion der Ammoniaksynthese sieht eigentlich einfach aus: Aus einem Stickstoffmolekül und drei Wasserstoffmolekülen entstehen zwei Ammoniakmoleküle. Den Forschern gelang es jedoch nicht aufzudecken, was sich auf dem Eisenkatalysator genau abspielt. Klar war nur, dass die Anlagerung der Distickstoff-Moleküle an seiner Oberfläche, ihre Adsorption, die Geschwindigkeit der Reaktion bestimmte. Offen blieb aber, ob die Stickstoffmoleküle auf der Fläche zuerst in einzelne Stickstoffatome zerfallen und dann mit dem Wasserstoff reagieren oder ob das komplette Stickstoffmolekül reaktiv wird.
Neue Energielandschaften
Erst 1975 konnten der deutsche Physikochemiker Gerhard Ertl und sein Team zeigen, dass das Distickstoffmolekül tatsächlich zuerst zerfällt. Der spätere Max-Planck-Direktor setzte dafür die damals neuesten Methoden der Oberflächenforschung ein. Er untersuchte die katalytische Wirkung von perfekt glatten Eisenoberflächen im Ultrahochvakuum. Schneidet man durch nahezu fehlerlose Einkristalle, dann sind die Atome auf diesen Flächen in einem regelmäßigen Muster angeordnet. Unter solchen Idealbedingungen sollten sich die einzelnen Schritte des Katalyseprozesses leichter entschlüsseln lassen, so vermutete Ertl, als am Nanopartikel-Chaos echter Industriekatalysatoren.
Die Eisenatome an der Oberfläche unterscheiden sich von denjenigen, die tiefer im Kristall stecken. Jedes Atom ist dort auf allen Seiten von Nachbaratomen umgeben, die seinen Hunger nach chemischen Bindungen sättigen. An der Oberfläche dagegen liegen die Atome offen; sie haben sozusagen eine chemische Hand frei. Kommt ein Stickstoffmolekül vorbei, dann können sie es an sich binden. Das passiert allerdings nur in etwa einem von einer Million Fällen. Das gebundene Stickstoffmolekül erfährt auf der Eisenoberfläche eine radikal veränderte Energielandschaft: Plötzlich verliert die starke Dreifachbindung ihren Energiegewinn. Die Stickstoffatome lösen sich und werden frei. Dem Wasserstoff-Molekül des gasförmigen Wasserstoffs ergeht es genauso, doch dessen Einfachbindung ist ohnehin recht locker. Die freien Stickstoff- und Wasserstoffatome können nun ihre chemische Hochzeit feiern.
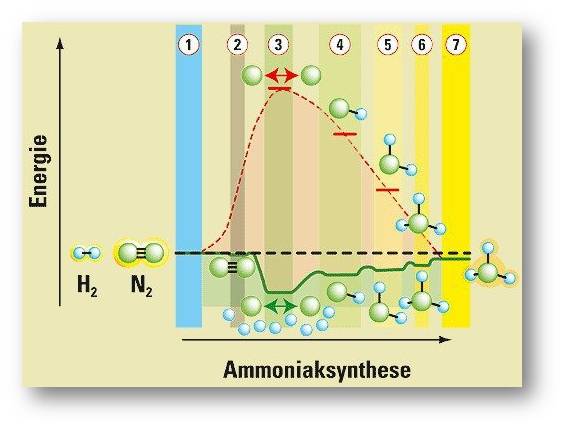
Ertls Gruppe schaffte es, den kompletten Ablauf der komplexen Ammoniaksynthese zu entschlüsseln und zu zeigen, wie man sie optimiert. (Abbildung 2) Doch für viele kinetisch anspruchsvollere Reaktionen gilt Katalyseforschung auch heute noch als „Schwarze Kunst“ – nach wie vor müssen die Forscher viele Mixturen ausprobieren. Gerhard Ertl führte in das Gebiet die exakten Methoden der Oberflächenforschung ein. Dafür bekam der Direktor am Berliner Fritz-Haber-Institut der Max-Planck-Gesellschaft, der inzwischen im Ruhestand ist, 2007 den Nobelpreis für Chemie.
|
Abbildung 2: Die wichtigsten Schritte der Ammoniaksynthese (rote Energiekurve ohne, grüne mit Katalysator). 1. Die N2¬- und H2¬-Moleküle (blaue bzw. grüne Kugeln) liegen frei vor. 2. Das N2¬-Molekül haftet sich an die Eisenoberfläche. 3. Die adsorbierten N2¬- und H2¬-Moleküle zerfallen zu freien N¬- und H¬-Atomen. Es enstehen NH (4.), NH2, (5.) und NH3 (6.). 7. Das fertige Ammoniakmolekül NH3 hat sich von der Eisenoberfläche gelöst. Die Produktion von 1 kg Ammoniak würde ohne Katalysator rund 66 Millionen Joule verbrauchen (etwa die Verbrennungswärme von 1,5 kg Rohöl). Auf der idealen Einkristalloberfläche setzt sie dagegen 2,7 Millionen Joule an Energie frei. © Grafik: R. Wengenmayr nach G. Ertl |
Zu Ertls Forschungsobjekten gehörte auch der Drei-Wege-Katalysator in Benzinautos. Er heißt so, weil er drei gefährliche Abgasbestandteile, die während der Verbrennung entstehen, in harmlose Gase umwandelt. Geeignete Katalysatoren sind Platin, Rhodium und Palladium. Auf einem Reaktionsweg oxidiert der „Kat“ das giftige Kohlenmonoxid (CO) mit Sauerstoff (O2) zum ungiftigen Kohlendioxid (CO2). Der zweite Weg ist die Oxidation giftiger Kohlenwasserstoff-Verbindungen zu Kohlendioxid und Wasser. Auf dem dritten Weg reduziert er schädliche Stickoxide (NOx) zu ungefährlichem Distickstoff (N2).
Der Max-Planck-Forscher untersuchte die Oxidation von Kohlenmonoxid (2CO + O2 zu 2 CO2) allerdings auf Platinoberflächen. „Die Kohlenmonoxid-Oxidation an Platin ist unsere Drosophila“, spielt Ertl auf das Modelltierchen der Biologen an. Sie testet stellvertretend für komplexere Reaktionen zuverlässig, wie aktiv die Oberfläche eines Oxidationskatalysators ist. Die Berliner trieben Anfang der 1980er-Jahre diese Reaktion in einen extremen Ungleichgewichtszustand. Die Katalyse produzierte daraufhin nicht mehr gleichmäßig Kohlendioxid, sondern schwang wie ein Pendel zwischen „keine Reaktion“ und „Reaktion“ hin und her. Abbildung 3.
Dabei breiten sich die Gebiete, die gerade CO2 produzieren, als Spiralwellen über die Platinfläche aus. Die Platinatome schwingen mit den CO¬- und O2¬-Molekülen im Wechsel, und die atomare Landschaft der Katalysatoroberfläche springt zwischen zwei verschiedenen Formen hin und her. Gerhard Ertl faszinieren solche Selbstorganisationsprozesse fernab langweiliger Gleichgewichte: „Das ist auch die Grundlage der ganzen Biologie!
|
Abbildung 3: Die schwingende Oxidationsreaktion des Kohlenmonoxids wandert in Spiralwellen über die Oberfläche des Platin-Katalysators. An den hellen Stellen sitzen Kohlenmonoxid-Moleküle, die noch nicht reagiert haben. Das Bild hat ei¬nen Durchmesser von etwa 500 Mikrometern (Millionstel Meter). © Fritz-Haber-Institut |
Offenbar ist die Lehrbuchmeinung, dass Katalysatoren von der Reaktion unbeeindruckt bleiben, idealisiert. Das bestätigt auch Ferdi Schüth, Direktor am Max-Planck-Institut für Kohlenforschung in Mülheim: „Manche Katalysatoren verändern sich unter Reaktionsbedingungen ganz dramatisch!“ Viele technische Katalysatoren brauchen erst eine Anlaufphase, um aktiv zu werden. Diese Aktivität verlieren sie dann wieder allmählich durch Alterungsprozesse.
Die Mülheimer erforschen feste Katalysatoren, wie sie technisch eingesetzt werden. Wie schwierig dieses Terrain ist, demonstriert Schüth mit elektronenmikroskopischen Aufnahmen. Anstatt glatter Flächen zeigen sie wild zerklüftete Mikrolandschaften des Trägermaterials, in denen die Nanopartikel des Katalysators wie verstreute Felsbrocken stecken. Diese poröse Struktur verleiht technischen Katalysatoren eine riesige Oberfläche, die den reagierenden Molekülen ein möglichst großes Spielfeld bieten soll. Ein Gramm der Eisenkatalysatoren für die Ammoniaksynthese zum Beispiel birgt in sich zwanzig Quadratmeter Oberfläche – also einen kompletten, zusammengeknüllten Zimmerboden! Das macht sie so enorm aktiv.
Ähnlich sieht es auch im Drei-Wege-Katalysator aus. Wie viele technische Katalysatoren leidet er zum Beispiel an der hohen Betriebstemperatur, die bis auf 800 °C steigen kann. Auf dem heißen Trägermaterial beginnen die Nanopartikel des Katalysators zu wandern. Bei diesem „Sintern“ lagern sie sich gerne zu größeren Klumpen zusammen. Das kann ihre gesamte Oberfläche und damit ihre Aktivität empfindlich reduzieren. „Deshalb wollen wir einen Katalysator entwickeln, der sinterstabil ist“, sagt Schüth. Dazu sperren die Mülheimer ihre Katalysatorpartikel in molekulare Käfige, die so klein sind, dass die Partikel ihnen nicht entkommen und zusammen sintern können. Diese Käfige besitzen aber Poren, die groß genug sind, damit die an der Oxidationsreaktion beteiligten Moleküle hindurch schlüpfen können. Das Mülheimer Modellsystem besteht aus Goldpartikeln. Seine Aktivität testen die Forscher wieder mit der Standardreaktion, der Oxidation von Kohlenmonoxid zu Kohlendioxid. Erprobt ist die Technik an Goldteilchen mit 15 Nanometern (Milliardstel Meter) Durchmesser.
Nanorasseln für`s Auto
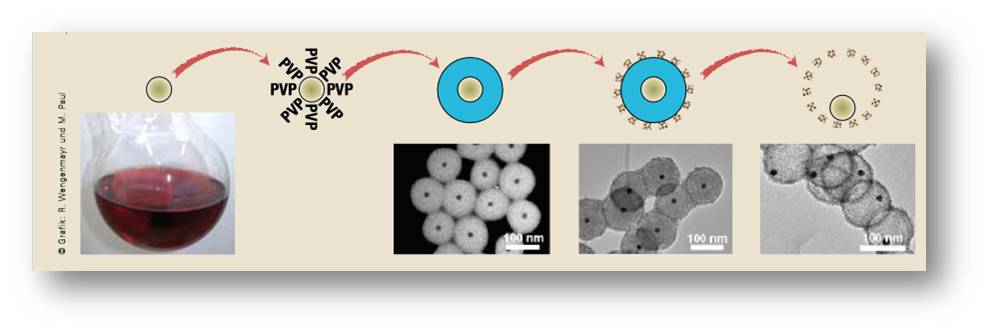
Schüths Mitarbeiter Michael Paul erklärt das Verfahren (Abbildung 4): „Wir bedecken zuerst die Goldpartikel mit einer Schicht aus Polyvinylpyrrolidon.“ Diese Polymermoleküle, kurz PVP genannt, verhindern, dass die Goldpartikel sich am Gefäßboden absetzen oder aneinander haften.
|
Abbildung 4: Herstellungsschritte des sinterstabilen Katalysators. (von links nach rechts): Die Goldpartikel bekommen eine Schicht aus PVP¬-Polymeren.Die Chemiker umgeben es mit einer Schicht aus Siliziumdioxid, danach mit einer dünnen Schicht aus Zirconiumoxidkristallen. Durch deren Poren lösen sie das Siliziumdioxid auf. Übrig bleibt eine hohle Zirconiumoxidkugel (rechts), die das lose Goldpartikel einschließt. Unten: elektronenmikroskopische Bilder zu diesen Schritten (ein Nanometer entspricht einem Milliardstel Meter). © Grafik: R. Wengenmayr und M. Paul |
Im nächsten Schritt setzen die Mülheimer der Lösung eine Silicatverbindung zu. Nun wirken die langen PVP-Moleküle wie Anker, in denen sich Siliziumdioxid (SiO2) aus der Lösung verfängt. „Sie funktionieren wie molekulare Staubsauger“, sagt Paul. Die Forscher lassen diesen Stöber-Prozess, benannt nach dem Physiker Werner Stöber, eine Weile laufen. Dabei wächst um das Goldpartikel ein Mantel aus Siliziumdioxid – wie bei einer Perle. Seine Schichtdicke können die Mülheimer zwischen 100 und 400 Nanometern einstellen, indem sie entsprechend lange warten.
„Danach packen wir die Partikel in eine sehr dünne Hülle aus Zirconiumoxidkristallen ein“, erläutert Paul, „und erhitzen sie auf 900 Grad Celsius, um sie zu stabilisieren“. Nun kommt der Trick: Die nur 15 bis 20 Nanometer dünne Zirconiumoxidhülle hat kleine Poren mit grob fünf Nanometern Durchmesser. Durch diese lassen die Forscher eine Natriumhydroxidlösung eindringen, die das Siliziumdioxid auflöst. Übrig bleibt eine hohle Zirconiumoxid-Nanokugel mit einem losen Goldpartikel. „Wir haben eine Nanorassel“, lacht Paul.
Tests zeigen, dass diese Nanorasseln über 800 Grad Celsius aushalten und zudem auch mechanisch sehr stabil sind. Als Katalysatoren oxidieren sie Kohlenmonoxid zuverlässig zu Kohlendioxid, ohne durch Sintern an Aktivität zu verlieren. Allerdings sind die 15-Nanometer-Goldpartikel kein sehr guter Katalysator. Technisch interessant werden erst kleinere Partikel mit nur wenigen Nanometern Durchmesser. Zudem sind andere Materialien wie zum Beispiel Platin aktiver. Deshalb arbeiten die Mülheimer Verpackungskünstler derzeit an einem System mit kleineren Platinpartikeln. Vielleicht haben unsere Autos bald Nanorasseln im Auspuff.
* Der Chemie-Nobelpreis ist eben für die Entdeckung einer neuen Art von Katalysatoren - kleinen organischen Molekülen - vergeben worden, die eine Revolution für Synthesen in Akademie und Industrie darstellen (s.u.). Wie die bislang, größtenteils auf Metallen basierenden Katalysatoren funktionieren, zeigt der obige Artikel. Er ist erstmals unter dem Title: "Alles ganz schön oberflächlich –warum Forscher noch mehr über Katalyse wissen wollen" in TECHMAX 10 der Max-Planck-Gesellschaft erschienen https://www.max-wissen.de/230626/Techmax-10-Web.pdf und steht unter einer CC BY-NC-SA 4.0 Lizenz. Der Artikel ist hier ungekürzt wiedergegeben.
Nobelpreis für Chemie 2021: Press release: https://www.nobelprize.org/prizes/chemistry/2021/press-release/und
Popular information: Their tools revolutionised the construction of molecules. https://www.nobelprize.org/prizes/chemistry/2021/popular-information/
B. List, 07.10.2021: Ein Leben ohne Katalyse ist nicht denkbar. Organokatalyse - eine neue und breit anwendbare Synthesemethode
- Printer-friendly version
- Log in to post comments