Antibiotika schädigen die Mucusbarriere des Dickdarms und erhöhen so das Risiko für entzündliche Darmerkrankungen
So,15.09.2024 — Redaktion
Eine neue Studie der Bar-Ilan-Universität zeigt auf, wie die Einnahme von Antibiotika das Risiko einer chronisch entzündlichen Darmerkrankung (CED) erhöht. Demnach führt bereits kurzzeitige Antibiotikabehandlung zum Zusammenbruch der schützenden Mucusbarriere, die Darmwand samt Immunzellen vor schädlichen Mikroorganismen im Darmlumen abschirmt. Die Schädigung der Mucusbarriere erfolgt offensichtlich dadurch, dass Antibiotika direkt die Schleimsekretion in den dafür verantwortlichen Becherzellen hemmen. In einem Mausmodell der CED führte der Antibiotika bedingte Mangel an Schleimproduktion zum Eindringen von Bakterien in die Darmschleimhaut, zum Auftauchen mikrobieller Antigene im Blutkreislauf und zur Verschlimmerung von Ulzerationen.
Mit der Entdeckung der ersten Antibiotika vor rund 100 Jahren setzte eine neue Ära der Medizin ein. Diese Wundermittel haben ehemals fatal verlaufende mikrobielle Infektionen zu (leicht) behandelbaren Erkrankungen gemacht, neue medizinische Verfahren ermöglicht, die von komplizierten Operationen, Transplantationen bis hin zu Krebsbehandlungen reichen, und so wesentlich dazu beigetragen, dass wir nun um Jahrzehnte länger leben als unsere Vorfahren. Allerdings hat der breite, allzu häufige und unsachgemäße Einsatz der Antibiotika nicht nur in der Humanmedizin, sondern auch im Tiergebiet (Massentierhaltung) bei vielen menschlichen Krankheitserregern zur Entwicklung von Arzneimittelresistenzen geführt. Es ist dies eine bedrohliche Situation, da neue, gegen (multi)resistente Bakterien wirksame Antibiotika derzeit fehlen.
Antibiotika und das Mikrobiom
Ein wesentliches Argument für den überaus hohen Einsatz der Antibiotika war, dass diese ja nur gegen mikrobielle Prozesse gerichtet sind, welche im menschlichen/tierischen Organismus nicht vorkommen. Natürlich wurde es zunehmend klar, dass neben der Vernichtung der schädlichen Mikroben auch Billionen unserer nützlichen mikrobiellen Mitbewohner - vor im Mikrobiom des Verdauungstrakts - durch Antibiotika empfindlich gestört/zerstört werden können. Wie die in den letzten Jahren boomende Mikrobiomforschung zeigt, gehen vom Mikrobiom im Darm Signale aus, die Verbindungen zu diversen Körperorganen - Achsen, darunter die bidirektionale Darm-Hirn-Achse - bilden, deren Stoffwechsel, Immun-, Nerven- und Hormonsysteme beeinflussen und so zur Homöostase der Organe beitragen. Als Folge wird daher angenommen, dass viele, in Zusammenhang mit Antibiotikaeinsatz stehende weitverbreitete Krankheiten - von neuro-immunologischen Entwicklungsstörungen bei (Klein)kindern über Fettleibigkeit, Diabetes bis hin zu chronischen Entzündungen - auf eben die Störung des Mikrobioms zurückzuführen sind. Zu diesen Entzündungen werden auch chronisch entzündliche Darmerkrankungen (CED) gezählt.
Antibiotika und chronisch entzündliche Darmerkrankungen
Von entzündlichen Darmerkrankungen - die wichtigste Arten sind Morbus Crohn und Colitis ulcerosa - sind derzeit rund 7 Millionen Menschen betroffen und diese Zahl ist im Steigen begriffen. Die Ursachen sind noch sehr schwammig mit einem komplexen Zusammenspiel von genetischer Veranlagung, Umweltfaktoren, einem deregulierten Immunsystem und dem Mikrobiom des Darms beschrieben. Epidemiologische Studien aus den letzten Jahren haben einen engen dosisabhängigen Zusammenhang zwischen der Anwendung von Antibiotika und dem Risiko für die Entwicklung von CED gezeigt [1].
|
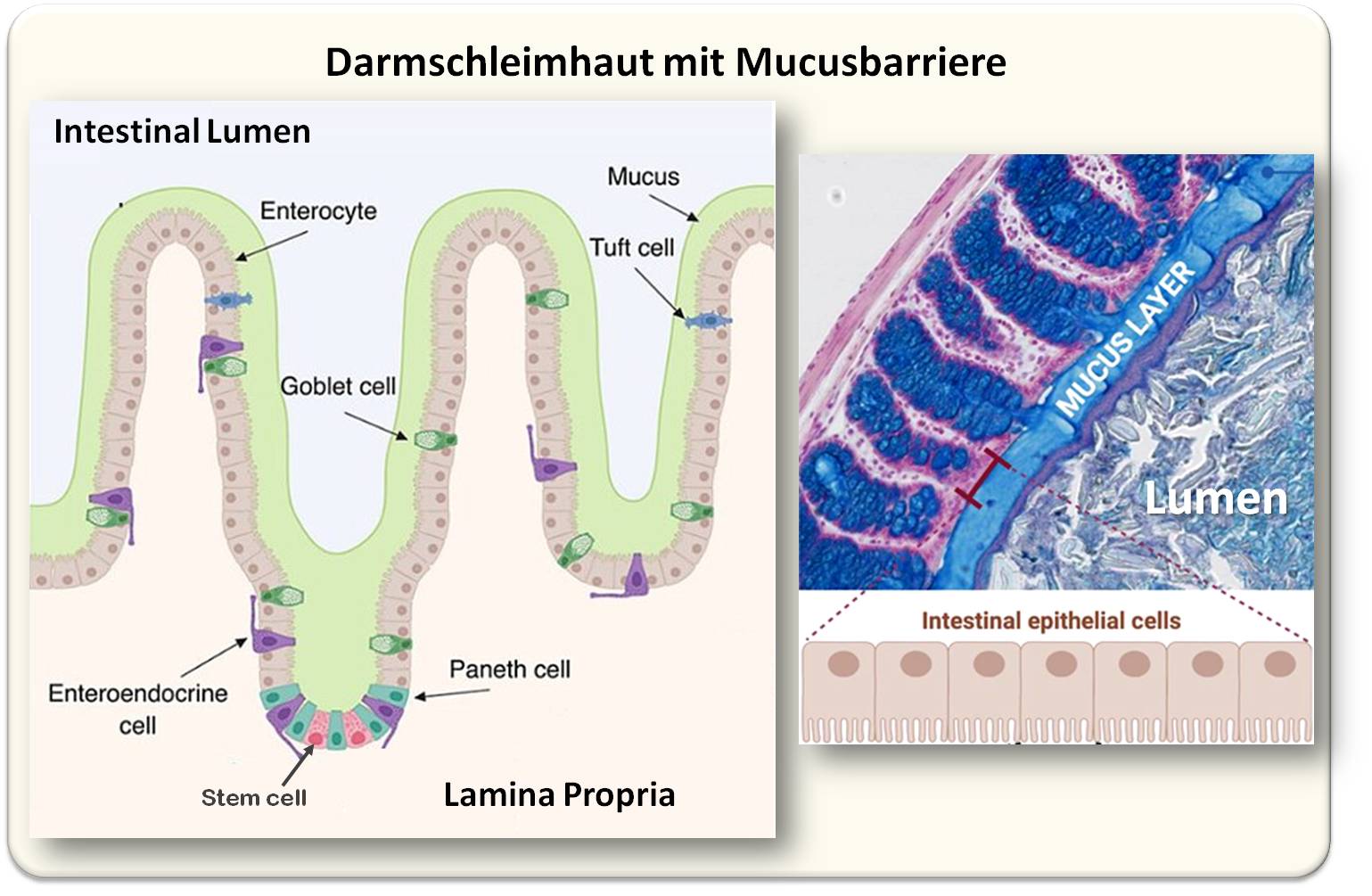
Abbildung 1. Die Darmschleimhaut (Darmmucosa), schematische Darstellung (links) und Gewebeschnitt (rechts). Die Darmmucosa nimmt Nährstoffe aus dem Darmlumen auf und ist gleichzeitig Barriere gegen das Eindringen von Partikeln und Mikroorganismen. Sie setzt sich aus den Epithelzellen, der darunter liegenden Trägerschicht aus Bindegewebe (Lamina propria) und der als Grenzschschicht zum Darmlumen liegenden Schleimschichte (Mucus) zusammen. Epithelzellen: Enterozytendienen der Resorption von Nährstoffen, dem Ionentransport. Goblet Zellen (Becherzellen) sezernieren Mucine (Schleim). Panethzellen (vor allem im Dünndarm bewirken lokale Immunabwehr. Enteroendokrine Zellen produzieren (Gewebs)Hormone, die auch in die Blutbahn abgegeben werden. Tuft Zellen (Bürstenzellen) sind chemosensorische Zellen, die in der Immunantwort.eine Rolle spielen. Nicht gezeigt: Die Lamina propria enthält Zellen der Immunabwehr -Makrophagen, T-Zellen, dendritische Zellen. (Bild links:modifiziert nach A. I. Wells & C. B. Coyne (2023), https://doi.org/10.3390/v11050460; Lizenz: cc-by-sa. Bild rechts: modifiziert nach P. Paone & P.D. Cani (2020), https://doi.org/10.1136/gutjnl-2020-322260; Lizenz cc-by.-nc) |
Ein Forscherteam unter Shai Bel von der Bar-Ilan-Universität (Ramat Gan, Israel) berichtet nun über entscheidende neue Erkenntnisse auf welche Weise Antibiotika zur Entstehung von chronisch entzündlichen Darmerkrankungen beitragen [2]:
Ausgehend von der Hypothese, dass Antibiotika im Darm nicht nur Mikroorganismen sondern auch Strukturen des Wirtsorganismus direkt angreifen können, haben die Forscher festgestellt, dass Antibiotika den Zusammenbruch der zwischen Darmepithel und Darmlumen liegenden, schützenden Mucusbarriere bewirken.
Zum besseren Verständnis dieser Ergebnisse veranschaulicht Abbildung 1 die Darmschleimhaut (Darmmucosa) mit den wesentlichen Zelltypen und der als Grenzschschicht zum Darmlumen liegenden Mucusbarriere.
Die Mucusbarriere des Darms
Schleim - Mucus - liegt als Schichte (in mehreren Schichten) auf der Darmschleimhaut auf und separiert den Inhalt des Darmlumens mit seinen Stoffwechselprodukten, Verdauungsresten und dem Mikrobiom von der Darmwand. Der Schleim besteht aus Mucinmolekülen - Glykoproteinen -, die von Becherzellen (goblet cells) im Darmepithel abgesondert werden und ein hydratisiertes Gel bilden. Dieses erleichtert den Transport der Verdauungsprodukte im Darmlumen, schützt die Darmwand vor Verdauungsenzymen und verhindert, dass große Partikel und Billionen von Mikroorganismen direkt mit der Epithelzellschicht in Berührung kommen; kleine Moleküle können jedoch durch das Gel hindurch zu den absorbierenden Darmzellen passieren.
Antibiotika wirken direkt auf die Mucusbarriere
|
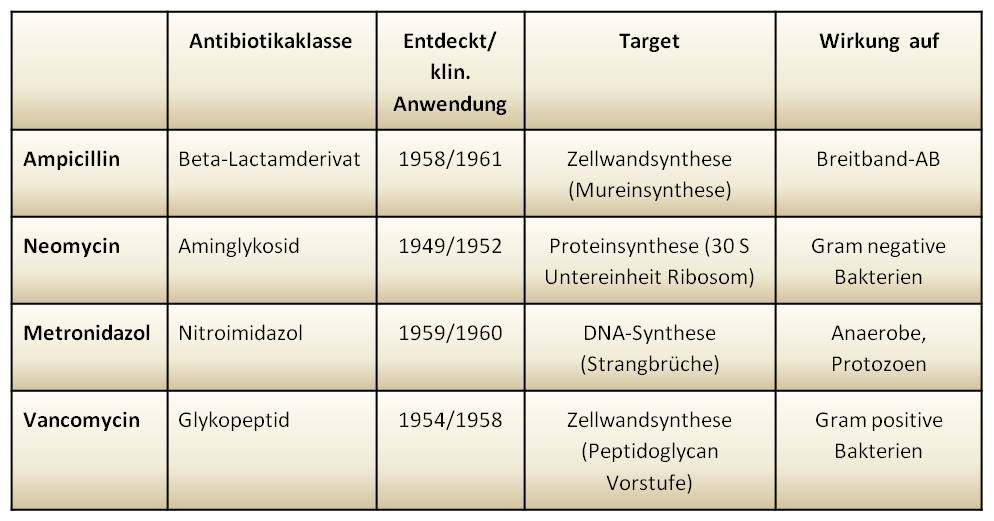
Tabelle. Charakteristika der 4 untersuchten Antibiotika |
Die in [2] berichteten Studien wurden an Mäusemodellen durchgeführt. Mit dem Ziel eine kurzzeitige Antibiotikabehandlung an Patienten zu imitieren, erhielten die Tiere drei Tage lang 2 x täglich Antibiotika oral verabreicht. Es handelte ich dabei um 4 klassische, seit mehr als 60 Jahren angewandte Antibiotika - Ampicillin, Neomycin, Metronidazol und Vancomycin -, die aus unterschiedlichen Antibiotikaklassen stammen, unterschiedliche Wirkungsmechanismen und Wirkspektren haben (siehe Tabelle). Eine Kontrollgruppe erhielt gepufferte Kochsalzlösung. Nach Tötung der Tiere wurden dann Gewebe und Blut entnommen und mit unterschiedlichen Techniken wie Fluoreszenzmikroskopie, Messung der Schleimsekretion, RNA-Sequenzierung und maschinellem Lernen untersucht.
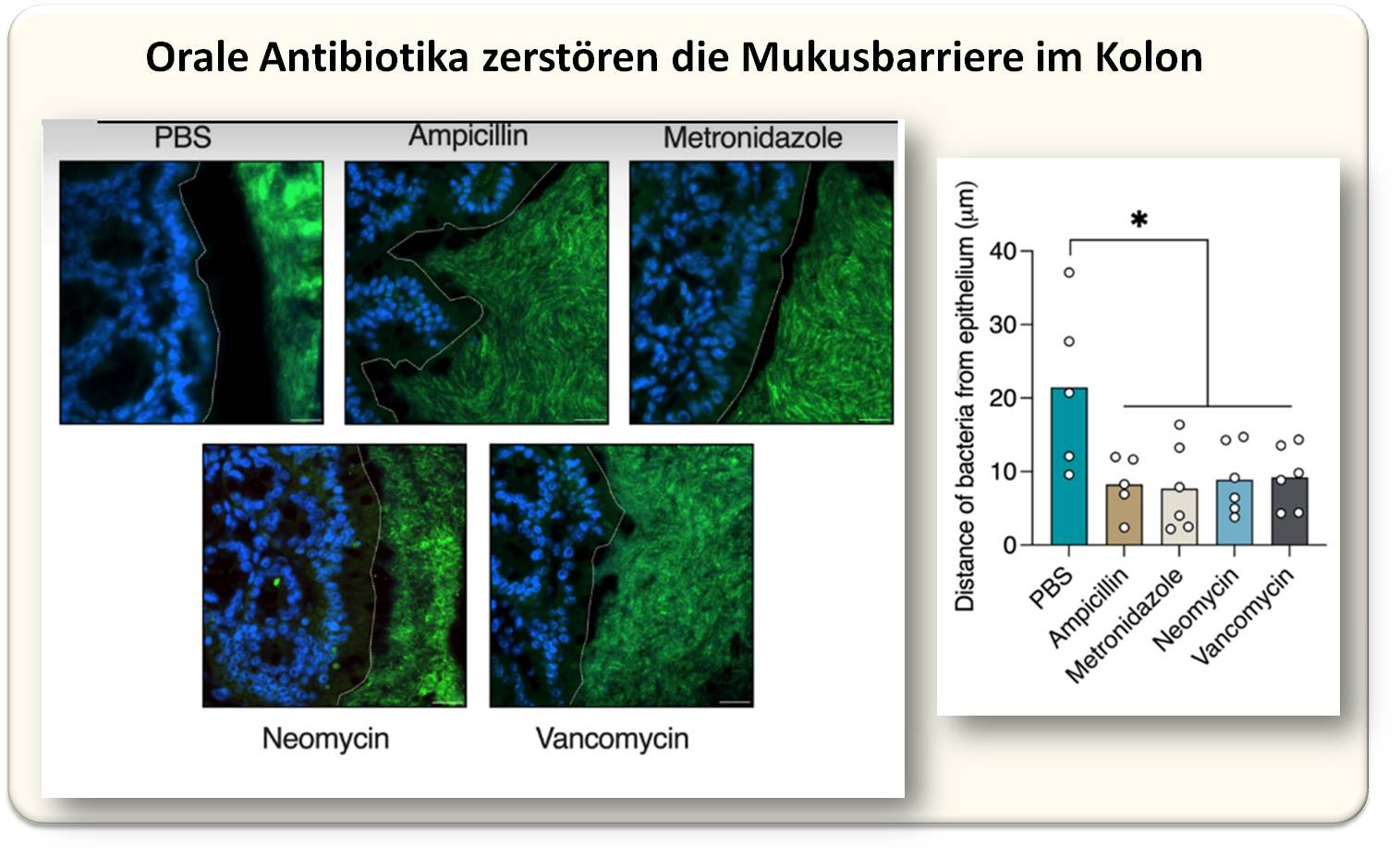
Das erstaunliche Ergebnis: Unabhängig von der Art des getesteten Antibiotikums, hat die kurzzeitige orale Behandlung in allen 4 Fällen zum Zusammenbruch der Mucusbarriere geführt; die räumliche Trennung von Epithelzellen/Immunzellen der Darmschleimhaut und den Mikroorganismen im Darmlumen wurde damit aufgehoben. Abbildung 2. Die Mikroben kommen so in direkten Kontakt mit dem Gewebe des Wirts und können eine Immunreaktion auslösen.
Tatsächlich wird sowohl in Tiermodellen für CED als auch bei Patienten mit CED ein Zusammenbruch der Mucusbarriere beobachtet.
|
Abbildung 2. Abbildung 2. Kolongewebe von Mäusen, die oral mit den angegebenen Antibiotika oder mit gepufferter Kochsalzlösung (PBS) behandelt wurden. Links: Fluoreszenz-in situ-Hybridisierung. Die Bakterien sind grün gefärbt, die Zellkerne des Wirts blau. Die gestrichelten weißen Linien markieren den Rand des Wirtsepithels. Maßstabsbalken, 20 μm. Rechts: Quantifizierung des Abstands zwischen luminalen Bakterien und Wirtsepithel. Jeder Punkt repräsentiert die Ergebnisse von einer Maus. (Bild aus J. Sawaed et al., 2024 [2], Lizenz cc-by). |
Mit Hilfe weiterer Untersuchungen, u.a. durch Antibiotikabehandlung von keimfreien Mäusen, Transplantation des fäkalen Mikrobioms und in vitro Studien zur Schleimsekretion der Becherzellen, stellten die Forscher fest, dass die Schädigung der Mucusbarriere unabhängig von der Antibiotika-bedingten Veränderung des Mikrobioms erfolgt. Antibiotika lösen direkt in den für die Schleimsekretion verantwortlichen Becherzellen (siehe Abbildung 1) eine Stressreaktion aus, die zur Hemmung der Mucussekretion führt.
In einem weiteren Mausmodell für CED führte die durch Antibiotika blockierte Schleimsekretion zum Eindringen von Bakterien in die Darmschleimhaut, zur Verlagerung mikrobieller Antigene in den Blutkreislauf und zur Verschlimmerung von Ulzerationen.
----------------------------------------------
Summa summarum: Antibiotika schädigen nicht nur Bakterien, sondern auch Wirtszellen. Die orale Einnahme von Antibiotika kann infolge der gehemmten Mucusproduktion die Entstehung von Darmentzündungen begünstigen.
[1] A. S. Faye et al., Antibiotic use as a risk factor for inflammatory bowel disease across the ages: A population-based cohort study. Gut 72, 663–670 (2023).
[2] J. Sawaed et al, Antibiotics damage the colonic mucus barrier in a microbiota-independent manner, Science Advances (2024). www.science.org/doi/10.1126/sciadv.adp4119
- Printer-friendly version
- Log in to post comments