Di, 17.06.2025— Inge Schuster
Das erst 2012 entdeckte glymphatische System des Gehirns ist ein Netzwerk von Kanälchen, die das Einströmen von Gehirnflüssigkeit samt den darin enthaltenen Nährstoffen ins Gehirngewebe und das Ausströmen samt den gelösten, potentiell neurotoxischen Abbauprodukten - darunter beta-Amyloid und Tau-Protein, die mit der Alzheimerkrankheit in Verbindung gebracht werden - regulieren. Im Tierversuch konnte festgestellt werden, dass dieser Flüssigkeitsstrom durch das Gehirn und damit die "Abfallbeseitigung" praktisch nur während des Schlafs stattfindet. Ein von Applied Cognition entwickeltes Gerät erweist sich als geeignet, um erstmals unter möglichst natürlichen Bedingungen und zeitaufgelöst die Biologie des glymphatischen Systems und dessen Fehlfunktionen am Menschen zu untersuchen, frühzeitig Personen mit beeinträchtigter Funktion zu identifizieren und therapeutische Strategien gegen die stark im Zunehmen begriffenen neurodegenerativen Erkrankungen zu prüfen.
Unser Gehirn hat einen sehr hohen Energiebedarf. Mit nur etwa 2 % der Körpermasse, braucht es 20 % unseres gesamten Energieumsatzes und etwa 15 % des Bluts das pro Minute vom Herzen in den Kreislauf gepumpt wird. Ein dichtes komplexes Netzwerk an Blutgefäßen durchdringt das gesamte Gehirn bis zu den einzelnen Zellen und führt diesen Sauerstoff und Nährstoffe zu. Die speziell abgedichtete Wand der Gefäße, die sogenannte Blut-Hirnschranke, sorgt dafür, dass außer kleinen fettlöslichen Molekülen nur bestimmte, für den Stoffwechsel wichtige Stoffe ins Hirngewebe gelangen wie vor allem Glukose - die Hauptenergiequelle des Gehirns -, Aminosäuren, Ionen, Vitamine und einige Hormone. Der darauf aufbauende Stoffwechsel der Hirnzellen ist sehr intensiv und lässt in großer Menge auch problematische Abbauprodukte entstehen, die rasch und effizient beseitigt werden müssen, um Sicherheit und Funktion der Nervenzellen nicht zu beeinträchtigen. Im restlichen Körper werden Stoffwechsel-Abfallprodukte aus den Zwischenräumen von Zellen (dem Interstitium) durch ein Netzwerk von Lymphgefäßen unidirektional in den systemischen Kreislauf abtransportiert, wo sie (nach Möglichkeit abgebaut ) und eliminiert werden. Solche Gefäße sind nur in den Hirnhäuten anzutreffen, fehlen aber im inneren Gehirngewebe (Gehirnparenchym).
Was ist das glymphatische System?
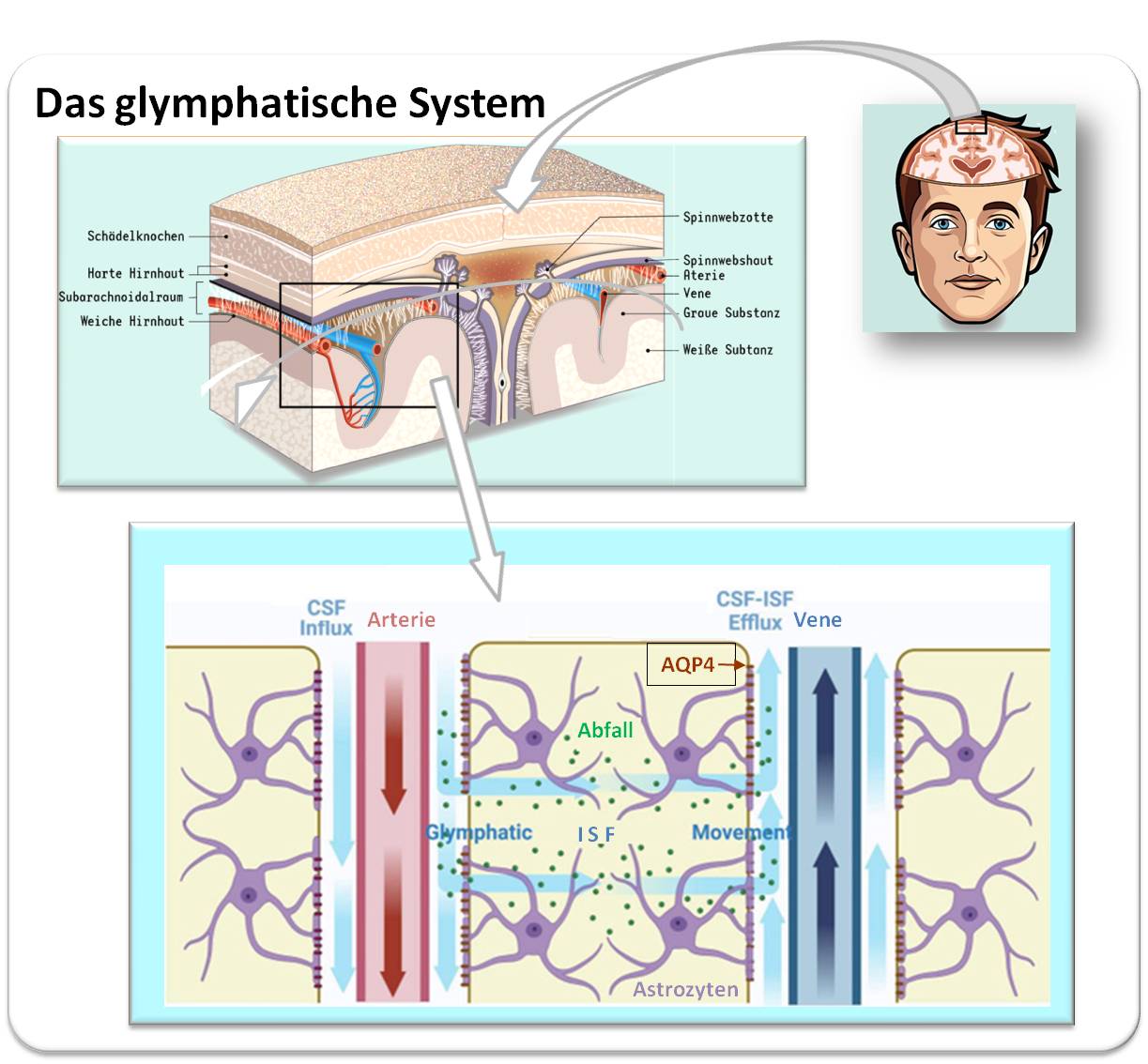
Wie der Abfall im Gehirn beseitigt wird, blieb lange ein Rätsel. Dem Team um die dänische Neurobiologin Maiken Nedergaard (University of Rochester, NY und Universität Kopenhagen) gelang es 2012 mit Hilfe der 2-Photonen-Mikroskopie - vorerst an Mäusen - ein Pendant zum Lymphsystem zu entdecken , das von ihr als glymphatisches System bezeichnet wurde. Es ist dies ein unidirektionales, von Gliazellen (speziell von den Astrozyten) gebildetes und gesteuertes Netzwerk von Kanälen, welche die Blutgefäße umschließen und das Einströmen von Gehirnflüssigkeit (Cerebrospinale Flüssigkeit - CSF-, Liquor) ins Gehirngewebe und Ausströmen samt den gelösten (Problem-)Stoffen regulieren. Diese perivaskulären Kanäle entstehen dabei aus den aneinandergelagerten, dicht mit wasserleitenden Poren (AQP4) besetzten Endfüßchen der Astrozyten. Wie man sich die Funktion dieses glymphatischen Systems vorstellen kann, ist in einem vereinfachten Schema in Abbildung 1. dargestellt.
|
Abbildung 1: Flüssigkeitsfluss im glymphatischen System. Vereinfachtes Schema. Die Gehirnflüssigkeit (CFS) fließt aus dem Subarachnoidalraum in die periarteriellen Kanäle (blaue Pfeile). Beim Eintritt in das Hirnparenchym vermischt sich die CSF mit der interstitiellen Flüssigkeit (ISF). Aquaporin-4 (AQP4) reguliert den Flüssigkeitsfluss und erleichtert den Transport von Stoffwechselabfallprodukten entlang der perivenösen Kanäle. Die ISF-CSF-Mischung entfernt so Stoffwechselabfallprodukte effektiv aus dem Gehirn. (Bilder oben: Detail aus: Arvid Leyh: Infografik: Das glymphatische System. https://www.dasgehirn.info/grundlagen/das-glymphatische-system/infografik-das-glymphatische-system. Lizenz: cc-by-nc-sa. Bild unten: modifiziert aus: S.Cheng et al., Glymphatic system: a self-purification circulation in brain. Front Cell Neurosci. 2025 Feb 12;19:1528995. doi: 10.3389/fncel.2025.1528995 . Lizenz cc-by.) |
Die kontinuierlich aus dem Blutplasma in den Ventrikeln des Gehirns gefilterte Gehirnflüssigkeit (500 - 700 ml /Tag), enthält Nährstoffe, Ionen, Vitamine und Hormone und nur wenig Protein. Sie füllt den Raum rund um das Gehirn (und das Rückenmark) - den zwischen 2. und 3. Hirnhaut liegenden Subarachnoidalraum (Abbildung 1 oben, links) - und gelangt von dort in die periarteriellen Kanäle, die sie von den pulsierenden Bewegungen der Arterien angetrieben durchströmt. Unterstützt durch die APQ4-Wasserporen strömt die CSF in und durch das Gehirngewebe (Gehirnparenchym), transportiert Nährstoffe zu den Zellen und vermischt sich mit der Flüssigkeit im extrazellulären Raum (der interstitiellen Flüssigkeit, ISF), die neben darin gelösten Stoffen potentiell neurotoxische Stoffwechselprodukte und auch Proteinabfälle (Abbildung 1, unten) enthält. Im konvektiven Massenfluss der CSF-ISF-Mischung verlassen diese Stoffe das Gehirngewebe über die perivenösen Kanäle und werden über klassische Lymphgefäße in den Gehirnhäuten aus dem Zentralnervensystem in den Blutkreislauf ausgeschleust.
Ein ganz wesentlicher Vorteil dieses konvektiven Stofftransports
im Vergleich zur einfachen Diffusion ist, dass alle im ISF gelösten Stoffe unabhängig von ihrer Molekülgröße mit derselben Fließgeschwindigkeit mitgeführt werden. Das Team um Maiken Nedergaard schreibt 2012: "Um 1 cm weit im Hirn zu diffundieren würde Harnstoff (Molekülgröße 60 Dalton) 5,4 Stunden benötigen, Albumin (Molekülgröße 66 500 Dalton) dagegen 109 Stunden. .. je größer das Gehirn, desto stärker hängt die effiziente Clearance von interstitiell gelösten Stoffen vom Massenfluss ab, insbesondere bei größeren Molekülen wie Peptiden und Proteinen, die nicht effektiv durch Diffusion entfernt werden können. Im menschlichen Gehirn könnten daher perivaskuläre Wege und der AQP4-abhängige Massenfluss wesentlich kritischer für die Gehirnfunktion sein als im Gehirn von Nagetieren." (Iliff et al., 2012). In derselben Arbeit wird auch gezeigt, dass lösliches beta-Amyloid, aus dem die für die Alzheimer-Erkrankung charakteristischen Plaques entstehen können, auf dem perivaskulären Weg aus dem Gehirngewebe transportiert wird.
Das glymphatische System ist im Schlaf aktiv
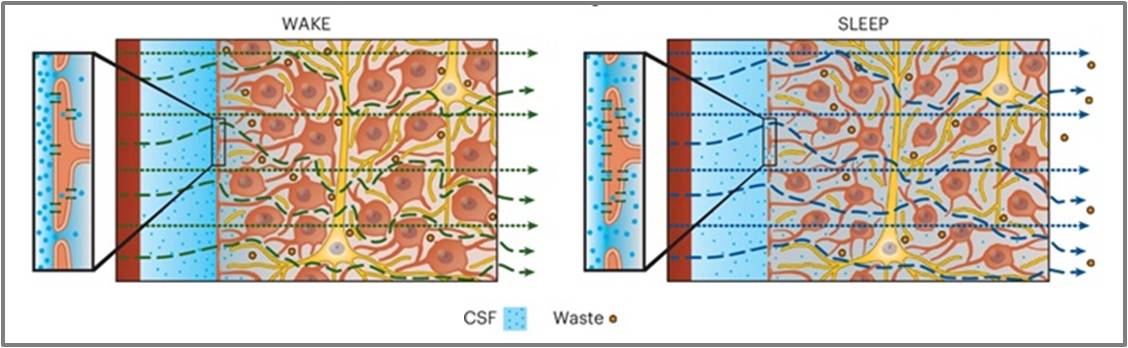
An der lebenden Maus in Echtzeit stellte das Team um Nedergaard 2013 fest, dass der gesamte CSF-ISF-Flüssigkeitsstrom durch das Gehirn praktisch nur im schlafenden Gehirn stattfindet. Bereits der Einstrom der mit einem kleinen fluoreszierenden Molekül markierten Hirnflüssigkeit war im wachen Tier gegenüber dem schlafenden Tier um 95 % reduziert. Ganz wesentlich war auch die unterschiedliche Struktur des Interstitialraums: Während dieser in den Wachphasen eng und gewunden war und einen hohen Widerstand für den glymphatischen Fluss bildete, schrumpften die Zellen im Schlaf, die interstitielle Flüssigkeit im extrazellulären Raum nahm um 60 % zu und die Wege für den CSF-ISF Strom waren erweitert. Abbildung 2. Dies führte zu einem deutlichen Anstieg des konvektiven Austauschs von CSF und ISF und der Geschwindigkeit der beta-Amyloid Clearance im ISF-Strom. (Xie et al., 2013). Die Schlussfolgerung der Autoren: "Somit könnte die regenerative Funktion des Schlafes eine Folge der verstärkten Beseitigung von potenziell neurotoxischen Abfallprodukten sein, die sich im wachen Zentralnervensystem ansammeln." (Xie et al., 2013)
Die glymphatische Funktion wurde in der Maus unter verschiedenen physiologischen Bedingungen gemessen. Es zeigte sich, dass der glymphatische CSF-ISF Austausch im Elektroenzephalogramm (EEG) mit Delta-Wellen und einer reduzierten Herzfrequenz - also der Tiefschlafphase - verbunden ist - die Abfallbeseitigung erfolgt also im Tiefschlaf.
|
Abbildung 2: Der extrazelluläre (interstitielle) Raum wird dynamisch reguliert. Vereinfachtes Schema.Im Wachzustand (links) ist der Einstrom von CSF aus dem periarteriellen Raum in das Gehirngewebe verringert - im Ausschnitt angezeigt durch weniger Wasserporen (AQP4) in den Endfüßchen der Astrozyten -; der Zellzwischenraum ist schmal und gewunden und unterdrückt den glymphatischen Fluss. Im Schlafzustand (rechts) ist der Einstrom von CSF stark erhöht - mehr Wasserporen in den Endfüßchen der Astrozyten-, die Zellen sind geschrumpft, der Zellzwischenraum um 60 % größer und der konvektive glymphatische Fluss kann effizient Abfall ausschleusen. Rote Zellen: Astrozyten, gelbe Zellen: Neuronen. (Bild: Figure 1 c,d unveränderter Ausschnitt aus Dagum et al., 2025. https://doi.org/10.1038/s41551-025-01394-9 Lizenz: cc-by-nc-nd) |
War es im Tierversuch möglich die glymphatische Clearance des Stoffwechselabfalls während des Schlafs kontinuierlich zu verfolgen, so konnte dies im menschlichen Gehirn aufgrund der invasiven, zeitlich schlecht aufgelösten Technologien bisher nicht in adäquater Weise durchgeführt werden. Derartige Messungen - hauptsächlich mittels Magnetresonanztomographie (MRT) und geringer zeitlicher Auflösung - werden nur in wenigen Neuroimaging-Zentren durchgeführt; sie weisen aber darauf hin, dass auch bei menschlichen Probanden die glymphatische Funktion während des Schlafs gesteigert ist und Schlafentzug zur Ansammlung von Abfallprodukten in Hirnregionen führt.
Schlechter Schlaf steht im Zusammenhang mit kognitiven Beeinträchtigungen, chronischer Schlafmangel ist ein bedeutender Risikofaktor für die Entstehung neurodegenerativer Erkrankungen wie Alzheimer- und Parkinson-Erkrankungen. Um effiziente Strategien zur Bekämpfung dieser global stark zunehmenden Erkrankungen zu entwickeln, ist ein besseres Verstehen der biologischen Vorgänge nötig, die Abfallbeseitigung im Gehirn, Schlaf und Demenz verknüpfen. Ein erstes nicht-invasives, tragbares Gerät zur Verfolgung des Abfallbeseitigungssystems des menschlichen Gehirns in Echtzeit kann nun einen Durchbruch im Auffinden neuer Ansatzpunkte und neuer Medikamente, die diese beeinflussen, liefern (P. Dagum et al., 2025; J. Iliff et al., 2024).
Applied Cognition stellt erste kontinuierliche, nicht-invasive Messung der menschlichen Glymphatikfunktion vor
Applied Cognition (Redwood City, Kalifornien), ein Unternehmen für therapeutische Plattformen im klinischen Stadium, https://appliedcognition.com/ hat ein nicht-invasives multimodales Gerät zur kontinuierlichen Messung von schlafaktivierten Veränderungen des menschlichen Gehhirngewebes entwickelt und seine Funktion in zwei separaten klinischen Studien vorgestellt und validiert (P. Dagum et al., 2025).
|
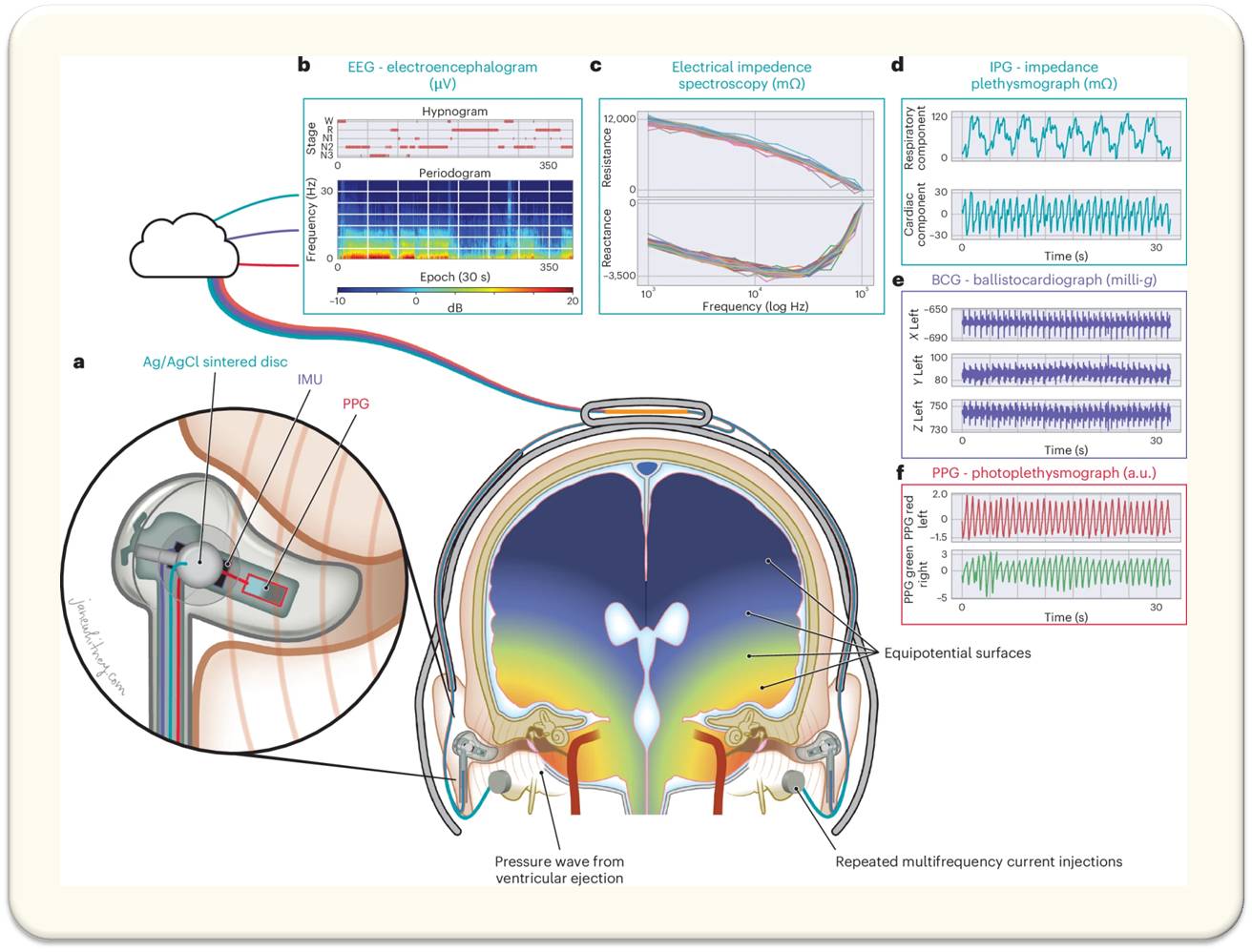
Abbildung 3: Schema des Geräts zur kontinuierlichen nicht-invasiven Messung der glymphatischen Funktion des menschlichen Gehirn und seiner Output-Signale. (Bild aus P. Dagum et al., 2025, https://doi.org/10.1038/s41551-025-01394-9 Lizenz: cc-by-nc-nd). |
Frühere Studien an Nagetieren und Menschen hatten gezeigt, dass die glymphatische Funktion von drei wichtigen neurophysiologischen Parametern abhängt:
- vom EEG (Elektroenkephalographie)- Schlaf-Zustand,
- von der zerebralen Gefäßfunktion und
- von der Regulierung des Widerstands im Gehirngewebe durch Astrozyten.
Diese Schlüsselfaktoren für den glymphatischen CSF-ISF Austausch werden mit dem neuartigen Untersuchungsgerät vom Schlaf bis zum Wachzustand kontinuierlich gemessen.
Es handelt sich dabei um eine Haube mit eingebauten Elektroden, die Mithilfe modernster Mikrotechnologie, Biophysik und Signalanalyse kontinuierlich den Widerstand des glymphatischen Flusses während des Schlafs mittels Impedanzspektroskopie (IPG) misst. Gleichzeitig werden die elektrische Aktivität mittels Elektroenzephalographie (EEG), die Änderung von Herzfrequenz, Herzleistung und Blutvolumen mittels Photoplethysmographie (PPG) und Ballistocardiographie (BCG) gemessen. Abbildung 3.
In Zusammenarbeit mit Forschern von der University of Florida und der University of Washington wurde das Gerät in 2 klinischen Studien (Benchmarkstudíe und Replikationsstudie) an insgesamt 48 gesunden Personen mittleren Alters geprüft. Dazu verbrachten die Studienteilnehmer im Abstand von 2 - 4 Wochen jeweils eine Nacht, in der sie normal schliefen und eine Nacht mit Schlafentzug. Kontinuierliche Messungen mittels elektrischer Impedanzspektroskopie konnten die Veränderungen des extrazellulären Volumens (ISF) im Schlaf erfolgreich abbilden und damit die präklinischen Ergebnisse an Versuchstieren replizieren.
|
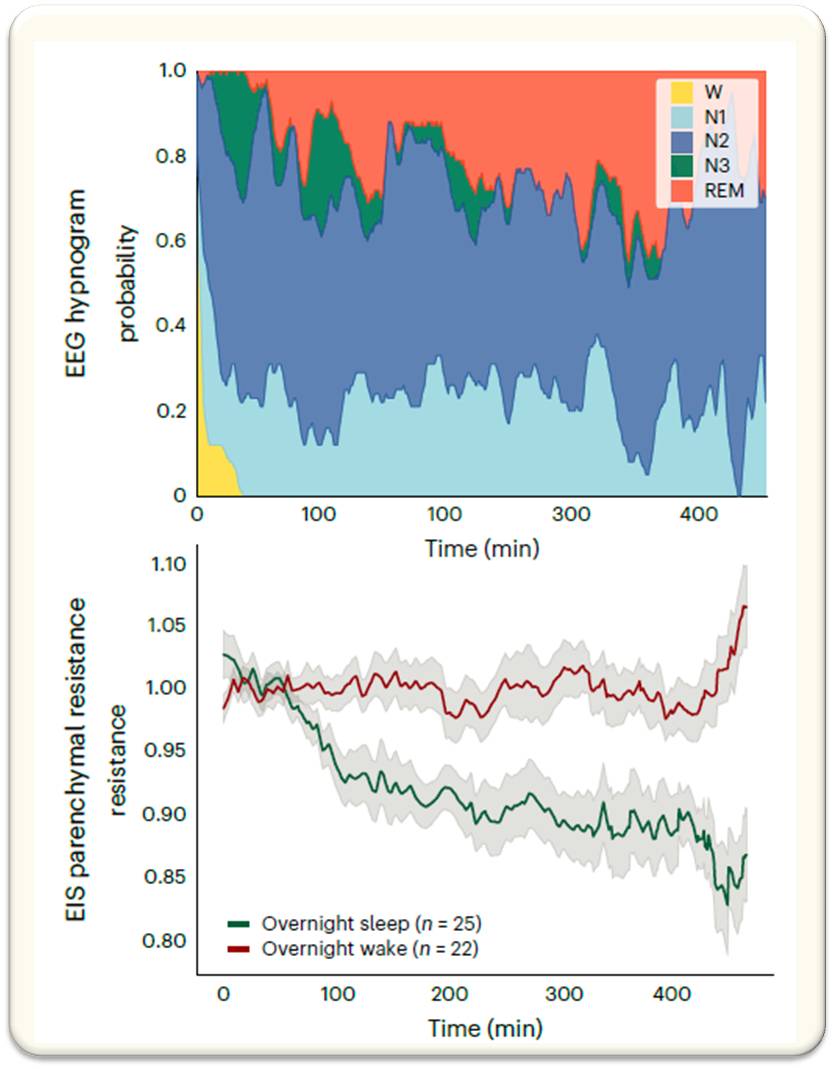
Abbildung 4: Der Widerstand des Hirnparenchyms ist während der Schlafphasen verringert. Ergebnisse der sogenannten Benchmarking Studie. Oben: Gemittelte EEG-Hypnogramme der Schlafphasen (Non-REM: N1, N2, N3; REM). Unten: Widerstand des Hirngewebes während der Wachphase (rot) und während der Schlafphase (grün). (Bild: Fig. 4a, aus P. Dagum et al., 2025, Lizenz: cc-by-nc-nd) |
Während der mittlere Widerstand des Gehirngewebes während der Wachphase weitgehend konstant hoch blieb, sank er während des Schlafs monoton ab und erreichte am Ende der Schlafphase einen Tiefpunkt der etwa 20 % unter dem Wert zu Beginn oder im Wachzustand lag. Abbildung 4.
Anschließend an die Schlafphase wurde die Aufnahme des Tracers Gadolinium-chelate in und seine Clearance aus dem Gehirngewebe mittels kontrastverstärktem MRI (CE-MRI) bestimmt und eine der Widerstandsminderung entsprechend höhere glymphatische Funktion festgestellt. Es zeigte sich damit, dass der Gewebswiderstand allein oder in Kombination mit EEG-Spektral- und Herzfrequenzdaten zuverlässig die mittels CE-MRT bestimmte glymphatische Funktion vorhersagen kann.
Das Gerät erweist sich also geeignet, um unter möglichst natürlichen Bedingungen die Biologie des menschlichen glymphatischen Systems zu charakterisieren.
Tierversuche hatten gezeigt, dass eine experimentelle Beeinträchtigung der glymphatischen Funktion ausreicht, um die Entwicklung der für die Alzheimer-Krankheit charakteristischen beta- Amyloid- und Tau-Pathologie zu fördern. Genetische und histologische Assoziationsstudien an Menschen mit neurodegenerativen Erkrankungen stützen den Zusammenhang zwischen einer Fehlfunktion des glymphatischen Systems und der Entwicklung solcher Erkrankungen.
Einen vielversprechenden neuen Ansatz zur Behandlung neurodegenerativer Erkrankungen, sieht das Unternehmen Applied Cognition in einer Verbesserung der glymphatischen Funktion. Mit Hilfe ihrer Untersuchungsmethoden wurden bereits Targets (Zielstrukturen) für die Modulation des glymphatischen Systems identifiziert und Substanzen gefunden, die diese Targets modulieren. Zwei der Substanzen stehen schon vor dem klinischen Proof-of-Concept in den Indikationen Alzheimer-Erkrankung und posttraumatische Kopfschmerzen (https://appliedcognition.com/pipeline).
Ausblick
Das von Applied Cognition entwickelte Gerät eröffnet erstmals die Möglichkeit die glymphatische Funktion am Menschen nicht-invasiv unter "natürlichen" Bedingungen in Echtzeit zu untersuchen. Eine Fülle von Fragestellungen können nun behandelt werden: Von zeitaufgelösten mechanistischen Studien zur Biologie der Abfallbeseitigung aber auch der Versorgung mit Nährstoffen, Hormonen und Neurotransmittern über eine kausale Rolle der Fehlfunktion des glymphatischen System in der Entwicklung neurodegenerativer Erkrankungen und eine frühzeitige Identifizierung von Personen mit beeinträchtigter Funktion bis hin zur Prüfung von therapeutischen Strategien gegen die stark im Zunehmen begriffenen neurodegenerativen Erkrankungen.
Paul Dagum et al. A wireless device for continuous measurement of brain parenchymal resistance tracks glymphatic function in humans. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01394-9
Jefferey Iliff et al., The glymphatic system clears amyloid beta and tau from brain to plasma in humans. medRxiv preprint. August 1, 2024 .(Not certified by peer review). doi: https://doi.org/10.1101/2024.07.30.24311248 (Artikel noch nicht peer reviewed)
Jeffrey Iliff et al.,: A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid β. Sci Transl Med. 2012 August 15; 4(147): 147ra111. doi:10.1126/scitranslmed.3003748.
Lulu Xie et al.,: Sleep Drives Metabolite Clearance from the Adult Brain. Science. 2013 October 18; 342(6156): . doi:10.1126/science.1241224
Das glymphatische Sytem im ScienceBlog
- Christian Wolf, 14.11.2024: Wie das Gehirn von Abfallstoffen gereinigt wird.
- Inge Schuster, 12.02.2024: Zur Drainage des Gehirngewebes über ein Netzwerk von Lymphgefäßen im Nasen-Rachenraum.
- Redaktion, 10.10.2017: Ein neues Kapitel in der Hirnforschung: das menschliche Gehirn kann Abfallprodukte über ein Lymphsystem entsorgen.
- Francis S. Collins, 14.02.2019: Schlaflosigkeit fördert die Ausbreitung von toxischem Alzheimer-Protein.
- Printer-friendly version
- Log in to post comments