Do, 13.01.2022 — Roland Wengenmayr
 Nanokapseln im medizinischen Bereich sollen Arzneistoffe sicher einschließen und diese an einen bestimmten Ort im Körper bringen. Welche Herausforderungen gibt es beim Bau bioverträglicher Kapseln, und wie gelangen sie genau zu den Stellen, an denen sie wirken sollen? Wie solche winzige Transporter hergestellt werden und welche Rolle Polymere dabei spielen, beschreibt der Physiker und Wissenschaftsjournalist DI Roland Wengenmayr*.
Nanokapseln im medizinischen Bereich sollen Arzneistoffe sicher einschließen und diese an einen bestimmten Ort im Körper bringen. Welche Herausforderungen gibt es beim Bau bioverträglicher Kapseln, und wie gelangen sie genau zu den Stellen, an denen sie wirken sollen? Wie solche winzige Transporter hergestellt werden und welche Rolle Polymere dabei spielen, beschreibt der Physiker und Wissenschaftsjournalist DI Roland Wengenmayr*.
Ohne die Eigenschaften der Nanowelt ist chemische Forschung heute kaum noch denkbar. Das gilt besonders für die Nanokapseln von Katharina Landfester, Direktorin am Max-Planck-Institut für Polymerforschung in Mainz. Diese Objekte sind mit einigen Hundert Nanometern Durchmesser zwar winzig. Sie sind aber immer noch viel größer als typische Moleküle. Deshalb können an ihren Oberflächen chemische Reaktionen ablaufen, zum Beispiel eine Polymerisation. Sind nun viele Nanoobjekte im Spiel, bieten sie dafür eine gigantisch große Oberfläche an. Genau diese Stärke der Nanowelt nutzt die Mainzer Forscherin in ihren Miniemulsionen aus fein verteilten Nanotröpfchen.
|
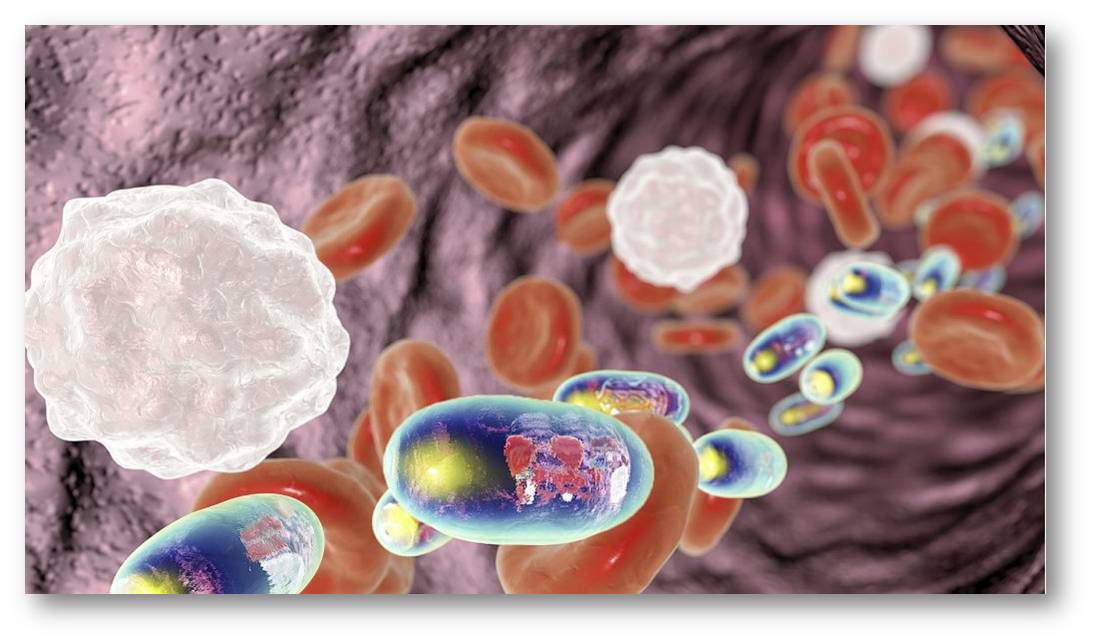
Abbildung 1: Schematische Darstellung von Nanokapseln als Träger von Wirkstoffen im Blut. Nanokapseln (Durchmesser etwa 100 Nanometer) sind wesentlich kleiner als Erythrozyten (rot, Durchmesser rund 7,5 Mikrometer (µm), Dicke 2 µm) und Lymphozyten (weiß, Durchmesser : 10 - 15 µm ). © Dr_Microbe/istock |
Wer in die Forschungsprojekte von Katharina Landfester eintaucht, erkennt, wie faszinierend und vielfältig Chemie sein kann. Grundlagenforschung und Anwendung gehen dabei Hand in Hand. Über 50 Patente hält die Chemieprofessorin inzwischen, und in allen spielen Nanokapseln eine tragende Rolle. Die Anwendungen reichen von eingekapselten Farbpigmenten, die dadurch nicht mehr zusammenklumpen, über Parfüm-Mikrokapseln für Waschmittel oder verkapselten Korrosionsschutz für Metalle, der nur bei Beschädigung freigesetzt wird, bis hin zur Zukunftsvision einer völlig neuen Art von Medizin. Zu ihren Partnern zählen große Konzerne – und ein durch die Corona-Pandemie berühmt gewordenes Mainzer Start-up-Unternehmen: BioNTech. „Viele junge Chemikerinnen und Chemiker aus meiner Abteilung arbeiten inzwischen dort“, berichtet die Max-Planck-Direktorin über die spannenden beruflichen Perspektiven. Landfester forscht auf einem Gebiet, das ihr ganz besonders am Herzen liegt. Es geht um die Verwirklichung des Traums, Medikamente im Körper gezielt zu den Zellen zu bringen, wo sie wirken sollen. Dazu sollen die Mainzer Nanokapseln sozusagen als winzige „Transport-U-Boote“ im Blut dienen (Abbildung 2). Doch zuerst geht es im Gespräch mit der Max-Planck-Direktorin darum, wie der chemische Zauberkasten funktioniert, den sie seit ihrer Zeit als Nachwuchsforscherin so enorm kreativ weiterentwickelt hat.
|
Abbildung 2: Winzige Behälter. Mainzer Nanokapseln aus Hydroxyethylstärke, die eines Tages zum Beispiel ein Medikament im Körper genau ans Ziel bringen könnten. Die Aufnahme wurde mit einem Raster-Elektronenmikroskop gemacht.© MPI für Polymerforschung / CC BY-NC-ND 4.0 |
Grundlegende Mixtur
Die Basis sind sogenannte Miniemulsionen. Eine Emulsion ist beispielsweise ein fein verteilter Mix aus kleinen Öl- oder Fetttröpfchen in einer wässrigen Umgebung – oder umgekehrt. In Miniemulsionen sind diese Tröpfchen besonders klein, bei Landfester sogar Nanoobjekte. Die Nanowelt ist auf der Größenskala zwischen der Mikrowelt mit Objekten in Mikrometergröße und der Welt der Atome und der meisten Moleküle angesiedelt. Der Durchmesser von Atomen bemisst sich in Zehntel-Nanometern (siehe [1]). Emulsionen begegnen uns vielfach im Alltag, etwa in Lebensmitteln oder Kosmetika. Milch ist eine Mixtur aus feinen Fetttröpfchen in einer wässrigen Lösung, bei Butter oder Hautcreme ist es umgekehrt. Eigentlich sind Emulsionen etwas Unmögliches, aber Chemie und Physik machen sie doch möglich. Das erlebt man beim Anmachen einer Salatsoße. Der Essig als wässrige Phase und das Salatöl bleiben zunächst getrennt voneinander. Schnelles Durchquirlen sorgt zwar für feinere Öltröpfchen in der Soße, aber stabil wird die Vinaigrette erst durch Zugabe von etwas Senf.
Der Grund, warum wässrige und fettige Flüssigkeiten sich schlecht mischen, liegt in den Eigenschaften ihrer Moleküle. In einem Wassermolekül zieht das Sauerstoffatom die Elektronen der beiden Wasserstoffatome an. Damit bekommt das Molekül elektrisch negative und positive „Pole“. Als polares Lösungsmittel kann Wasser daher Stoffe, deren Moleküle ebenfalls elektrisch geladene Abschnitte haben, gut lösen. Beim Anlagern der Wassermoleküle entstehen Wasserstoffbrückenbindungen, die in Landfesters Forschung eine wichtige Rolle spielen: Die Wassermoleküle docken sozusagen mit ihren positiv geladenen Wasserstoffatomen an den negativ geladenen Teil eines anderen Moleküls an.
Stoffe mit solchen „hydrophilen“, also wasserliebenden Eigenschaften sind wasserlöslich. Unpolaren Lösungsmitteln wie Fetten und Ölen hingegen fehlen diese von elektrischen Ladungen dominierten Eigenschaften. Ihre Moleküle wechselwirken untereinander durch sogenannte Van-der-Waals-Kräfte. Daher können sich die Wassermoleküle nicht so gut an Fettmoleküle anlagern, was die geringe oder fehlende Löslichkeit von Fetten in Wasser erklärt. Sie sind daher hydrophob, also „wasserängstlich“. Es gibt aber „amphiphile“ Stoffe, deren Moleküle diese lipophilen, „fettliebenden“ Abschnitte und dazu noch hydrophile Teile besitzen. Als Kontaktvermittler können sie so auf der Grenzfläche zwischen den beiden Phasen dafür sorgen, dass zum Beispiel Fetttröpfchen sich sehr fein in Wasser verteilen, also emulgieren. Das geschieht beim Abwaschen von fettigem Geschirr, dank der Tensidmoleküle des Spülmittels. „Ein Beispiel für ein verbreitetes Tensid ist das Natriumdodecylsulfat in Waschmitteln“, erklärt die Chemikerin.
Das Besondere an Landfesters Miniemulsionen ist nun, dass extrem winzige Nanotröpfchen eine riesige Gesamtoberfläche formen. Auf diesem Spielfeld können chemische Reaktionen viel effizienter ablaufen als zwischen den unvermischten wässrigen und öligen Phasen. Sind diese getrennt übereinandergeschichtet, kommen sie nur auf der vergleichsweise kleinen Querschnittsfläche des Gefäßes in Kontakt. „In einer Miniemulsion gleichen Volumens entspricht dagegen die gesamte Grenzfläche zwischen beiden Phasen ungefähr einem Fußballfeld“, sagt Landfester.
|
Abbildung 3: Herstellung von Nanokapseln © R. Wengenmayr verändert nach MPI für Polymerforschung / CC BY-NC-SA 4.0 |
Wie die Herstellung von Miniemulsionen funktioniert, erklärt Landfester im Labor anhand der Geräte. „Der erste Schritt beginnt tatsächlich mit einem Turbomixer, also im Prinzip einem besseren Pürierstab“, sagt sie (Abbildung 3). Das ergibt eine Voremulsion, die dann in das eigentliche „Herzstück“ kommt. Das ist ein Hochdruck-Homogenisator, wie er im Prinzip auch zum Homogenisieren von Milch eingesetzt wird. In ihm wird die Voremulsion unter hohem Druck von bis zu 2000 bar durch einen schmalen Spalt gegen eine Art Prallwand geschossen, was die Tröpfchen bis in den Nanobereich zerkleinert. Zum Vergleich: Ein Druck von 1000 bar herrscht in einer Wassertiefe von 10 km, also ungefähr der tiefsten Stelle aller Ozeane im Marianengraben. Benötigt das Team nur kleinere Mengen, dann verwendet es alternativ ein Ultraschallgerät zur Zerkleinerung.
Spontane Kugelbildung
Aber wie setzt Landfesters Team die winzigen Tröpfchen als chemische Nanoreaktoren ein? Angefangen haben die Mainzer mit technischen Polymeren und den dazu nötigen Polymerisationsreaktionen. Grundsätzlich verketten diese Reaktionen immer gleiche chemische Grundbausteine, die Monomere, zu langen Polymeren. Mono bedeutet auch im Altgriechischen so viel wie „allein“, während Poly für „viel“ steht. „Das Polymer darf bei uns aber nur an der Kapselwand entstehen“, betont Landfester den entscheidenden Punkt. Ein Beispiel, wo das funktioniert, ist Nylon. „Nylon geht im Prinzip in der Miniemulsion, wenn auch nicht sehr gut, es ist zudem wissenschaftlich nicht so interessant für uns“, sagt Landfester.
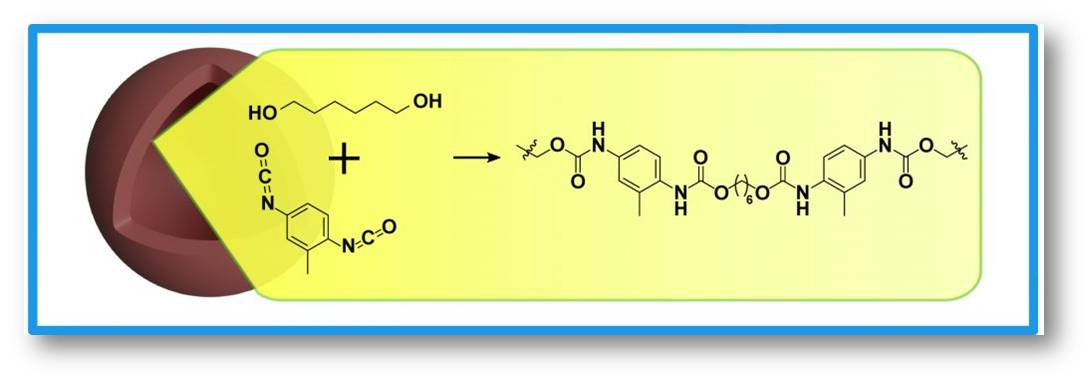
Besser funktioniert die Nanokapsel-Herstellung mit einer ähnlichen Reaktion, bei der Polyurethan entsteht (Abbildung 4). Beide Kunststoffe haben grundsätzlich gemeinsam, dass die Polymerisationsreaktion zwei verschiedene Monomer-Bausteine zu einer langen Polymerkette verknüpft. Polyurethan entsteht in einer Polyadditionsreaktion, die Polyamidfasern des Nylons hingegen in einer Polykondensationsreaktion. Bei einer Polykondensationsreaktion muss immer ein Nebenprodukt abgespalten werden, damit die funktionellen Gruppen beider Monomere verbunden werden können. Bei einer Polyadditionsreaktion ist das nicht nötig.
Entscheidend für Landfesters Strategie ist nun, dass eine Bausteinsorte besser in der öligen, die andere in der wässrigen Phase löslich ist. Folglich kommen sie nur an der Grenzfläche miteinander in Kontakt. Damit läuft auch nur dort die Polymerisationsreaktion ab. Da das entstehende Polymer amphiphil ist, verbleibt es zwischen der wässrigen und öligen Phase und baut die Kugel des eingeschlossenen Tropfens nach. So formt sich die Nanokapsel selbstorganisiert. Bei Polyurethan ist einer der beiden Monomerbausteine ein Diol. Das ist eine organische Verbindung, die zwei alkoholische Gruppen enthält und damit oft wasserlöslich ist. Das zweite Monomer ist ein Diisocyanat, das sich besser in der öligen Phase löst. Sobald beide Monomere an der Grenzfläche in Kontakt kommen, startet die Polyadditionsreaktion, denn das Diisocyanat ist hochreaktiv.
|
Abbildung 4: Polyurethan-Nanokapsel. Herstellung einer Nanokapsel aus Polyurethan durch eine Polyadditionsreaktion. Links unten ist das Diisocyanat, darüber das Diol, rechts vom Reaktionspfeil das fertige Polymer. © R. Wengenmayr verändert nach MPI für Polymerforschung / CC BY-NC-SA 4.0 |
Verträgliche Transporter
Allerdings eignen sich solche technischen Kunststoffe nicht für Nanokapseln, die medizinische Wirkstoffe ans Ziel bringen sollen. Der Einsatz im Körper erfordert biokompatible Alternativen für das Kapselmaterial. Und noch etwas sei wichtig, sagt Landfester: „Die meisten Wirkstoffe sind wasserlöslich.“ Das ist typisch für biologische Moleküle, ein Beispiel ist das mRNA-Molekül im Covid-Impfstoff von BioNTech. „Also müssen wir unsere Miniemulsion sozusagen umdrehen“, fährt die Chemikerin fort (Abbildung 3 rechts). Das Team musste Nanokapseln mit einem wässrigen Inhalt erzeugen, die während der Reaktion in einer öligen Flüssigkeit emulgiert sind – sozusagen High-Tech-Creme. Für das Material der Kapsel experimentierten die Mainzer mit verschiedenen biokompatiblen Stoffen, die sich polymerisieren lassen. Dazu müssen diese reaktive Gruppen besitzen, die sich für chemische Bindungen an weitere Moleküle eignen. So sind die Mainzer zu Kohlenhydraten und Proteinen gekommen. „Zucker haben OH-Gruppen, mit denen man solche Grenzflächenreaktionen machen kann“, erzählt Landfester, „und bei Proteinen sind es Amino.(NH2)-Gruppen an bestimmten Aminosäuren, die man zur Reaktion nutzen kann“.
Proteine sind besonders interessant für das Ziel, Medikamente im Körper genau dorthin zu bringen, wo sie wirken sollen. Das liegt daran, dass man Proteinoberflächen von Nanokapseln gewissermaßen mit chemischen Versandadressen versehen kann, die bestimmte Zellen erkennen können. Das können Immunzellen sein, die gegen ein Virus oder eine Krebsart aktiviert werden sollen – oder Tumorzellen. Targeting heißt dieser Traum der Medizin, nach dem englischen Wort „target“ für Ziel. Proteine sind als große Biomoleküle bereits Polymere. Die Grenzflächenreaktion, die aus ihnen Nanokapseln formen soll, muss daher etwas anderes tun als zu polymerisieren. Sie muss benachbarte Polymerstränge miteinander so vernetzen, dass diese eine stabile Kapsel bilden. Das Resultat einer Vernetzung von Proteinen begegnet uns im Alltag zum Beispiel in Form von Gelatine. Für die biokompatiblen Nanokapseln kommen verschiedene Vernetzungsreaktionen zum Zug. Ein besonders interessanter Ansatz sind sogenannte „Click-Reaktionen“. Ein herkömmliches Reagenz, das eine Vernetzung starten soll, funktioniert „unspezifisch“, also nicht zielgerichtet. Dadurch besteht die Gefahr, dass es auch mit den Wirkstoffen reagiert, die eingekapselt werden sollen. „Viele Wirkstoffe haben ebenfalls OH- oder NH2-Gruppen“, erklärt die Professorin: „Das heißt, wir würden sie ungewollt mit der Kapsel vernetzen.“ Das darf aber nicht passieren, und hier spielt die Click-Chemie ihren Vorteil aus: Sie funktioniert zielgerichtet und schnell.
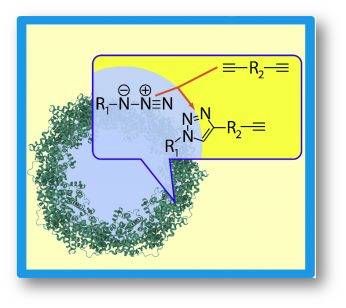
Es gibt verschiedene Vernetzungsreaktionen mit Hilfe der Click-Chemie. Eine ist die Alkin-Azid-Reaktion. Entscheidend ist hier die N3-Gruppe der Azide, mit der zuerst die zu vernetzenden Proteine „funktionalisiert“, sozusagen für die Vernetzung vorbereitet werden. Dabei werden die NH2-Gruppen des Proteins genutzt, um ein Molekül anzubinden, an dessen Ende sich eine N3-Gruppe befindet. Diese Azid-Gruppe reagiert dann mit einem Dialkin, das die Rolle eines „Vernetzermoleküls“ übernimmt. Die Dreifachbindung des Dialkins öffnet sich und sorgt dafür, dass sich mit den am Protein hängenden Azid-Gruppen Ringmoleküle ausbilden. Diese verknüpfen dann benachbarte Proteine zum Netzwerk (Abbildung 5).
|
Abbildung 5: Click-Chemie. Proteinmoleküle, die durch die Reaktion einer Azid-Gruppe mit einem Dialkin miteinander vernetzt wurden. Das Fenster zeigt, wie die Reaktion an der Kapselwand abläuft (rote Pfeile). R1: Proteinmolekül, R2: Dialkin, blau: wässriger Nanotropfen, gelb: umgebende ölige Phase, grün: Proteinmoleküle. © R. Wengenmayr verändert nach MPI für Polymerforschung / CC BY-NC-SA 4.0 |
Eine Click-Vernetzungsreaktion hat noch einen Vorteil: Es entstehen keine Nebenprodukte, die gesundheitsschädlich sein könnten. Außerdem muss die Vernetzung so ablaufen, dass sie die biologische Funktion der Kapselproteine selbst nicht verändert. Das ist wichtig für die smarte Funktion beim Targeting im Körper. Bei den Nanokapseln gibt es allerdings noch eine Herausforderung: Sie müssen so dicht sein, dass die Wirkstoffmoleküle sicher eingekapselt bleiben, solange sie nicht am Ziel sind. Nun ist so eine Kapsel mit einem Durchmesser von etwa hundert Nanometern wirklich winzig. Die Kapselwand ist folglich nur 15 bis 20 Nanometer dünn – eine Extremfolie sozusagen. „Jetzt versuchen Sie mal, das dicht zu machen“, sagt Landfester. Je dünner so ein Polymernetzwerk ist, desto durchlässiger wird es auch. Die Folge: Die Wirkstoffmoleküle drohen die Kapsel zu verlassen, bevor sie am Ziel sind. Zum Glück gibt es Möglichkeiten, diese superdünnen Kapselwände dichter zu bekommen. Als ersten Schritt kann man sie noch stärker vernetzen, also das Molekülgitter engmaschiger machen. „Das reicht aber häufig nicht aus“, sagt die Chemikerin. Abhilfe können nun zusätzliche Wasserstoffbrückenbindungen bringen. „Die ziehen das Netzwerk der Proteinstränge noch näher zusammen und machen es dichter“, betont Landfester. Vor allem ordnen die Stränge sich teilweise so sauber nebeneinander, dass sie ansatzweise Kristalle bilden. Diese Teilkristallinität macht zum Beispiel auch Kunststofffolien wasserdichter. „Wenn Plastiktüten knistern, dann hört man diese Teilkristallinität sogar“, erklärt die Max-Planck-Direktorin einen Effekt, den alle kennen.
Zielgenaue Lieferung
Eine Nanokapsel, die einen Wirkstoff sicher eingeschlossen transportieren kann, ist aber nur der erste Schritt. Der nächste ist das Targeting, also das erfolgreiche Adressieren an ein Ziel im Körper. Das erfordert Lösungen, bei denen Chemie auf Biologie und Medizin trifft. Deshalb arbeitet Landfesters Team seit 2013 in einem großen Sonderforschungsbereich mit diesen Disziplinen zusammen, auch die Physik ist dabei. Ein Ziel ist es, die Kapseln an ihrer Oberfläche mit Molekülen zu versehen, die nur von den zu bekämpfenden Erregern im Körper erkannt werden. Dazu muss die Kapsel allerdings chemisch so getarnt sein, dass sie nicht vorher schon im Blut von den falschen Adressaten wie den Fresszellen erkannt und aufgenommen wird. „Angesichts von 1600 Proteinen im Blut ist das eine echte Herausforderung“, sagt Landfester. Inzwischen hat das Team Lösungen für eine solche Tarnkappenfunktion gefunden. Eine wichtige Rolle spielen dabei sogenannte Apolipoproteine. Diese Moleküle führen dazu, dass die Nanokapseln von den Zellen nicht erkannt werden.
Beim Targeting, das Krebszellen bekämpfen soll, gibt es eine schlauere Alternative als die Tumorzellen direkt zu vergiften: Das Immunsystem selbst soll gegen die versteckten Tumorzellen fit gemacht werden. Dazu werden die Nanokapseln an der Oberfläche so präpariert, dass die T-Zellen des Immunsystems sie erkennen und zerstören. In der Kapsel befinden sich Moleküle, die das Immunsystem auf Merkmale der Tumorzellen trainieren. So lernen die T-Zellen, diese Feinde im Körper aufzuspüren und zu vernichten. Tatsächlich funktionieren diese „Nanotherapeutika“ schon bei erkrankten Mäusen im Labor. Katharina Landfester ist optimistisch, dass der Einsatz solcher Therapeutika auch bald beim Menschen möglich sein wird. Chemische Grundlagenforschung kann also auf unterschiedlichsten Gebieten Fortschritte bringen. Das ist das Faszinierende an ihr.
*Der Artikel ist unter dem Titel " Smarte Polymere – wie Nanokapseln Chemie und Medizin revolutionieren" in TECHMAX 29 der Max-Planck-Gesellschaft erschienen, https://www.max-wissen.de/max-hefte/techmax-29-polymere-nanokapseln/.. Der unter einer CC BY-NC-SA 4.0 Lizenz stehende Artikel ist hier ungekürzt wiedergegeben. Abbbildung1 wurde von der Redaktion mit einer Beschriftung versehen.
Weiterführende Links
Katharina Landfester: Physikalische Chemie der Polymere. Max-Planck-Institut für Polymerforschung. https://www.mpip-mainz.mpg.de/de/landfester
Volker Mailänder & Katharina Landstätter: Wirkstofftransporter für die Nanomedizin (2016). https://www.mpg.de/11344118/wirkstofftransporter-fuer-nanomedizin.pdf
Max-Planck.Institut für Polymerforschung: Kunststoff Bildungspfad: https://sites.mpip-mainz.mpg.de/kunststoffbildungspfad
Universität Mainz: Sonderforschungsbereich 1066 - Die vier Teile der Videoreihe zum SFB 1066 im Überblick (30.10.2020):
- SFB 1066: Nanomedizin – Kleine Partikel, große Wirkung
- https://www.youtube.com/watch?v=H3MOQOrT-NU
- Wie Nanomedizin das Immunsystem im Kampf gegen Krebs unterstützen kann. https://www.youtube.com/watch?v=IQq2Y-MmvFE&list=PL0F68B2B14956A8A8&t=0s
- Teil 3: Nanopartikel – Der Weg vom Baustein zum Wirkstofftransportsystem. https://www.youtube.com/watch?v=MF-VYlhVWO4&list=PL0F68B2B14956A8A8&index=11
- • Teil 4: Bildgebung in der Nanomedizin und ihr Beitrag zur Entwicklung moderner Therapeutika https://www.youtube.com/watch?v=kSoSsibkkdw&list=PL0F68B2B14956A8A8&index=12
- Printer-friendly version
- Log in to post comments