Fr, 9.08.2012 - 05:20 — Kurt Redlich & Josef Smolen
Entzündungsprozesse bewirken eine Aktivierung der knochenabbauenden Osteoklasten bei gleichzeitiger Blockierung der knochenaufbauenden Osteoblasten und sind damit wichtige, aber meistens ignorierte Ursachen für die Entstehung von Knochenschwund. Strategien zur Therapie des Knochenschwunds setzen bei der ursächlichen Bekämpfung des Entzündungsprozesses an, aber auch bei der Manipulation der für den Knochenumbau verantwortlichen Zellen.
Die systemische Osteoporose kann als Begleiterkrankung verschiedener, chronisch-entzündlicher Erkrankungen auftreten. Ist bei diesen Erkrankungen die zugrunde liegende Ursache bekannt und kann beseitigt werden, so erweist sich dies auch als effiziente Therapie der assoziierten Osteoporose. Dafür können einige Beispiele angeführt werden:
- Die Zöliakie ist eine chronisch-entzündliche Erkrankung der Schleimhaut des Dünndarms bedingt durch eine Überempfindlichkeit gegen Gluten-Bestandteile. Wird eine Gluten-freie Diät eingehalten, so kommt es auch zu einer raschen Besserung der Knochendichte.
- Bei Patienten mit Parodontitis (ausgelöst durch Infektionen des Zahnfleisches) sind antibakteriell wirksame Tetrazykline auch erfolgreich in der Behandlung des systemischen und lokalen Knochenschwunds (allerdings dürften hier nicht nur antimikrobielle Aktivitäten dieser Medikamente zur Wirkung kommen).
- Bei der Mukoviszidose, einer genetisch bedingten Stoffwechselerkrankung mit einer gesteigerten Bildung von klebrigem, zähflüssigen Schleimsekret (insbesondere in den Atemwegen und im Verdauungstrakt), kommt es zu wiederholten Infektionen, die für den systemischen Knochenschwund verantwortlich sein dürften: eine strenge antiinfektiöse Therapie führt auch hier zu einer Verbesserung der Knochendichte.
Allerdings sind die Ursachen der meisten chronisch-entzündlichen Erkrankungen (noch) unbekannt. Daher sind hier therapeutische Strategien anzuwenden, die in spezifischer Weise den Entzündungsprozeß und essentielle Schritte in diesem Prozeß zum Ziel) haben.
Behandlung von Knochenschwund – Allgemeines
Wie bereits in unserem vorangegangenen Artikel beschrieben, sind entzündungsfördernde Botenstoffe (proinflammatorische Zytokine) nicht nur im finalen Verlauf der Entzündung wirksam, sie üben auch massive Effekte auf die Aktivitäten von Osteoblasten und Osteoklasten aus und führen damit zum systemischen Knochenschwund. Es ist daher ein wichtiges therapeutisches Ziel die Entzündung zu reduzieren, idealerweise diese zu eliminieren.
Basistherapeutika. In einer prototypischen entzündlichen Erkrankung, wie der rheumatoiden Arthritis, beginnt die Standardtherapie mit synthetischen krankheitsmodifizierenden Antirheumatika (sogenannten “disease-modifying antirheumatic drugs“: DMARDs), wie dem bewährten Methotrexat. Mit diesen Basistherapeutika geht eine Verbesserung der Knochendichte einher. Solange allerdings die Erkrankung noch aktiv ist, kann auch der Knochenabbau weiter fortschreiten.
Glukokortikoide. Das Entzündungsgeschehen wird häufig auch mit (synthetischen) Glukokortikoiden bekämpft, insbesondere in der chronisch obstruktiven Lungenerkrankung (COPD), der rheumatoiden Arthritis oder der chronisch-entzündlichen Darmerkrankung (IBD). Glukokortikoide sind Hormone, die eine Vielfalt unterschiedlicher Vorgänge im Stoffwechsel, im zentralen Nervensystem und im Immunsystem regulieren. Sie können den Entzündungsprozess zwar sehr effizient reduzieren, indem sie u.a. die Ausschüttung von entzündungsfördernden Zytokinen und Gewebshormonen blockieren, sie interferieren aber auch stark mit dem Knochenumbau und können damit zu Auslösern/Verstärkern der Osteoporose werden. Wenn Entzündungsprozesse mit Glukokortikoiden behandelt werden, müssen also geeignete Maßnahmen getroffen werden um den Knochenschwund zu verhindern. Eine ausreichende Zufuhr von Vitamin D und Calcium – aber auch Muskeltraining - sollte alle Behandlungen der Osteoporose begleiten.
Biologika. Bei zielgerichteten medikamentösen Therapien, wie sie für verschiedene chronisch-entzündliche Krankheiten zugelassen sind, spielen seit rund einem Jahrzehnt Biologika, d.h. mit Mitteln der Biotechnologie hergestellte Produkte, eine zunehmend wichtigere Rolle: alle für die Behandlung der rheumatoiden Arthritis zugelassenen Biologika (Antikörper, Rezeptorkonstrukte) blockieren den lokalen Knochenschwund, einige der Produkte verbessern auch den systemischen Knochenschwund.
Zielgerichtete Strategien zur Behandlung chronisch-entzündlicher Erkrankungen und Knochenschwund
Im folgenden werden wesentliche Ansatzpunkte für zielgerichtete Therapien kurz beschrieben. Eine Auflistung zielgerichteter Therapeutika, die gegenwärtig für verschiedene chronisch-entzündliche Erkrankungen und/oder Knochenschwund zugelassen sind, findet sich abschließend in Tabelle 1.
- Blockierung der Cytokine. Hier handelt es sich vorwiegend um die Blockierung der Entzündungsfaktoren Tumor Necrosis Factor Alpha (TNF-Alpha) und Interleukin (IL-1 und IL-6). Diese werden von unterschiedlicher Zelltypen gebildet, docken an der Oberfläche einer Vielzahl von Zelltypen an hochspezifische (Rezeptor-) Proteine an und lösen damit eine Kaskade von Entzündungsmediatoren und proteinabbauenden Enzymen aus, welche auf umgebende Gewebe zersetzend wirken. Die Blockierung erfolgt im wesentlichen durch spezifische gegen diese Cytokine gerichtete Antikörper, die damit die Verfügbarkeit der Cytokine reduzieren, oder durch Rezeptor-Konstrukte, welche die Bindung der Cytokine an deren eigentliche Zell-Rezeptoren und damit die Signalauslösung in der Zelle verhindern.
- Blockierung von B- und T-Lymphocyten (B- und T-Zellen). Aktivierte B- und T-Zellen können auf verschiedenen Wegen die Bildung von Osteoklasten aus Vorläuferzellen beeinflussen, insbesondere auch auf Grund ihrer Expression des Proteins RANKL, das eine Schlüsselrolle im Knochenabbau spielt (Beschreibung siehe unten). Aktivierte T-Zellen interagieren mit anderen Zellen des Immunsystems und produzieren eine Reihe von pro-inflammatorischen Cytokinen. Die Aktivierung von T-Zellen kann durch spezifische, gegen ein (ko-stimulatorisches) Rezeptorprotein an der Zelloberfläche gerichtete Moleküle unterbunden werden. Im Falle von B-Zellen führt ein (gegen das Oberflächen-Antigen CD20 gerichtete) Antikörper zur Zerstörung der Zellen.
- Blockierung der Osteoklasten-Bildung und Aktivität. Verschiedene Verbindungen können direkt die Aktivität von Osteoklasten inhibieren ohne, dass sie einen Effekt auf die Entzündung zeigen. Hier sind die klassischen Bisphosphonate zu nennen, die – gleichwertig mit den anorganischen Pyrophosphaten – eine hohe Affinität zum Calciumphosphat des Knochens aufweisen und eine sehr gute Wirksamkeit in der Behandlung der Osteoporose. Neuere Produkte vom Typ der Aminobisphosphonate werden erfolgreich in der Bekämpfung der postmenopausalen Osteoporose eingesetzt, einige zeigen auch gute Wirksamkeit in der Behandlung von Osteoporose, die als Begleiterscheinung entzündlicher Erkrankungen auftritt. Unerwünschte Nebenerscheinungen von Bisphosphonaten sind vor allem Irritationen der Speiseröhre bei oraler Verabreichung, Fieber und Muskelschmerzen bei intravenöser Applikation. Seltene, aber schwere Nebenwirkungen sind Beeinträchtigung der Nierenfunktion, Kiefernekrosen und atypische Knochenbrüche.
- Denosumab. Ebenfalls zur Behandlung der postmenopausalen Osteoporose geeignet ist Denosumab, ein Antikörper gegen das Cytokin RANKL (RANKL = receptor activator of the nuclear factor kappaB ligand). RANKL wird von verschiedenen Zelltypen, u.a. von Osteoblasten auf der Zell-Oberfläche exprimiert und liegt auch in einer löslichen Form vor. Wenn RANKL an seinen spezifischen Rezeptor RANK, der u.a. auf Osteoklasten exprimiert ist, bindet, wird der Reifungs- und Aktivierungsprozess der Osteoklasten angeschaltet. Der physiologische Gegenspieler von RANKL ist Osteoprotegerin (OPG), das ebenfalls von Osteoblasten ausgeschüttet wird, an RANKL bindet und so seine Assoziation an RANK und auf diese Weise den Prozess der Osteoklasten-Reifung und damit des Knochenabbaus hemmt. Aktivierte T-Zellen und B-Zellen, aber auch Tumorzellen sezernieren RANKL und erhöhen damit das Verhältnis von RANKL zu Osteoprotegerin und leiten so den Weg zum Knochenabbau ein. Ein Schema des RANKL-RANK-OPG- Systems ist in Abbildung 1 gegeben.
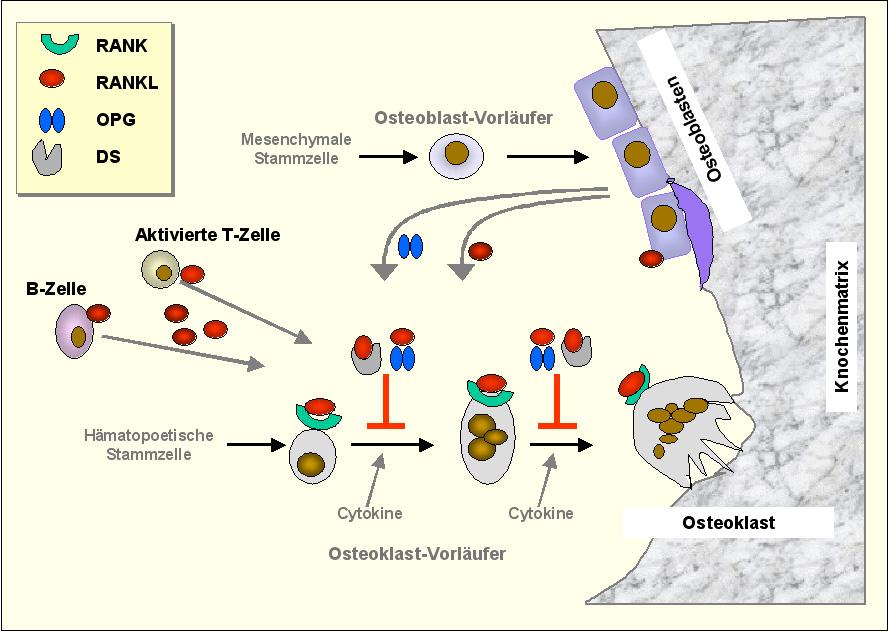 Abbildung 1. Der RANK-Weg führt zur Reifung und Aktivierung von Osteoklasten. RANKL, das u.a. von Osteoblasten exprimiert wird, bindet an seinen Rezeptor RANK an der Oberfläche von Osteoklastenvorstufen und löst damit deren Reifungs- und Aktivierungsprozess aus. Osteoprotegerin (OPG), das ebenfalls von Osteoblasten produziert wird, ist der physiologische Gegenspieler: es bindet an RANKL und blockiert so seine Wechselwirkung mit RANK. Ein Ungleichgewicht von RANKL zu Osteoprotegerin – wenn RANKL auch von aktivierten T-Zellen und B-Zellen und/oder von Tumorzellen produziert wird – führt zum Knochenabbau. In analoger Weise bindet der Antikörper Denosumab (DS) überschüssiges RANKL und verhindert damit Reifung und Aktivierung von Osteoklasten.
Abbildung 1. Der RANK-Weg führt zur Reifung und Aktivierung von Osteoklasten. RANKL, das u.a. von Osteoblasten exprimiert wird, bindet an seinen Rezeptor RANK an der Oberfläche von Osteoklastenvorstufen und löst damit deren Reifungs- und Aktivierungsprozess aus. Osteoprotegerin (OPG), das ebenfalls von Osteoblasten produziert wird, ist der physiologische Gegenspieler: es bindet an RANKL und blockiert so seine Wechselwirkung mit RANK. Ein Ungleichgewicht von RANKL zu Osteoprotegerin – wenn RANKL auch von aktivierten T-Zellen und B-Zellen und/oder von Tumorzellen produziert wird – führt zum Knochenabbau. In analoger Weise bindet der Antikörper Denosumab (DS) überschüssiges RANKL und verhindert damit Reifung und Aktivierung von Osteoklasten.
- Steigerung der Osteoblasten Aktivität. Strategien zur Aktivierung von Osteoblasten waren bei der postmenopausalen Osteoporose schon erfolgreich. Bei entzündlichem Knochenschwund sind sie noch nicht vollständig etabliert oder befinden sich im Entwicklungsstadium. Die intermittierende Anwendung von Parathormon – einem Hormon der Nebenschilddrüse, das unter anderem den Calciumspiegel im Blut kontrolliert –, ist ein wesentlicher Stimulator der Osteoblasten. In Arthritismodellen führte Parathormon zur Umkehr des systemischen Knochenabbaus, sogar tiefe lokale Erosionen wurden aufgefüllt. Ein derartiger Effekt wird üblicherweise mit keiner anderen Behandlung der rheumatoiden Arthritis gesehen: lokaler Knochenschwund kann dort zwar gestoppt aber nicht in Neubildung umgekehrt werden.
Tabelle 1. Aktuelle Medikamente, die den Entzündungsprozess und/oder den entzündlichen Knochenschwund zum Ziel haben
| Medikament | Molekül | Target Wirkung |
Zulassung für |
| Bisphosphonate | Klein, synthetisch. | Osteoklasten | Osteoporose |
| Denosumab | Humaner mAb | RANKL | |
| Adalimumab (Humira) | Humaner mAb | TNF anti- entzündlich |
Rheumatoide Arthritis, |
| Certolizumab (Cimzia) | Humanisierter mAb | ||
| Etanercept (Enbrel) | Rezeptor Konstruct | ||
| Golimumab (Simponi) | Humaner mAb*) | ||
| Infliximab (Remicade) | Chimärer mAb | ||
| Abatacept (Orencia) | Rezeptorkonstrukt | T-Zell Aktivierung anti-entzündlich |
Rheumatoide Arthritis |
| Rituximab (Rituxan) | Chimärer mAb | B-Zellen anti-entzündlich |
Rheumatoide Arthritis, B Zell Lymphom, (Multiple Sklerose) |
| Tocilizumab (Actemra) | Humanisierter mAb | IL-6 Rezeptor anti-entzündlich |
Rheumatoide Arthritis, Juvenile idiopathische Arthritis, Castleman Krankheit |
| Belimumab (Benlysta) | Humaner mAb | B-Zellen Inhibierung | Systemischer Lupus erythematodes (SLE) |
*) mAb: monoklonaler Antikörper (ist gegen ein einziges spezifisches Epitop eines Antigens gerichtet). Definitionen für chimäre, humanisierte und humane mAb’s finden Sie in diesem PDF. Hersteller und Details zu den einzelnen Medikamenten finden sich im Internet.
Ausblick
Knochenschwund, der als Begleiterscheinung chronisch-entzündlicher Erkrankungen auftritt, ist ein enormes medizinisches und auch sozio-ökonomisches Problem, dem häufig nicht genügend Beachtung geschenkt wird. Moderne Behandlungsstrategien haben die ehemals unabwendbare Entwicklung von Bewegungseinschränkung zur Invalidität dramatisch verändert und ermöglichen nun für viele Patienten eine gute Lebensqualität. Die fortschreitende Entwicklung, vor allem von innovativen, hochspezifischen Biologika, die regulierend in den Prozess des Knochenumbaus eingreifen, bieten Patienten nicht nur Chancen auf längerdauernde, klinische Remissionen sondern vielleicht auch auf Heilung von Gelenksdestruktion und Knochenabbau.
Anmerkungen der Redaktion
Dieser aufgrund des Themas naturgemäß etwas schwierigere Text ist der 2. Teil einer Artikelreihe ist, die am 19. Juli begann: Chronische Entzündungen sind Auslöser von Knochenschwund> Viele der hier verwendeten und zum Verständnis nötigen Begriffe werden dort einführend erklärt!
Weiterführende Links
Werden Rheuma-Gelenke bald Medizingeschichte? (aerztezeitung.de)
Vitamin D – Allheilmittel oder Hype? (ScienceBlog Beitrag v. 10.5.2012)
- Printer-friendly version
- Log in to post comments


