Do, 24.05.2018 - 12:32 — Norbert Bischofberger 
![]() Wir erleben in der Medizin einen Paradigmenwechsel. Rasante Fortschritte im Management von "Big Data" und in diversen analytischen Verfahren werden zu einer neuen Daten-gesteuerten Medizin führen, die ein verbessertes Verstehen von Krankheitsursachen ermöglicht und Therapien entsprechend dem individuellen genetischen und epigenetischen Status eines Patienten. Der Chemiker Norbert Bischofberger bis April 2018 Forschungsleiter von Gilead (2017: Nummer 6 unter den Top 10 Pharmakonzernen) und dzt. Präsident des Startups Kronos Bio- zeigt den Weg zu einer Medizin von Morgen.*
Wir erleben in der Medizin einen Paradigmenwechsel. Rasante Fortschritte im Management von "Big Data" und in diversen analytischen Verfahren werden zu einer neuen Daten-gesteuerten Medizin führen, die ein verbessertes Verstehen von Krankheitsursachen ermöglicht und Therapien entsprechend dem individuellen genetischen und epigenetischen Status eines Patienten. Der Chemiker Norbert Bischofberger bis April 2018 Forschungsleiter von Gilead (2017: Nummer 6 unter den Top 10 Pharmakonzernen) und dzt. Präsident des Startups Kronos Bio- zeigt den Weg zu einer Medizin von Morgen.*
Wohin wird sich die Medizin weiter entwickeln, was lässt sich bereits heute absehen?
Die Medizin von Heute
Ein Charakteristikum der Medizin von heute ist bereits an der Art und Weise erkennbar, wie sie an medizinischen Hochschulen gelehrt wird: es wird eingeteilt nach Körper-Systemen, es gibt den Spezialisten für die Leber, einen anderen für das Herz-Kreislaufsystem, wieder einen anderen für die Lunge, für das Zentralnervensystem usw.
Was die Diagnose betrifft, so erfolgt sie heute auf Grund von Symptomen und von Laborbefunden, die von der Norm - dem statistischen Mittelwert - abweichen. Dies bedeutet beispielweise im Fall der rheumatoiden Arthritis eine Diagnose auf Grund von geschwollenen Gelenken und eines erhöhten CRP-Wertes (CRP: c-reaktives Protein, ein unspezifischer Entzündungsparameter; Anm. Redn). Dazu möchte ich anmerken, dass die sogenannten Normalbereiche von Laborwerten statistisch erhoben werden. In diese Normalbereiche passen 95 % der an einer großen Population erhobenen Messwerte; ein Messwerts der den oberen Grenzwert signifikant überschreitet - beispielsweise ein 2 x höherer Wert des Leberenzyms - wird als anormal betrachtet.
"One size fits all‘ – eine Größe passt für alle
Die Entwicklung von Arzneimitteln ist bis jetzt im Wesentlichen nach dem Schema "one size fits all" erfolgt - quer durch die Bevölkerung, ohne Berücksichtigung von Alter, Geschlecht, ethnischer Zugehörigkeit etc.
Von "one size fits all" gibt es bislang nur einige wenige Ausnahmen und diese sind hauptsächlich in der Onkologie zu finden. Ein Beispiel ist Imatinib (Gleevec), das bereits vor fast rund 2 Jahrzehnten zur Behandlung der chronischen myelogenen Leukämie zugelassen wurde. Gleevec blockiert hier das bei mehr als 90 % der Patienten vorhandene Fusionsprotein BCR-ABL, das ein unkontrolliertes Wachstum der weißen Blutkörperchen verursacht. Ein weiteres Beispiel ist der Antikörper Trastuzumab (Herceptin): dieser blockiert den auf manchen Krebszellen sitzenden Wachstumsfaktor-Rezeptor HER2 und wird bei HER2 positivem Brustkrebs (rund 20 % der Brustkrebsfälle) eingesetzt. In beiden Fällen handelt es sich um Medikamente, die auf definierte Körperteile/Organe wirken.
Aus der jüngsten Zeit stammt eine weitere Ausnahme: der Antikörper Pembrolizumab. Meines Wissens nach ist dies das erste Mal, dass die amerikanische Gesundheitsbehörde FDA ein Medikament zugelassen hat, das nicht auf einen Tumor (z.B. Colon Ca, Brustkrebs) spezifisch wirkt, sondern breit auf alle Tumoren angewandt werden kann, die bestimmte genetische Anomalien aufweisen.
Warum ist die Medizin (noch) auf Symptomatik ausgerichtet, warum vertrauen wir auf statistische Mittelwerte, warum behandeln wir entsprechend definierter Systeme/Organe unseres Körpers? Das ist, weil wir unglaublich komplex sind. (Abbildung 1).
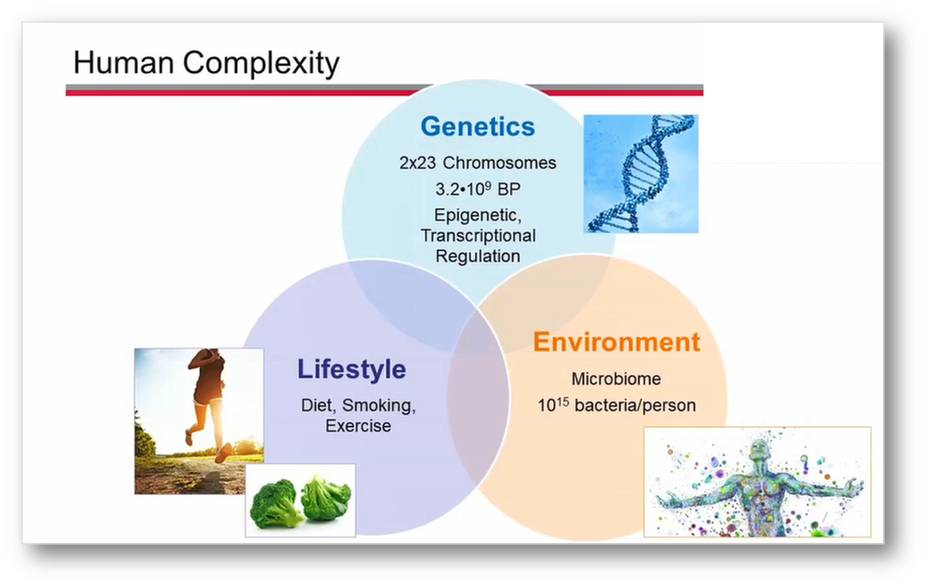 Abbildung 1: Die menschliche Komplexität wird durch unser genetisches Rüstzeug, durch die Umgebung, in der wir leben und durch unsere Lebensführung bedingt.
Abbildung 1: Die menschliche Komplexität wird durch unser genetisches Rüstzeug, durch die Umgebung, in der wir leben und durch unsere Lebensführung bedingt.
Zur Komplexität des Menschen
Komplex ist zum Ersten unser ererbtes, genetisch determiniertes Rüstzeug. Wir besitzen 2 Sets von jeweils 23 Chromosomen und unser Genom setzt sich aus 3,2 Milliarden Basenpaaren zusammen.
Darauf baut die Epigenetik auf. Ohne die in den Genen gespeicherte Information zu beeinflussen, wird - epigenetisch - mittels chemischer Markierungen (Einführung von Methylgruppen) an der DNA, an ihren Gerüstproteinen und an RNAs die Expression der einzelnen Gene und damit die Entwicklung und Steuerung von Körperzellen und deren weiteres Geschick bestimmt.
Dazu kommt dann die Ebene des Transkriptoms, das alle von der DNA in RNA umgeschriebenen (20 000 -25 000) Gene enthält und auch wie die Transkription reguliert wird u.a.m.
Überaus komplex ist auch das, was mit uns lebt, was uns umgibt: das Mikrobiom -Mikroorganismen in uns und um uns herum, die an Zahl die rund 30 Billionen Körperzellen noch übertreffen. Wesentlich zur Komplexität trägt auch unser Lebensstil bei, d.i. wovon wir uns ernähren, welche Schadstoffe wir aufnehmen, wie wir uns bewegen etc.
Bis jetzt war es praktisch unmöglich alle diese hochkomplexen Systeme zusammenzubringen. Wir stehen nun aber am
Beginn einer neuen Daten-gesteuerten Medizin von Morgen
Die Möglichkeit riesige Datenmengen - Big Data - zu speichern und zu verarbeiten und die enorme Effizienzsteigerung und Kostenreduktion neuer analytischer Verfahren lassen uns unglaubliche Durchbrüche erleben, welche die Basis für ein neues Zeitalter einer Daten-gesteuerten Medizin bilden. Triebkräfte sind hier vor allem die Fortschritte
- in der Sequenzierung der DNA,
- im Überwachen physiologischer und umweltbedingter Vorgänge,
- in bildgebenden Verfahren und in der Informationstechnologie,
- und insbesondere in der künstlichen Intelligenz
Megatrends in vielen großen Disziplinen der modernen Systembiologie
sind zu erwarten und zeichnen sich bereits jetzt ab: von der Genomik und Transkriptomik (s.u.) über die Proteomik (die Gesamtheit aller zu einem Zeitpunkt in einem System exprimierten Proteine), die Metabolomik (Gesamtheit aller zu einem Zeitpunkt in einem System vorhandenen Stoffwechselprodukte), den Immunstatus und die Epigenetik bis hin zum Mikrobiom (s.u.).
Beginnen wir mit dem Megatrend Genomik,…
d.i, der systematischen Analyse unseres vollständigen Genoms. Das erste Humangenom-Projekt wurde von den US National Institutes of Health (NIH) finanziert. Sein Start erfolgte 1990, sein Abschluss wurde 2003 offiziell verkündet. Aus diesem Projekt gingen zwei zukunftsweisende Veröffentlichungen hervor, die 2001 - praktisch gleichzeitig - in den Topjournalen Nature und Science erschienen.
Seit damals gab es in dieser Disziplin unglaublich rasante Fortschritte.
Um dies zu veranschaulichen, möchte ich auf das sogenannte Moore'sche Gesetz eingehen: Diese, aus den 1970er Jahren stammende Voraussage von Gordon Moore besagt, dass die Zahl der auf einen Computerchip passenden Transistoren sich alle 18 Monate verdoppelt - eine Prognose die sich bis jetzt als völlig zutreffend erwiesen hat (Abbildung 2). Enthielt um 1970 ein Chip 1000 Transistoren, so sind es heute bereits 10 Milliarden (der Grund, warum heute Handys viel, viel mehr können als die größten Computer in den 1970ern).
Im Vergleich zur Entwicklung, welche die Sequenzierung des Humangenoms genommen hat, fällt der enorme Fortschritt in der Halbleiterindustrie aber geradezu bescheiden aus. Als das Humangenom 2001 sequenziert vorlag, hätte eine weitere Sequenzierung um die 100 Millionen Dollar verschlungen und bei einer dem Moore'schen Gesetz entsprechenden, weiteren Entwicklung würden die Kosten heute bei 1 Million Dollar liegen. Tatsächlich betragen sie aber nur mehr wenige Tausend Dollar und werden in den nächsten Jahren auf wenige 100 Dollar weiter sinken (Abbildung 2).
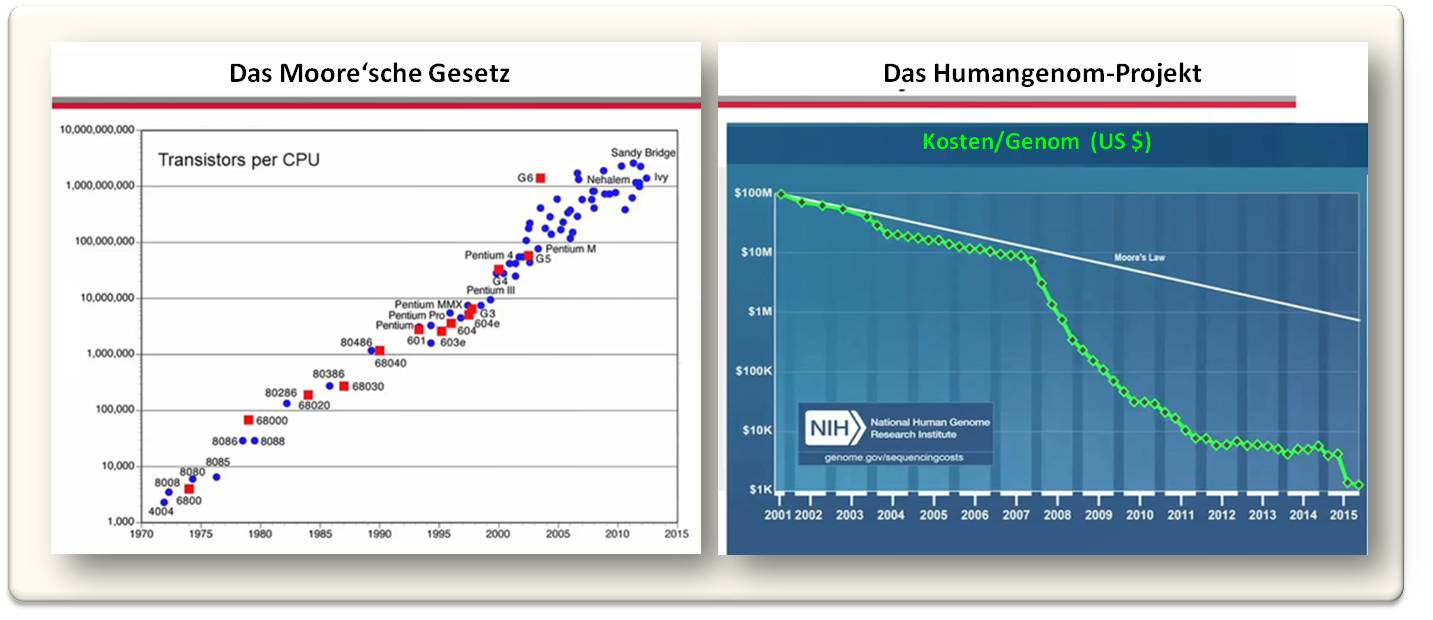 Abbildung 2. Der rasante Fortschritt in der Halbleiterindustrie folgt dem Moore'schen Gesetz, d.i. es tritt eine Verdopplung der Transistoren pro Chip alle 18 Monate ein (rote Punkte sind Intel Transistoren). Noch schneller verlief die Entwicklung effizienterer Verfahren zur DNA-Sequenzierung und die Reduktion der anfallenden Kosten.
Abbildung 2. Der rasante Fortschritt in der Halbleiterindustrie folgt dem Moore'schen Gesetz, d.i. es tritt eine Verdopplung der Transistoren pro Chip alle 18 Monate ein (rote Punkte sind Intel Transistoren). Noch schneller verlief die Entwicklung effizienterer Verfahren zur DNA-Sequenzierung und die Reduktion der anfallenden Kosten.
…und ihrer Bedeutung für die Medizin
Primär wird die Genomik zu einem verbesserten Verstehen von Erkrankungen und wirksameren Therapien führen. Bereits heute werden pränatale Diagnosen erstellt; die Untersuchung des Fruchtwassers von Schwangeren ermöglicht die Analyse der fötalen DNA.
Auf der Basis der Genom-Analysen wird eine Neu-Klassifizierung von Krankheiten stattfinden -nach Ursachen und nicht mehr nur nach Symptomen und anormalen Laborbefunden (wie im oben erwähnten Beispiel der rheumatoiden Arthritis, aus der dann möglicherweise 10 unterschiedliche Krankheitsbilder werden). Eine Klassifizierung der sogenannten Seltenen Erkrankungen (Orphan Diseases) ist bereits erfolgt.
Es sind neue Disziplinen entstanden: die Pharmakogenomik, d.i. der Einfluss des persönlichen Genoms auf die Wirkung von Arzneimitteln, und Personal Genomics, der Zugang des Einzelnen zu seinem vollständigen Genom.
Megatrend Epigenetik: Die Horvath'sche Uhr verrät unser Alter
Wenn man jemanden fragt "wie alt sind Sie", wird die Antwort lauten" ich bin x Jahre alt". Das ist natürlich das chronologische Alter und wie wir wissen, ist chronologisches Alter nicht dasselbe wie biologisches Alter. Einige Leute altern rascher, andere schauen für ihr Alter noch relativ jung aus.
Interessanterweise spiegelt sich das biologische Alter im Epigenom wieder. Die Muster der epigenetischen Markierungen - Methylierungen - verändern sich mit dem Alter der Zellen. Dies hat der an der Universität von Los Angeles tätige Humangenetiker Steve Horvath festgestellt. Aus der Untersuchung von 353 Methylierungsstellen an der DNA hat Horvath einen mathematischen Algorithmus des Musters dieser Stellen entwickelt, der mit dem biologischen Alter korreliert und als sogenannte Horvathsche Uhr bezeichnet wird.
Auf Grund des Musters der 353 Stellen, kann man nun recht genau bestimmen, wie alt jemand tatsächlich ist. Eine positive Differenz zwischen chronologischem und biologischem Alter wird dann als "beschleunigtes Altern" definiert. Langsameres Altern trifft offensichtlich auf hundert (und mehr)jährige Menschen zu (Abbildung 3, links), beschleunigtes Altern ist bei vielen Krankheiten anzutreffen, beispielsweise sind HIV-Kranke im Mittel um 5 Jahre älter als die durchschnittliche Bevölkerung. (Abbildung 3, rechts)
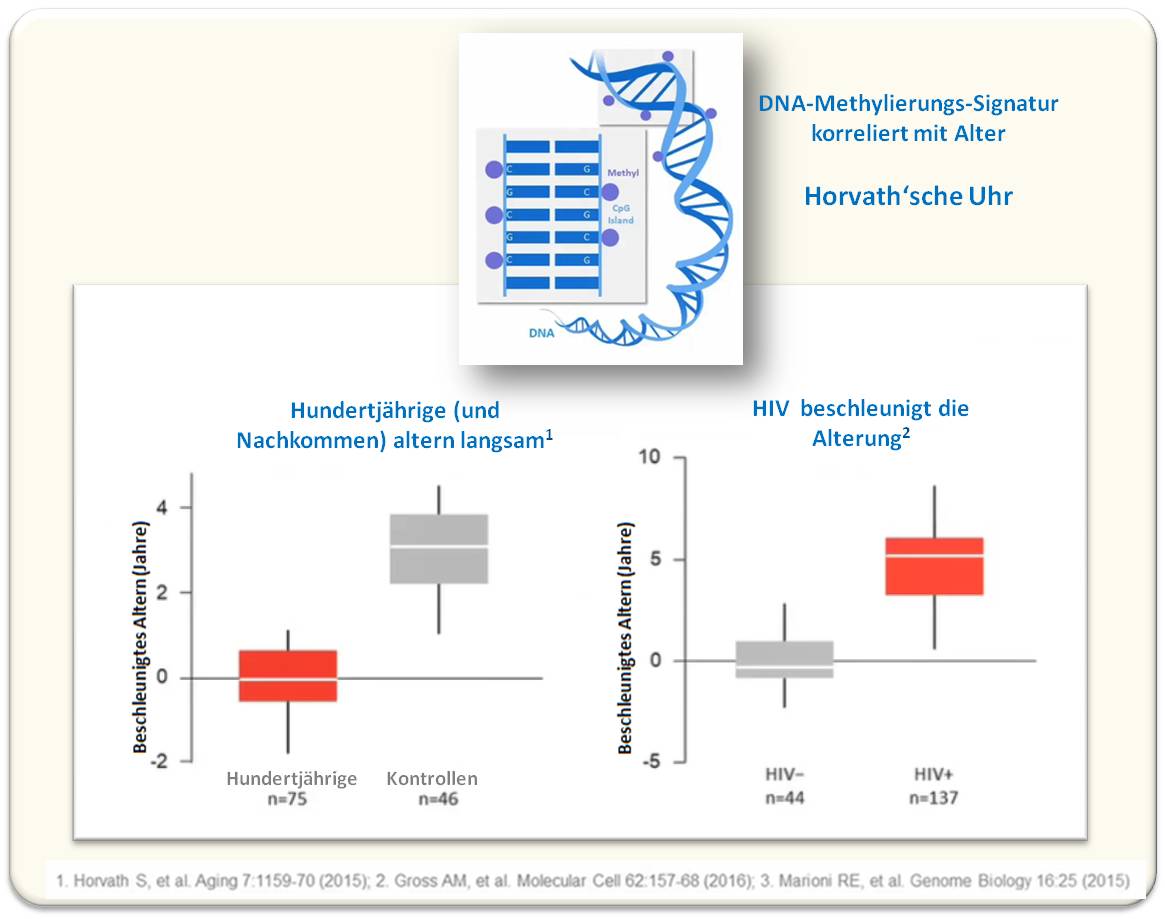 Abbildung 3 . Die klinische Relevanz der Horvath'schen Uhr. Auf Grund des epigenetischen Methylierungsmusters kann das biologische Alter recht genau bestimmt werden. Links: Hundertjährige altern um einige Jahre langsamer als die Normalbevölkerung. Rechts: Die epigenetische Alterung ist in zahlreichen chronischen Erkrankungen - wie beispielsweise HIV - beschleunigt1,2 und lässt die Lebenszeit voraussagen3.
Abbildung 3 . Die klinische Relevanz der Horvath'schen Uhr. Auf Grund des epigenetischen Methylierungsmusters kann das biologische Alter recht genau bestimmt werden. Links: Hundertjährige altern um einige Jahre langsamer als die Normalbevölkerung. Rechts: Die epigenetische Alterung ist in zahlreichen chronischen Erkrankungen - wie beispielsweise HIV - beschleunigt1,2 und lässt die Lebenszeit voraussagen3.
Das Alter wird in Zukunft also neu definiert werden - also nicht wie alt wir unserer Geburtsurkunde nach sind, sondern wie alt wir biologisch sind. Dies hat auch Auswirkungen auf medizinische Behandlungen: beispielsweise vertragen ältere Menschen Chemotherapie wesentlich schlechter als jüngere.
Megatrend: das Mikrobiom
Es ist dies ein Trend der letzten 5 - 10 Jahre. Mikroorganismen in uns und um uns gibt es mehr als Körperzellen. Bis vor kurzem fehlten uns die Methoden um diese Systeme zu analysieren und die Datenflut zu managen. Nun aber können wir durch Sequenzierung der 16s-RNA beispielsweise in Speichel-, Haut- oder Stuhlproben recht einfach auf die Zusammensetzung des dortigen Mikrobioms schließen. Abbildung 4. 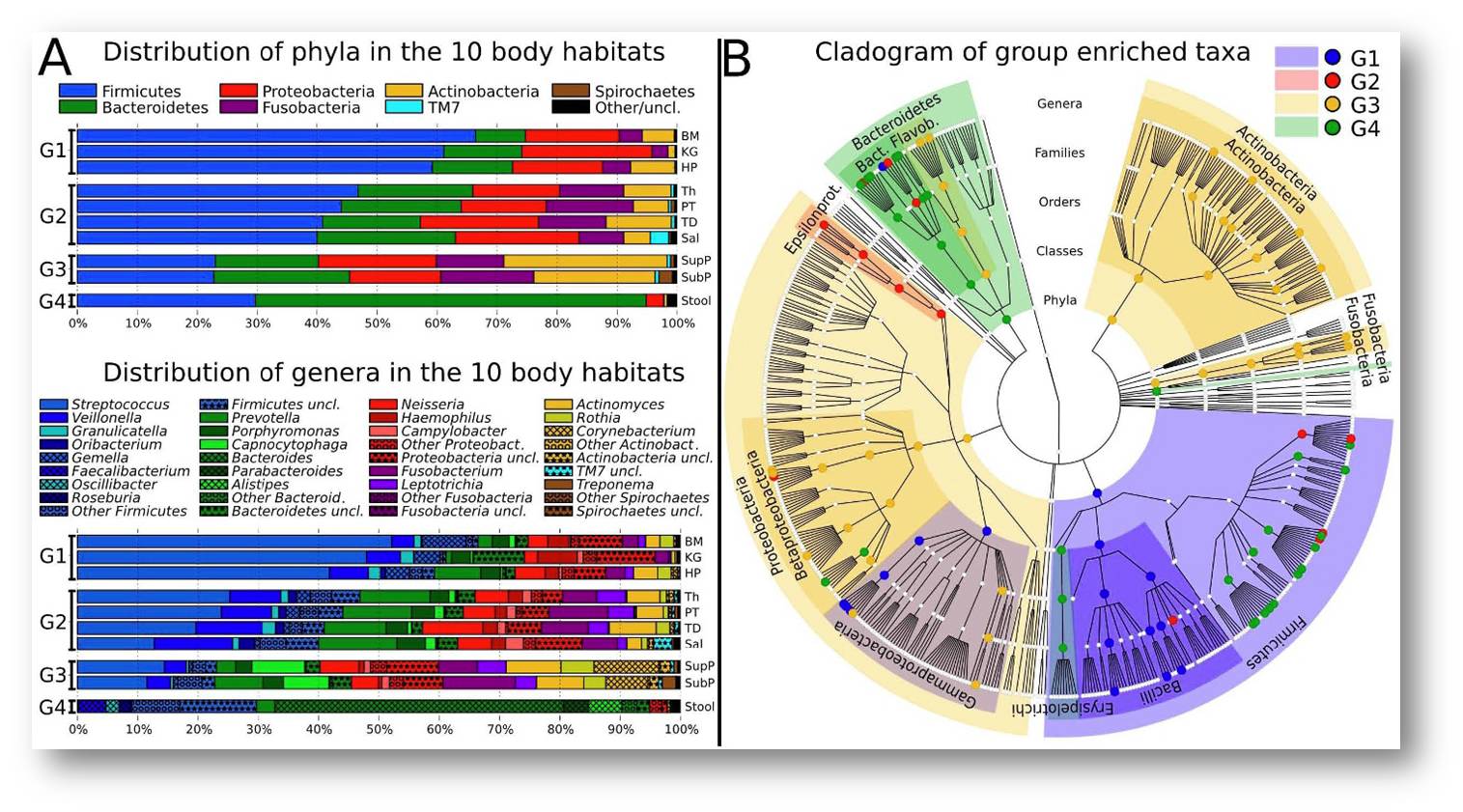
Abbildung 4. Der menschliche Organismus ist Wirt einer Vielfalt und Vielzahl an Mikroorganismen, die auch Einfluss auf unsere Stoffwechselvorgänge und Inzidenz für Krankheiten haben. Taxonomische Zusammensetzung der Prokaryoten an 10 Stellen (Habitaten) des Verdauungsystems, im Mund-/Rachenraum (9 Stellen: G1-G3) und in Stuhlproben(G4). Links: Stämme (Phyla) und Arten (Genera) in den Habitaten G1 - G4. Rechts: Kladogramm - phylogenetische Verwandschaft der Stämme. Quelle: Nicola Segata et al., Genome Biology 2012 13:R42; https://doi.org/10.1186/gb-2012-13-6-r42 (Lizenz: cc-by)
Was man heute dazu bereits aussagen kann:
- zwischen der Genetik des Wirtsorganismus und der des Mikrobioms besteht keine Korrelation,
- das Mikrobiom erklärt aber Parameter wie den Body-Mass-Index (BMI) und den Bauchumfang, den "Nüchternzucker" und Lipoproteine (HDL),
- einige Erkrankungen sind mit einer reduzierten Bakteriendichte assoziiert (beispielsweise Asthma, rheumatoide Arthritis und entzündliche Darmerkrankungen (IBD))
Das Mikrobiom hat aber auch Einfluss auf Vorgänge, an die man so nicht gedacht hätte, Ein Beispiel ist die jüngst erfolgte Schilderung, wie Krebskranke - Melanom-Patienten - auf eine Behandlung mit sogenannten "checkpoint Inhibtioren" - immunstimulierenden Molekülen -, reagierten. Interessanterweise zeigte sich hier, dass Patienten mit einer hohen Diversität von Mikroorganismen wesentlich länger überlebten als solche mit einer mittleren oder niedrigen Diversität.
Fazit
Rasante Effizienzsteigerungen in neuen analytischen Verfahren und die Möglichkeit ungeheure Datenmengen zu speichern und zu verwerten, lassen uns nun einen Paradigmenwechsel in der Medizin erleben. A la longue werden wir von einer Diagnostik abkommen, die auf Grund von Symptomen und von der Norm abweichenden Laborbefunden erstellt wird und dazu gelangen, die überaus komplexe individuelle Situation des Patienten zu erfassen. Das bedeutet ein Abgehen von Therapien nach dem Schema "Eine Größe passt allen" hin zu einer zielgerichteten Behandlung, einer personalisierten Medizin.
* Dies ist die Einleitung zu einer Artikelserie des Autors, die sich im Teil 2 mit dem Einsatz künstlicher Intelligenz und der Bedeutung von "deep learning" auf die Medizin befassen wird und im dritten Teil an Hand der CAR-T Zell Therapie mit Beispielen für "Personalisierte Medizin". Über das gesamte Thema hat Norbert Bischofberger am 6. Dezember 2017 einen Vortrag "The future of medicine: Technology and personalized therapy" in der Österreichischen Akademie der Wissenschaften gehalten.
Weiterführende Links
-
Kronos Bio: http://www.kronosbio.com; "Pursuing therapies against some of the most intractable cancer targets"
-
Gilead Sciences:http://www.gilead.com/
- Steve Horvath: Die Uhr des Lebens (2018) Video 03:57 Min. https://www.youtube.com/watch?v=5qQcUzTma74 Standard-YouTube-Lizenz
-
Interview with Dr. Steve Horvath (2017) Video 4:36 min. https://www.youtube.com/watch?v=iIP0OhzxmFM, Standard-YouTube-Lizenz
-
Robert Knight: Wie unsere Mikroben uns zu dem machen, wer wir sind Video 17:24 min. TED-Talk 2014 (deutsche Untertitel). https://www.ted.com/talks/rob_knight_how_our_microbes_make_us_who_we_are/transcript?language=de
-
Urs Jenal: Der Mensch und sein Mikrobiom.Weltenreise 2016 Video 23:49 min. https://www.youtube.com/watch?v=7S5-okH7Myo Standard-YouTube-Lizenz
Artikel im ScienceBlog:
-
Redaktion, 22.12.2016: Kenne Dich selbst - aus wie vielen und welchen Körperzellen und Mikroben besteht unser Organismus?
-
Francis S. Collins, 28.09.2017: Ein erweiterter Blick auf das Mikrobiom des Menschen
- Printer-friendly version
- Log in to post comments
