Fr, 24.01.2014 - 23:07 — Inge Schuster ![]()
 Cytochrom P450 (abgekürzt CYP) ist der Sammelname für eine Superfamilie an Enzymen, die sich in praktisch allen Lebensformen unserer Biosphäre finden – in Mikroorganismen ebenso wie in Pflanzen und Tieren. Mit ihrer Fähigkeit unterschiedlichste organische Verbindungen zu oxydieren generieren diese Enzyme eine ungeheure Vielzahl und Vielfalt von Produkten, die entscheidend in Aufbau und Regulierung der Spezies eingreifen und damit zu deren Überleben, aber auch zu deren Evolution beitragen. CYP-gesteuerte Prozesse, die den Abbau von Fremdstoffen – Entgiftung - und die Synthese und Abbau körpereigener Signalmoleküle ermöglichen, sind von zentraler Bedeutung für alle Sparten der Lebenswissenschaften und Anwendungen der Biotechnologie. In die öffentliche Wahrnehmung und in die Lehrpläne unserer Schulen und Hochschulen haben derartige Inhalte aber noch kaum Eingang gefunden.
Cytochrom P450 (abgekürzt CYP) ist der Sammelname für eine Superfamilie an Enzymen, die sich in praktisch allen Lebensformen unserer Biosphäre finden – in Mikroorganismen ebenso wie in Pflanzen und Tieren. Mit ihrer Fähigkeit unterschiedlichste organische Verbindungen zu oxydieren generieren diese Enzyme eine ungeheure Vielzahl und Vielfalt von Produkten, die entscheidend in Aufbau und Regulierung der Spezies eingreifen und damit zu deren Überleben, aber auch zu deren Evolution beitragen. CYP-gesteuerte Prozesse, die den Abbau von Fremdstoffen – Entgiftung - und die Synthese und Abbau körpereigener Signalmoleküle ermöglichen, sind von zentraler Bedeutung für alle Sparten der Lebenswissenschaften und Anwendungen der Biotechnologie. In die öffentliche Wahrnehmung und in die Lehrpläne unserer Schulen und Hochschulen haben derartige Inhalte aber noch kaum Eingang gefunden.
Es gibt Tausende und Abertausende CYPs
In den folgenden Jahrzehnten wurden CYPs in praktisch allen bisher untersuchten Spezies – von den Einzellern zu den Vielzellern im Pilze-,Pflanzen- und Tierreich - entdeckt. Mit der nun immer rascheren Sequenzierung der Genome von vielen weiteren Organismen steigt die Zahl der CYPs geradezu explosionsartig an: im August 2013 waren bereits mehr als 21 000 unterschiedliche CYPs beschrieben (Abbildung 1). Zweifellos erfolgt die Identifizierung von CYP-Genen wesentlich rascher als deren biochemische Charakterisierung erzielt werden kann, dennoch zeigen die bereits gewonnenen Einsichten einen ungeheuren Einfluss der CYPs auf die Zusammensetzung der Biosphäre und Ökologie der Welt, in der wir leben.
Wieviele unterschiedliche CYPs eine Spezies enthält, ist variabel: Die meisten CYPs - bis über 400 Gene -werden in Pflanzen gefunden, beispielsweise in Reis, Kartoffel, oder Baumwolle. Im Tierreich liegt deren Zahl zwischen 35 und 235; der Mensch besitzt 57 unterschiedliche CYPs.
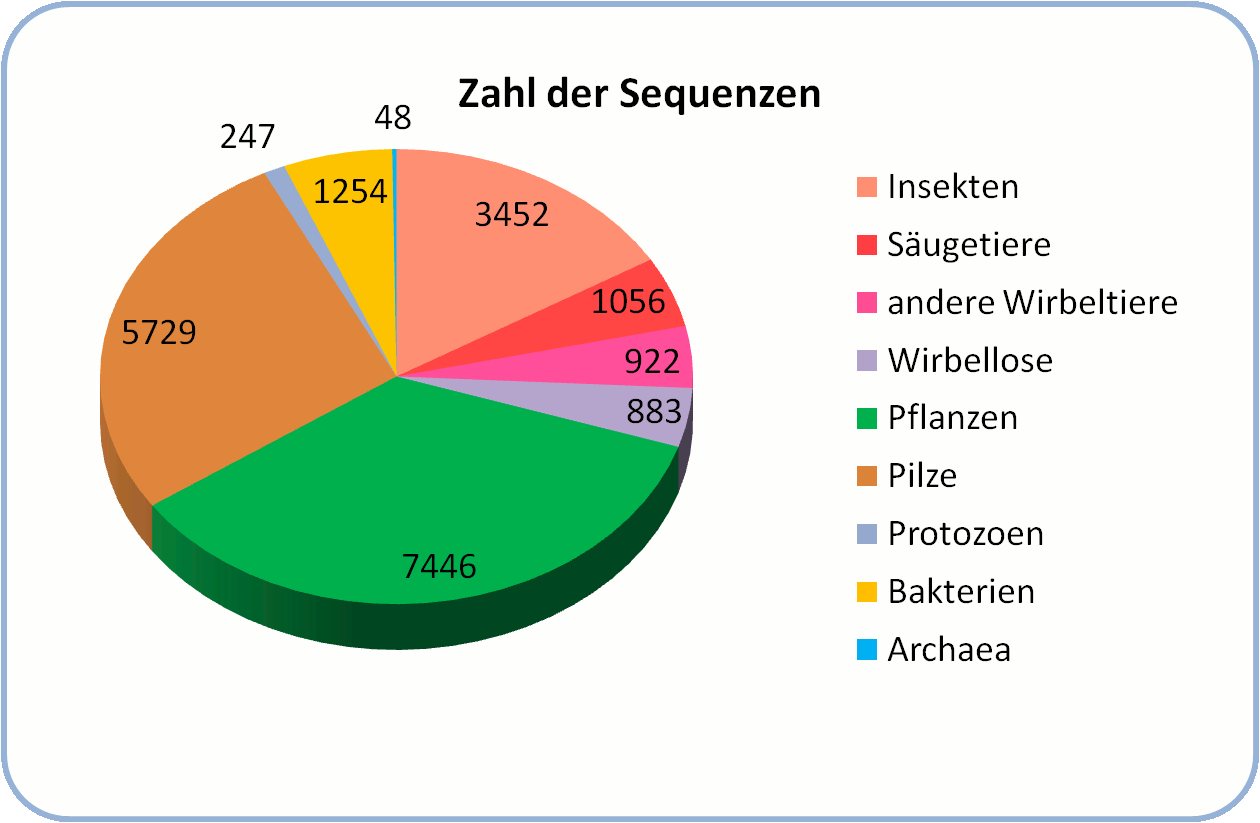 Abbildung 1. CYPs sind in praktisch allen Lebensformen zu finden; bis jetzt wurden mehr als 21 000 unterschiedliche CYPs aufgelistet. (Stand vom August 2013: http://drnelson.uthsc.edu/P450.stats.Aug2013.png)
Abbildung 1. CYPs sind in praktisch allen Lebensformen zu finden; bis jetzt wurden mehr als 21 000 unterschiedliche CYPs aufgelistet. (Stand vom August 2013: http://drnelson.uthsc.edu/P450.stats.Aug2013.png)
Um alle diese CYPs eindeutig erfassen und zuordnen zu können, wurde eine recht brauchbare Nomenklatur entwickelt, welche auf Basis der Übereinstimmung von Aminosäuresequenzen die Proteine in Familien (mehr als 40 % Übereinstimmung) und diese wiederum in Subfamilien (mehr als 55 % Übereinstimmung) einteilt. Die offizielle Bezeichnung eines Cytochrom P450 - z.B. das in der menschlichen Leber besonders reichlich vorhandene CYP3A4 - beginnt mit der Abkürzung CYP gefolgt von einer Ziffer, die für die Familie steht (hier ist es die Familie 3), gefolgt von einem Buchstaben, der die Unterfamilie charakterisiert und schließlich einer Zahl für das individuelle Protein.
Ursprung und Evolution der CYPs
Auf der Basis von Sequenzvergleichen erstellte Stammbäume weisen darauf hin, daß alle CYPs sich aus einem Ur-CYP entwickelten, welches bereits in einer sehr frühen Lebensform, schon vor dem Übergang von Prokaryonten zu Eukaryonten, auftrat: eine potentielle Urform könnte CYP51 sein, das essentiell ist für die Synthese der für die Eukaryonten-Membranen benötigen Sterole und auch in praktisch allen aeroben Organismen zu finden ist. Mutationen in den frühen CYPs, aus denen Vorteile für eine Spezies erwuchsen, haben zu deren weiterer Entwicklung beigetragen und wurden so zur Triebkraft der Evolution.
Die Bedeutung von CYPs für unsere Biosphäre soll hier nur ganz kurz am Beispiel der Pflanzenwelt aufgezeigt werden. Das Reich der Pflanzen ist ohne CYPs nicht vorstellbar. Pflanzen synthetisieren mit Hilfe diversester CYPs eine riesige Fülle von niedermolekularen Substanzen (z.B. Alkaloide, Flavonoide, Phytohormone, etc), die sie zur Adaptation an ihre Umgebung, zum Schutz vor Umweltbedingungen und zur Abwehr gegen Feinde einsetzen.
Viele derartige Naturstoffe haben für uns interessante pharmakologische Eigenschaften und dienen uns als (Ausgangsstoffe für) Arzneimittel, wie beispielsweise Morphin oder aktuell das gegen Malaria hochwirksame Artemisinin. Biotechnologische Verfahren zur Herstellung von Naturstoffen bedienen sich in zunehmendem Maße der entsprechenden CYPs.
Von besonderer Bedeutung für unsere Biosphäre ist die Schlüsselrolle von CYPs in der Synthese des Lignins - eines der wichtigsten Biopolymeren unserer Erde ; ohne diese CYPs gäbe es keine größeren Pflanzen am Land , keine Wälder und für uns keinen entsprechenden Rohstoff. Auch in den Abbau von Lignin sind CYPs involviert, die beispielsweise in einigen Pilzen vorkommen, denen die Abbauprodukte als Nahrungsquelle dienen.
CYPs im Porträt
Allen CYPs aus allen Spezies gemeinsam
- Ist eine Primärstruktur, die aus einer einzigen Kette von rund 500 Aminosäuren besteht und sich trotz sehr unterschiedlicher Sequenzen zu sehr ähnlichen 3D-Strukturen faltet,
- Ist der prinzipielle Mechanismus, nach welchem die Umwandlung unterschiedlichster organischer Verbindungen in diverseste Produkte erfolgt – seien es Metabolite des endogenen Stoffwechsels, wie z.B. Lipide, Steroide, Prostaglandine, Neurotransmitter, etc., seien es in den Organismus aufgenommene Fremdstoffe wie u.a. Lösungsmittel, Kohlenwasserstoffe, Pestizide, Kanzerogene und auch Arzneimittel.
Zur Gestalt von CYPs
Um Daten zu Gestalt und Funktion von Proteinen mittels Röntgen-Strukturanalyse zu erhalten, müssen diese in ihrer Kristallform vorliegen. Die Kristallisierung der in höheren Organismen vorwiegend Membran-gebundenen Cytochrom P450-Enzyme erwies sich über lange Jahre als überaus schwierig. Durchbrüche in diesen Techniken haben dann zu einer Flut neuer struktureller Daten geführt: In der Datenbank des NIH sind bereits nahezu 1000 Strukturanalysen unterschiedlicher CYP-Proteine und ihrer Komplexe mit Substraten und Inhibitoren gespeichert.
Alle diese Proteine - von den Formen in Bakterien bis zu den Formen im menschlichen Organismus – zeichnen sich durch eine sehr ähnliche 3D-Struktur aus, die grob vereinfacht an ein dreiseitiges Prisma erinnert. Wesentliche Strukturelemente sind 12 alpha-Helizes, die einen Helix-reichen Bereich bilden und ein beta-Faltblatt Bereich (Abbildung 2). Das Reaktionszentrum ist eine „Tasche“, die zwischen dem Helix-reichen- und dem Faltblatt-Bereich ausgebildet wird und - mit der Hämgruppe an ihrem Boden - zumeist im Inneren dieser Proteine sitzt. Größe, Gestalt und Auskleidung mit polaren/unpolaren Aminosäuregruppen dieser Taschen variieren bei unterschiedlichen CYPs – sind optimiert um die entsprechenden Substrate darin zu binden und ihre Umwandlung zu katalysieren. 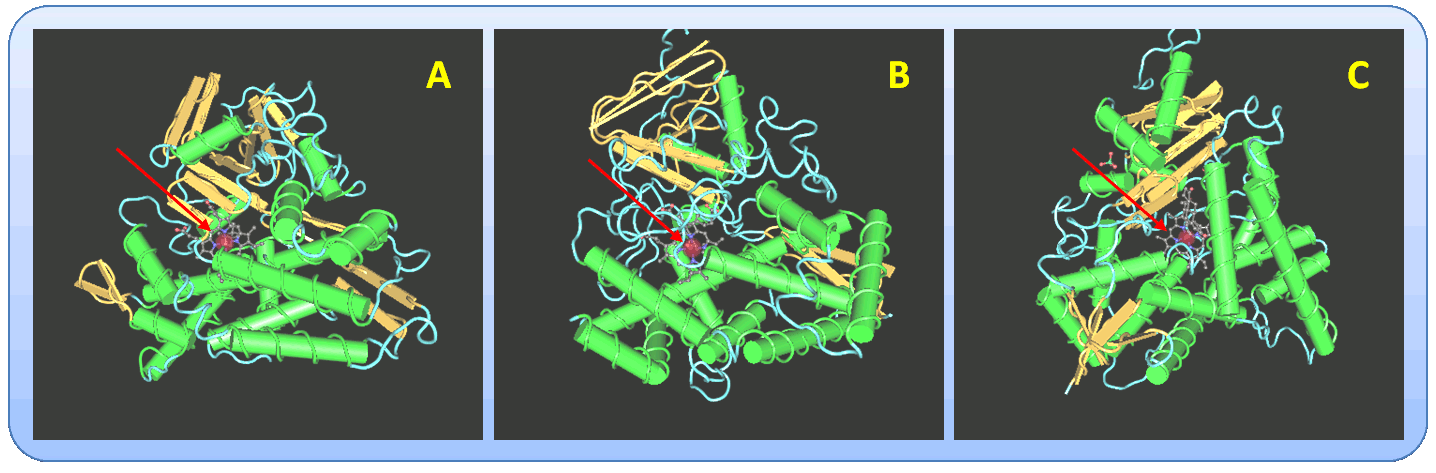 Abbildung 2. Kristallstrukturen von Cytochrom P450. A) Bakterielles CYP101 (Pseudomonas putida; wächst auf Campher, den es oxydiert; Code: 6CPP), B) Pflanzliches CYP74A (Arabidopsis thaliana; oxydiert Allenoxyde; Code: 2RCL), C) Humanes CYP19A1 (Aromatase aus der Placenta, wandelt Androgene in Östrogene um; Code 3EQM). Die alpha-helikalen Elemente sind durch grüne Röhren markiert, der beta-Faltblattbereich ist gelb. Die roten Pfeile weisen auf die Hämgruppe(Eisen:rote Kugel) im Reaktionszentrum hin. (Quelle: http://www.ncbi.nlm.nih.gov/Structure/index.shtml)
Abbildung 2. Kristallstrukturen von Cytochrom P450. A) Bakterielles CYP101 (Pseudomonas putida; wächst auf Campher, den es oxydiert; Code: 6CPP), B) Pflanzliches CYP74A (Arabidopsis thaliana; oxydiert Allenoxyde; Code: 2RCL), C) Humanes CYP19A1 (Aromatase aus der Placenta, wandelt Androgene in Östrogene um; Code 3EQM). Die alpha-helikalen Elemente sind durch grüne Röhren markiert, der beta-Faltblattbereich ist gelb. Die roten Pfeile weisen auf die Hämgruppe(Eisen:rote Kugel) im Reaktionszentrum hin. (Quelle: http://www.ncbi.nlm.nih.gov/Structure/index.shtml)
Zur Funktion von CYPs
Ohne auf Details einzugehen, lässt sich der komplexe Reaktionsmechanismus als Übertragung von Sauerstoff auf Substrate, also als Oxydation darstellen: Sauerstoff, der im Reaktionszentrum an das Eisen der Hämgruppe bindet, wird in mehreren Schritten aktiviert und sodann auf das, in optimaler Distanz im Reaktionszentrum fixierte, Substrat übertragen. Dies führt zur Einfügung von Hydroxylgruppen in das Substrat, zur weiteren Oxýdation vorhandener Hydroxylgruppen, zur Spaltung von Kohlenstoff-Kohlenstoff-, Kohlenstoff-Stickstoff-, Kohlenstoff-Sauerstoff-, Kohlenstoff-Halogen-Bindungen und vielen anderen Reaktionen.
Mit der Änderung in der chemischen Zusammensetzung der Substrate ändern sich auch deren Eigenschaften massiv: durch das Einfügen von Hydroxylgruppen und Abspalten von Alkylgruppen i) werden die Moleküle wasserlöslicher (polarer) und damit rascher aus den Zellen und aus den ganzen Organismen ausgeschieden, ii) erfahren die Moleküle eine Modifizierung ihrer Wechselwirkung mit Biomolekülen (Rezeptoren) und damit ihrer biologischen Aktivität: sie „passen“ nicht mehr in „ihren“ Rezeptor und/oder sie sind nun für einen neuen Rezeptor adaptiert.
Schutz vor Fremdstoffen
Von enormer Bedeutung ist die Rolle von CYPs im Abbau von Fremdstoffen, die aus Umwelt und Nahrung in den Organismus gelangen. Eine Voraussetzung für deren Aufnahme in den Organismus ist eine gewisse Fettlöslichkeit (Lipophilie), die sie befähigt durch die Lipidschicht der Zellmembranen durchzutreten. Ohne einen effizienten Abbaumechanismus würden derartige Fremdstoffe nun in den Zellen akkumulieren und diese zunehmend schädigen.
Säugetiere besitzen ein Set an CYPs, das es ihnen ermöglicht praktisch jedes organische Molekül – auch solche, die in Zukunft noch synthetisiert werden – zu wasserlöslicheren und damit ausscheidbaren Produkten abzubauen. Dazu wird nicht durch eine Vielzahl an hochspezifischen CYPs benötigt, sondern relativ wenige CYPs, die breite, teilweise überlappende Spezifitäten aufweisen, d.h. jedes dieser CYPs kann in seinem Reaktionszentrum eine Palette unterschiedlicher Substrate akkommodieren und oxydieren.
Von den 57 CYPs im Körper des Menschen sind etwa 12 hauptsächlich mit dem Abbau von Fremdstoffen beschäftigt. Diese befinden sich in den meisten Körperzellen, vor allem in den Zellen des Darmes und in der Leber, die über die Nahrungsaufnahme hohen Konzentrationen an Fremdstoffen ausgesetzt sind. Um eine gesteigerte Zufuhr von Fremdstoffen zu bewältigen, können einige CYPs vermehrt gebildet – induziert – werden. Dies gilt auch für die meisten Arzneimittel, die als Fremdstoffe über CYPs metabolisiert werden; in den meisten Fällen führt dies zu Reduzierung und Verlust der Wirkung und zur raschen Eliminierung der entstandenen Metabolite aus dem Körper. In manchen Fällen können auch Metabolite entstehen, die toxisch sind.
Synthese und Abbau körpereigener Verbindungen
Die Mehrzahl der CYPs in Säugetieren ist in die Synthese und den Metabolismus endogener Verbindungen involviert. Zum Unterschied von den Fremdstoff-metabolierenden CYPs handelt es sich hier größtenteils um hochspezifische Enzyme; d.h. jedes dieser CYPs bindet und oxydiert nur ein einziges (oder ganz wenige, sehr ähnliche) Substrat(e). Eine Zusammenstellung wesentlicher endogener Substrate und Metabolite findet sich in Abbildung 3.
 Abbildung 3. Klassen endogener Substrate der CYPs. Die in Synthese und/oder Metabolismus involvierten CYPs sind entsprechend der offiziellen Nomenklatur angegeben.
Abbildung 3. Klassen endogener Substrate der CYPs. Die in Synthese und/oder Metabolismus involvierten CYPs sind entsprechend der offiziellen Nomenklatur angegeben.
Zu den wichtigsten Substraten und Produkten gehören hier Steroidhormone und die hormonell aktive Form des Vitamin D3 (ein Secosteroid), die zentrale Rollen in der Kontrolle und Steuerung unseres Stoffwechsels, der Immunfunktionen, des Wasser- und Salzhaushalts, der Entwicklung von Geschlechtsmerkmalen und der Fortpflanzung haben. Gestagene, Androgene, Östrogene, Glucocorticoide und Mineralcorticoide entstehen aus Cholesterin, welches in einer Kaskade von Reaktionen durch spezifische CYPs an unterschiedlichen Stellen oxydiert wird. Auch die Aktivierung von Vitamin D3 zum aktiven Hormon und sein anschließender Metabolismus vollzieht sich ausschließlich über spezifische CYPs.
Cholesterin wird durch CYPs auch zu Gallensäuren oxydiert, die für Fettverdauung und Galleeliminierung unerläßlich sind, und zu sogenannten Oxysterolen, die u.a. Aufnahme und Stoffwechsel von Cholesterin regulieren.
Wichtige Funktionen haben CYPs im Metabolismus von Fettsäuren, insbesondere der Arachidonsäure (einer vierfach ungesättigten C20-Fettsäure - „Eicosatetraensäure“ ), die Ausgangssubstanz für eine Fülle an Produkten, den Eicosanoiden ist (u.a. von Prostaglandinen, Leukotrienen, Thromboxan, Prostacylin, EETs (Epoxy-Eicosatetraensäuren), HETEs (Hydroxyeicosatetraensäuren),..). Eicosanoide steuern als kurzlebige lokale Hormone praktisch alle Lebensvorgänge (u.a. Vasoconstriction, Broncho-Constriction,- dilatation, Muskelkontraktion, Oedembildung, Inflammation, Schmerz, Mitogenese u.v.a.). Die Bildung von Thromboxan und Prostacylin erfolgt über spezifische CYPs (CYP5A1, CYP8A1), mehr als 100 weitere Eicosonaide werden durch CYPs gebildet und/oder abgebaut.
Schlussendlich sollte auch die aktive hormonelle Form des Vitamin A – all-trans-Retinsäure – erwähnt werden, die eine Schlüsselrolle in Embryogenese/Morphogenese spielt und in viele anderen Regulationsvorgänge kontrolliert.
Fazit
Das Positive: CYPs haben die Welt, in der wir leben, entscheidend mitgestaltet und sind aus unserer Biosphäre nicht wegzudenken. Dementsprechend sind CYPs wichtige Themen von Grundlagen- und angewandter Forschung in allen Disziplinen der Lebenswissenschaften - von Mikrobiologie über Botanik, Umweltwissenschaften und Ökologie, Physiologie, Pharmakologie, Toxikologie bis hin zur Medizin. Beispielsweise ist eine Entwicklung neuer Arzneimittel nicht möglich ohne ausführliche Studien wie schnell, durch welche CYPs und zu welchen Produkten ein möglicher Kandidat abgebaut wird. Moderne Landwirtschaft ist nicht denkbar ohne auf CYP-basierenden Pflanzenschutz gegen Pilzerkrankungen, ohne Strategien gegen die durch CYP-hervorgerufene Resistenzentwicklung von Insektiziden. In jüngster Zeit verwendet die Biotechnologie in zunehmendem Maße CYP-Enzyme um ansonsten überaus komplizierte Synthesen auszuführen (wie z.B. in jüngster Zeit die Synthese des Antimalariamittels Artemisinin) und der neue Zweig „Synthetische Biologie“ um gewünschte, neue Synthesen nachzubauen.
Das Negative: In die öffentliche Wahrnehmung - vor allem in unserem Land und in die Lehrpläne unserer Schulen und Hochschulen - haben derartige Inhalte noch kaum Eingang gefunden.
Outlook: Zu den verschiedenen Gesichtspunkten dieses Blog-Eintrags werden weitere Artikel erscheinen.
Weiterführende Links
Leider gibt es zu diesem Themenkreis noch kein leicht verständliches Lehrbuch. Weiterführende Literatur und Antworten zu allen Fragen können von der Autorin erhalten werden (die ihren Einstieg in dieses ungemein spannende Gebiet vor 44 Jahren nie bereut hat).
Cytochrome P450: versatile Enzymsysteme mit Anwendungen in der Biotechnologie und Medizin. R. Bernhardt http://www.uni-saarland.de/fileadmin/user_upload/Campus/Forschung/forsch...
Cytochrome P450. Enzymfamilie mit zentraler Bedeutung. http://www.pharmazeutische-zeitung.de/?id=40909
Strukturdatenbanken:
NIH: Kristallstrukturen aller bis jetzt analysierten CYPs: http://www.ncbi.nlm.nih.gov/pubmed/?term=cytochrome+p450
Protein Data Bank: http://www.pdb.org/pdb/home/home.do
GENOME: CYTOCHROME P450 ENZYMES. Video 3.07 min. (Englisch) http://www.youtube.com/watch?v=Z2uadurrclM
Phase I Metabolism - Pharmacology Lect 7 (Drug Metabolism) Video 6:56 min (Englisch). http://www.youtube.com/watch?v=GGLddVpVg9M
Beiträge im Blog zu verwandten Themen:
Die Sage vom bösen Cholesterin
Zu Wirkung und Nebenwirkungen von Medikamenten
Vitamin D – Allheilmittel oder Hype?
- Printer-friendly version
- Log in to post comments
