Do, 20.10.2011- 04:20 — Günther Bonn
Die Analytische Chemie ist ein Teilgebiet der Chemie und beschäftigt sich mit der Identifizierung und Konzentrationsbestimmung von chemischen Verbindungen. Sie hat in den letzten Jahrzehnten zunehmend an Bedeutung gewonnen. Ein Rückblick zeigt, dass es im Laufe der Jahre immer wichtiger wurde, die Zusammensetzung von Stoffen in verschiedenen Bereichen wie z.B. der Lebensmittel- oder Pharmaindustrie aber auch in der Medizin, präziser und empfindlicher bestimmen zu können.
Damit verbunden ist die ständige Entwicklung von neuen analytischen Methoden, die Einblick in die Zusammenhänge von Molekülen liefern. Die Bedeutung der Analytischen Chemie wird auch durch die steigende Anzahl an Publikationen verdeutlicht (Abbildung 1).
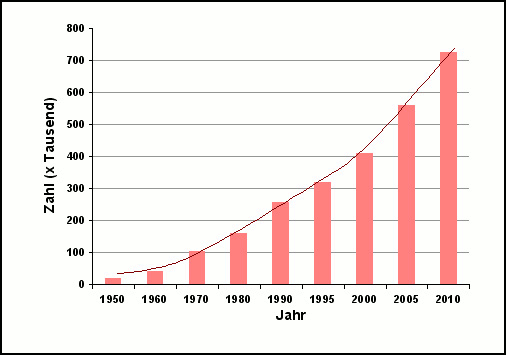 Abbildung 1: Anzahl der in den letzten 60 Jahren publizierten Artikel mit dem Schlüsselwort „Analytik“
Abbildung 1: Anzahl der in den letzten 60 Jahren publizierten Artikel mit dem Schlüsselwort „Analytik“
Die Analytische Chemie ist geprägt von einer rasanten technologischen Entwicklung beginnend im letzten Jahrhundert. Nachfolgende Tabelle 1 gibt einen auszugsweisen Überblick über signifikante innovative analytische Entwicklungsschritte.
In den letzten Jahrzehnten wurden Trennmethoden wie die Gaschromatographie (GC) oder die Hochleistungsflüssigkeitschromatographie (HPLC) entwickelt und optimiert. An dieser Stelle seien Prof. Erika Cremer als Pionierin erwähnt, die 1946 an der Universität Innsbruck mit ihren Dissertanten an der Entwicklung der GC entscheidend mitwirkte und Prof. Csaba Horvath, der an der Yale Universität (USA) in den 60er Jahren mit anderen Kollegen die Hochleistungsflüssigkeitschromatographie-Trenntechnologie entwickelte. Ebenfalls dort wurden Kopplungsverfahren zwischen Trenntechnologie- (HPLC) und Strukturaufklärungsmethoden (Massenspektrometrie – MS) geschaffen, die heute aus den Laboratorien nicht mehr wegzudenken sind. Dafür erhielt Prof. John Fenn 2002 den Nobelpreis für Chemie.
| Jahr | Analysenmethode |
|---|---|
| 1906 | Chromatographie |
| 1930 | Elektrophorese |
| 1937 | Rasterelektronenmikroskopie |
| 1941 | Verteilungschromatographie |
| 1946 | NMR-Spektroskopie (NMR) |
| 1946 | Gaschromatographie (GC) |
| 1950 | Massenspektrokopie (MS) |
| 1960 | Röntgenstrukturanalyse |
| 1963 | Hochleistungsflüssigkeits- chromatographie (HPLC) |
| 1976 | DNA-Sequenzanalyse |
| 1987 | MALDI-MS |
| 1987 | ESI-MS |
Tabelle 1: Entwicklung wichtiger analytischer Methoden im letzten Jahrhundert
Insbesondere Fachgebiete der Biowissenschaften (engl. life sciences) benötigen immer empfindlichere und selektivere Methoden, um Mechanismen der Entstehung von Krankheiten oder ganze Krankheitsbilder möglichst früh zu erkennen. Dadurch können kontinuierlich neue Erkenntnisse über molekulare Zusammenhänge komplexer Krankheiten wie Krebs, Diabetes oder Alzheimer gewonnen werden. Ziel ist eine personenbezogene Diagnostik und Therapie. Im Zentrum des Interesses steht dabei die Biomarkerforschung, die sich mit der systematischen Erforschung von Biomolekülen wie DNA, RNA, Peptiden, Proteinen und Metaboliten beschäftigt, um deren Funktion in biologischen Systemen für die Entstehung und den Verlauf von Krankheiten zu untersuchen. Der interdisziplinäre Fachbereich Bioanalytik liefert die erforderlichen Werkzeuge und Methoden zur Lokalisierung und Identifizierung dieser Biomarker. Um im unteren Konzentrationsbereich (attomol=10-18 Mol) Analysen durchführen zu können, ist es insbesondere in der biowissenschaftlichen Forschung und in der Diagnostik notwendig, Moleküle aufzukonzentrieren, um sie dann mit den modernen Trennmethoden und Detektoren, wie z.B. die der Massenspektrometrie zu erfassen.
Am Institut für Analytische Chemie und Radiochemie der Leopold-Franzens Universität Innsbruck werden seit Jahren innovative Verfahren entwickelt, mit deren Hilfe potentielle Biomarker an modifizierten Trägermaterialien angereichert werden können. Diese Oberflächen sind chemisch so gestaltet, dass nur ganz bestimmte Biomoleküle an ihnen anhaften, sodass eine hohe Selektivität und Empfindlichkeit erreicht wird. Leitet man eine biologische Probe wie Blutserum oder Urin über derartige Trägermaterialien, werden die relevanten Moleküle gebunden und in weiterer Folge einer Identifizierung unterzogen. Die gebundenen Biomoleküle dienen in der medizinischen Diagnostik als Marker für z.B. Tumorerkrankungen oder neurodegenerative Erkrankungen. Die neu entwickelten analytischen Verfahren werden vor allem im Bereich der so genannten Proteomforschung (engl. proteomics) eingesetzt. Die Proteomforschung ist ein noch junger Fachbereich, der sich mit der systematischen Erforschung der Eiweißstoffe in biologischen Systemen beschäftigt. Sie analysiert Art und Menge der vorhandenen Proteine sowie deren Mechanismus.
In diesem Zusammenhang kommt der Phosphoproteomforschung (engl. phosphoproteomics) eine große Bedeutung zu, deren Inhalt die Untersuchung von Proteinen ist, die mit einer oder mehreren Phosphatgruppen versehen sind. Das Anhängen und Abspalten von Phosphatgruppen ist einer der wichtigsten Mechanismen zur Feinregulierung zellulärer Abläufe. Auf diese Weise werden Signalwege, die zu Wachstum, Reifung oder Tod einer Zelle führen, durch Phosphorylierungen an- oder ausgeschaltet. Einer der Schlüssel zur Erforschung natürlicher Systeme ist es zu verstehen, welche Proteine, wann, wo und wie oft phosphoryliert werden. Auch bei der Entstehung vieler Krankheiten spielen fehlgesteuerte Phosphoproteine eine entscheidende Rolle. Neue analytische Werkzeuge kommen auch hier zum Einsatz. Für die selektive Anreicherung von phosphorylierten Peptiden und Proteinen wurden spezielle Methoden entwickelt, die auf Basis der Festphasenextraktion beruhen. So wurden bereits 2008 am Institut für Analytische Chemie und Radiochemie Pipettenspitzen inwendig mit einem organischen Polymer ausgekleidet, das von winzigen Kanälen und Poren durchzogen ist (Abbildung 2).
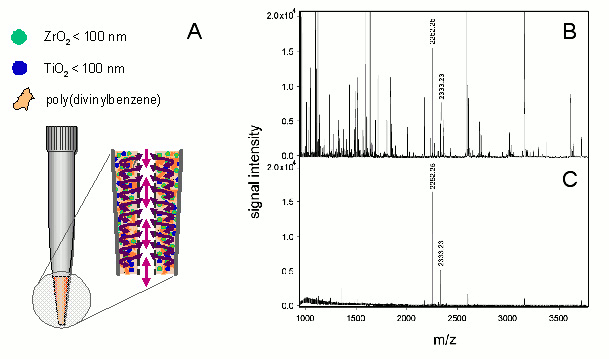 Abbildung 2: Modifizierte Pipettenspitze zur Anreicherung von phosphorylierten Peptiden (A)... Massenspektrum vor (B) und nach der Anreicherung eines enzymatischen Erk1 Protein Verdaues (C). Die zwei phosphorylierten Peptide (m/z 2252 und 2333) können mit Hilfe der Extraktionsspitzen komplett isoliert werden
Abbildung 2: Modifizierte Pipettenspitze zur Anreicherung von phosphorylierten Peptiden (A)... Massenspektrum vor (B) und nach der Anreicherung eines enzymatischen Erk1 Protein Verdaues (C). Die zwei phosphorylierten Peptide (m/z 2252 und 2333) können mit Hilfe der Extraktionsspitzen komplett isoliert werden
In diesem Polymer befinden sich Titan- und Zirkoniumdioxid-Nanopartikel. Diese sind in der Lage, Phosphoproteine zu binden, und zwar spezifischer als das mit bisherigen Materialien möglich gewesen ist. Mit derartigen Pipettenspitzen kann man biologische Proben aufsaugen und die Phosphoproteine bleiben in der Spitze kleben. Der Rest der Probe wird ohne Phosphoproteine wieder entlassen. Mit ähnlichen Methoden lassen sich auch bestimmte Proteine, die in Verbindung mit der Alzheimerkrankheit stehen, selektiv aus Liquor anreichern.
Ein weiteres innovatives Verfahren zur selektiven Anreicherung von Biomolekülen ist die Entwicklung von chemisch modifizierten DVD Trägern. Dabei wurde eine konventionelle DVD mit einem Diamantfilm so beschichtet, dass an der Oberfläche Biomoleküle selektiv angereichert werden können. Anschließend wird die DVD mit einem Laser beschossen. Dabei wirkt die Diamantschicht als energieabsorbierende Matrix, welche die Biomoleküle vor der Lasereinwirkung schützt. Durch den Laserpuls geraten die Moleküle in die gasförmige Phase und können anschließend in einem Massenspektrometer identifiziert werden. Die Unterseite der DVD dient als Speichermedium der erhaltenen Daten (Abbildung 3). 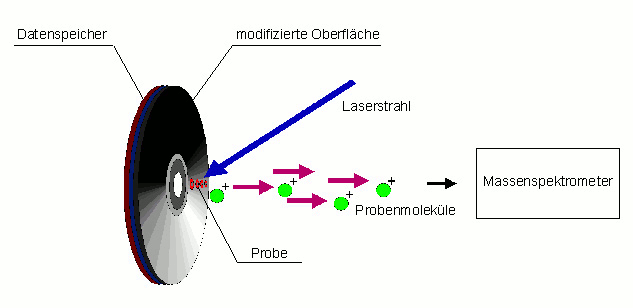
Abbildung 3: Diamantbeschichteter DVD Träger für die Analytik von niedrig konzentrierten Proben. Die DVDs wurden in Kooperation mit der Firma Sony DADC (Anif, Salzburg) entwickelt
Eine weitere Trennmethode wurde im Bereich der Genomforschung für die Mutationsanalytik von Brustkrebs entwickelt. Mutationen des BRCA1-Gens auf Chromosom 17 erhöhen die Wahrscheinlichkeit einer Tumorbildung, insbesondere für Brustkrebs. Frauen mit einer Mutation in einem der Brustkrebs-Gene haben je nach Literaturquelle ein lebenslanges Risiko von 50-80% an Brustkrebs zu erkranken. Diese Gen-Mutationen können in einem an der Innsbrucker Universität entwickelten Verfahren mit Hilfe der denaturierenden Hochleistungsflüssigkeitschromatographie (DHPLC) und einer speziell entwickelten Trennsäule analysiert werden. In der HPLC werden Proben mit Hilfe eines Laufmittels durch eine mit einer stationären Phase (ein organisches Polymer) gefüllten Trennsäule gepumpt. Dabei werden die Substanzen aufgetrennt und anschließend in einem Detektor analysiert. Im konkreten Fall können die mutierten DNA-Fragmente schnell aufgetrennt und die BRCA1-Mutationen festgestellt werden. Diese Information bietet neue Ansätze für eine personalisierte Medizin, die zielgerichtete und individuell auf die Patienten abgestimmte Therapien ermöglicht. Tausende derartiger Analysegeräte sind derzeit weltweit im Einsatz.
Eine weitere moderne Entwicklung im Bereich der Flüssigkeitschromatographie (HPLC) ist der Einsatz neuer selektiver Trennmaterialen, die in hauchdünnen (Durchmesser beträgt 200 Mikrometer) Kapillaren zum Einsatz kommen. Es handelt sich dabei um organische Polymere, sogenannte Monolithen, die sowohl über kleine als auch große Poren verfügen. Mit diesen neuen Materialien können erstmals selektiv kleine und große Biomoleküle gleichzeitig getrennt und identifiziert werden.
Auch auf dem Gebiet der Infrarotspektroskopie wurden in den letzten Jahren in der biowissenschaftlichen Forschung große Fortschritte gemacht. Die Geburtstunde der Infrarotspektroskopie ist eng mit der Entdeckung der Infrarotstrahlung durch Sir William Herschels berühmtes Experiment im Jahr 1809 verknüpft, bei dem das Sonnenlicht mit Hilfe eines Prismas in die verschiedenen Wellenlängenbereiche aufgespalten wurde. In den 50ern des letzen Jahrhunderts wurden schließlich die ersten effizienten Infrarotspektrometer gebaut, welche bereits eine frühe Fingerprintanalytik und Identifizierung von einzelnen Inhaltsstoffen erlaubte, was zu jener Zeit besonders im Bereich der Landwirtschaft von Interesse war.
Heutzutage sind hochentwickelte Infrarotspektrometer, welche im mittleren (400 – 4.000 / cm) und im nahen (4.000 – 12.000 / cm) Infrarotbereich arbeiten erhältlich, deren Leistungsfähigkeit durch Kombination mit chemometrischen Auswerteverfahren durch leistungsstarke Rechner deutlich erhöht wird. Am Institut für Analytische Chemie und Radiochemie konnte die Spektroskopiegruppe unter der Leitung von Prof. Christian Huck bereits existierende Verfahren weiterentwickeln und für die Bereiche Metabolomics, Proteomics und Materialwissenschaft aber auch für pharmazeutische Anwendungen im Bereich der Heilpflanzen (Phytochemie) etablieren.
Abbildung 4: Dreidimensionales infrarotspektroskopisches Abbild der Proteinverteilung in der Brennesselwurzel
Dabei wird auf die Kombination von Trenn- und Anreicherungsverfahren mit infrarotspektroskopischen Methoden gesetzt, was eine deutliche Erhöhung der Selektivität und Sensitivität erlaubt. Diese neuen Methoden ermöglichen eine einfachere und schnellere Identifizierung der zu untersuchenden Spezies, sowie eine präzisere und empfindlichere simultane quantitative Analytik. Durch die Kombination dieser Verfahren mit hochauflösender Mikroskopie kann zudem erstmals die Verteilung von Inhaltsstoffen mit einer Auflösung von bis zu 1.5 µm in 3 Dimensionen erfasst werden. Abbildung 4 zeigt die Verteilung von hochwirksamen Proteinen in einer Brennesselwurzel gemessen mittels Infrarotspektroskopie. Die ständige Entwicklung neuer analytischer Technologien für die biowissenschaftliche Forschung ist vor allem wegen des rasanten Fortschritts auf den Gebieten der Genom- und Proteomforschung von enormer Bedeutung. Der Einsatz derartiger Technologien zeigt auch international hohes Interesse, sodass mittlerweile einige dieser Methoden am Sino-Austrian Biomarker Research Center in China durchgeführt werden, das gemeinsam von den Universitäten Innsbruck und Peking betrieben wird. Die erwähnten Analysemethoden sollen nur als Beispiel für die Bedeutung der Fortschritte auf dem Gebiet der Analytischen Chemie in den Biowissenschaften verstanden werden. Die Erfolge der modernen Biowissenschaften beruhen weitgehend auf der Entwicklung neuer, selektiver und sensitiver Analysemethoden. Diese stellen nicht nur die Grundlage für theoretische wissenschaftliche Forschungen dar, sondern sind auch aus der modernen angewandten medizinischen Forschung und Diagnostik nicht mehr wegzudenken.
Weiterführende Literatur
Rainer M. et al.: Analysis of protein phosphorylation by monolithic extraction columns based on poly(divinylbenzene) containing embedded titanium dioxide and zirconium dioxide nano-powders. Proteomics (2008), 8(21), 4593-4602.
Bonn G. K., Huber C., Oefner P.: Separation of nucleic acid fragments with alkylated nonporous polymer beads. PCT Int. Appl. (1994), 30 pp.
Wagner T. M. et al.: BRCA1-related breast cancer in Austrian breast and ovarian cancer families: specific BRCA1 mutations and pathological characteristics. International journal of cancer. (1998), 77(3), 354-60.
Trojer L. et al.: High capacity organic monoliths for the simultaneous application to biopolymer chromatography and the separation of small molecules. Journal of Chromatography, A (2009), 1216(35), 6303-6309.
Najam-ul-Haq M. et al.: Nanostructured diamond-like carbon on digital versatile disc as a matrix-free target for laser desorption/ionization mass spectrometry. Analytical chemistry (2008), 80(19), 7467-72.
Huck C.W. et al.: Advances of Infrared Spectroscopic Imaging and Mapping Technologies of Plant Material , PLANTA MEDICA 77, 12, 1257-1258 (2011)
Lottspeich F.: Bioanalytik. Spektrum Akademischer Verlag, Auflage: 2. 2006. ISBN-10: 3827415209
Glossar
- Biomarker
- Charakteristische biologische Merkmale, die objektiv gemessen werden können und als Indikator für einen normalen biologischen oder pathologischen Prozess dienen. In der Medizin werden Biomarker zur Erstellung einer Diagnose, Prognose, zum Verfolgen des Krankheitsverlaufs und der Effizienz einer therapeutischen Intervention angewandt (z.B. PSA-Wert bei Prostata-Ca).
- Gaschromatographie (GC)
- Analytische Trennmethode für Substanzgemische, die sich unzersetzt in die Gasphase überführen (verdampfen) lassen. Das gasförmige Gemisch wird mit einem (inertem) Trägergas durch ein sehr langes gebogenes Kapillarrohr geschickt. Je nach ihrem Dampfdruck und den Wechselwirkungen mit dem Trägermaterial der Kapillare erfolgt der Austritt der einzelnen Komponenten zu unterschiedlichen Zeiten und wird mit entsprechenden Detektoren nachgewiesen.
- Hochleistungsflüssigkeitschromatographie (HPLC)
- Analytische Trennmethode mit besonders hohem Trennvermögen bei der ein gelöstes Substanzgemisch auf eine Trennsäule aufgetragen und zusammen mit einem Laufmittel durch die Säule gepumpt wird. Der Austritt der einzelnen Substanzen aus der Säule erfolgt entsprechend der Stärke mit der sie mit dem Material der Säule wechselwirken, der Nachweis mit ensprechenden Detektoren.
- Infrarotspektroskopie (IR-Spektroskopie)
- Analytische Methode der Chemie zur Identifikation, Quantifizierung und Strukturaufklärung von organischen Verbindungen. IR-Spektroskopie beruht auf der Absorption infraroter Strahlung (Wellenlänge 800 nm - 1mm) durch das zu analysierende Molekül; dabei ändern sich dessen Rotations- und Schwingungsenergien.
- Liquor
- Cerebrospinal-Flüssigkeit (= Gehirn-Rückenmarksflüssigkeit: CSF) umfließt das Zentralnervensystem und schützt es gegen Druck und Stöße. Die Zusammensetzung des Liquors ändert sich bei Defekten, wie zB. Entzündungen, Infektionen, Blutungen im ZNS und wird zur Diagnostik herangezogen.
- Massenspektrometrie (MS)
- Methode zur Identifizierung und Strukturaufklärung von Molekülen. Die in die Gasphase überführte Verbindung wird ionisiert und die resultierenden Ionen entsprechend ihres Masse/Ladungs-Verhältnisses (m/z) aufgetrennt und anschließend registriert. Um Substanzgemische aufzutrennen und deren Komponenten zu analysieren, wird der MS häufig eine Trennung durch Gaschromatographie oder Flüssigkeitschromatographie vorgelagert.
- Metabolomics
- Untersuchung der Gesamtheit der biochemischen Stoffwechselprodukte, der an ihrer Entstehung beteiligten Stoffwechselwege (Enzyme) und deren Umsatzraten.
- Printer-friendly version
- Log in to post comments