Den Seuchen auf der Spur: Genetische Untersuchungen zur Geschichte der Krankheitserreger
Den Seuchen auf der Spur: Genetische Untersuchungen zur Geschichte der KrankheitserregerDo, 31.08.2017 - 10:03 — Marcel Keller & Johannes Krause


![]() Das Max-Planck-Institut für Menschheitsgeschichte (Jena) betreibt Grundlagenforschung auf dem Gebiet moderner analytischer Methoden mit dem Ziel einer integrierten Wissenschaft der Menschheitsgeschichte ; es schlägt dabei eine Brücke zwischen den Geschichts- und Naturwissenschaften. Eines der Projekte widmet sich der genetischen Rekonstruktion verschiedener Krankheitserreger vergangener Epochen. Mit innovativen molekularbiologischen Methoden ist es gelungen, aus den sterblichen Überresten von Pestopfern zahlreiche Genome des Pest-Erregers zu entschlüsseln. Die Autoren dieses Essays zeigen auf, wie die Ergebnisse helfen, die Evolution des Pathogens besser zu verstehen und neue Einblicke in die (Vor-)Geschichte zu eröffnen. Weitere Studien untersuchen zum Beispiel den Ursprung der Tuberkulose in der Neuen Welt und die Evolution der Lepra-Erreger.*
Das Max-Planck-Institut für Menschheitsgeschichte (Jena) betreibt Grundlagenforschung auf dem Gebiet moderner analytischer Methoden mit dem Ziel einer integrierten Wissenschaft der Menschheitsgeschichte ; es schlägt dabei eine Brücke zwischen den Geschichts- und Naturwissenschaften. Eines der Projekte widmet sich der genetischen Rekonstruktion verschiedener Krankheitserreger vergangener Epochen. Mit innovativen molekularbiologischen Methoden ist es gelungen, aus den sterblichen Überresten von Pestopfern zahlreiche Genome des Pest-Erregers zu entschlüsseln. Die Autoren dieses Essays zeigen auf, wie die Ergebnisse helfen, die Evolution des Pathogens besser zu verstehen und neue Einblicke in die (Vor-)Geschichte zu eröffnen. Weitere Studien untersuchen zum Beispiel den Ursprung der Tuberkulose in der Neuen Welt und die Evolution der Lepra-Erreger.*
Das menschliche Skelett steht in ständiger Wechselwirkung mit Weichgewebe und Blutkreislauf. Deshalb kann es noch lange nach dem Tod einiges über den Gesundheitszustand des Individuums zu Lebzeiten verraten: Stoffwechselstörungen und Mangelernährung können zu charakteristischen Veränderungen des Knochenaufbaus führen, zum Beispiel Osteoporose oder Rachitis, auch Knochentumore und Metastasen lassen sich gelegentlich identifizieren. Jedoch führen nur wenige Infektionskrankheiten wie etwa Lepra oder eine fortgeschrittene Tuberkulose zu sichtbaren Veränderungen am Skelett.
Für andere Seuchen standen den Anthropologen bis vor etwa 20 Jahren keine Nachweismethoden zur Verfügung. Die teilweise verheerenden Infektionskrankheiten, die der Menschheit vor dem Zeitalter von Antibiotika und Impfungen zusetzten, ließen sich damit nur indirekt fassen – etwa durch Symptombeschreibungen in historischen Quellen oder die Entdeckung von Massengräbern, die nur durch katastrophale Ereignisse erklärt werden können.
 Abbildung 1. Mit Hilfe von DNA-Analysen konnte dieses Massengrab in Ellwangen (Marktplatz) der Pest zugeschrieben werden. © Regierungspräsidium Stuttgart, Abt. 8 Landesamt für Denkmalpflege
Abbildung 1. Mit Hilfe von DNA-Analysen konnte dieses Massengrab in Ellwangen (Marktplatz) der Pest zugeschrieben werden. © Regierungspräsidium Stuttgart, Abt. 8 Landesamt für Denkmalpflege
Paläogenetik: Neuer Blick in die Geschichte des Menschen
Dies änderte sich mit der Entdeckung, dass DNA – also jenes Biomolekül, das für alle Lebewesen den genetischen Bauplan bereitstellt – mitunter über Jahrtausende in Skeletten im Boden überdauern kann. Im Mittelpunkt des Interesses der neuen Disziplin Paläogenetik stand dabei zunächst das Erbgut des Menschen, das in Knochen und Zähnen konserviert bleibt. Der Wissenschaftszweig greift aber noch weiter: Auch Bakterien, die sich bei schweren Infektionen über den Blutkreislauf ausbreiten, lassen sich mit den Methoden der Paläogenetik an archäologischem Skelettmaterial nachweisen. Abbildung 1.
Die Analyse der DNA von Krankheitserregern erlaubt dadurch erstmals die zweifelsfreie Diagnose bakterieller Infektionen in vergangenen Zeiten. Mehr noch: So wie die DNA des Menschen etwas über seine Abstammung und Herkunft verrät, so trägt auch das Erbgut von Bakterien Informationen über deren Vergangenheit. Durch die Rekonstruktion kompletter Genome dieser Mikroorganismen (Abbildung 2) kann heute eine Geschichte der Krankheitserreger nachgezeichnet werden, die ihrerseits ganz eigene Fragen aufwirft, aber auch einen neuen Blick auf die menschliche Historie erlaubt.
 Abbildung 2. Da die Proben nur geringe DNA-Mengen enthalten, ist die Gefahr einer Verunreinigung sehr hoch. Daher müssen alle Proben im Reinraum bearbeitet werden. © Wolfgang Haak, Max-Planck-Institut für Menschheitsgeschichte
Abbildung 2. Da die Proben nur geringe DNA-Mengen enthalten, ist die Gefahr einer Verunreinigung sehr hoch. Daher müssen alle Proben im Reinraum bearbeitet werden. © Wolfgang Haak, Max-Planck-Institut für Menschheitsgeschichte
Beispiel Pest
Rund 300 Jahre nach dem letzten großen Ausbruch gilt die Pest in Europa immer noch als Inbegriff einer Seuche. Beginnend mit dem „Schwarzen Tod“ in den Jahren 1348 bis 1352, der nach Schätzungen die europäische Bevölkerung um ein Drittel dezimierte, flammte die Pest in den folgenden Jahrhunderten immer wieder in einzelnen Regionen und Städten auf, bis sie nach dem letzten großen Ausbruch 1720 bis 1722 in Marseille nach und nach aus Europa verschwand.
Das für die Pest verantwortliche Bakterium Yersinia pestis zirkuliert auch heute noch in einigen Regionen der Welt in wild lebenden Nagetieren und infiziert sporadisch Rattenpopulationen. Durch den Rattenfloh kann es dann auch auf den Menschen übertragen werden. Im menschlichen Körper breitet sich das Bakterium über das Lymphsystem oder den Blutkreislauf aus und manifestiert sich als Beulenpest, septikämische Pest oder Lungenpest. Letztere ist über Tröpfcheninfektion auch direkt von Mensch zu Mensch übertragbar. Während sich die Beulenpest bei etwa 50 Prozent der Infizierten wieder zurückbilden kann, führen die anderen Formen unbehandelt fast immer zum Tod.
Perspektivwechsel: Geschichte aus der Sicht eines Krankheitserregers
Durch die molekularbiologischen Untersuchungen von Pestopfern aus ganz Europa können wir die Geschichte der Pest heute quasi aus der Perspektive des Erregers erzählen. Abbildung 3. So konnte der Vergleich mit den modernen Erregerstämmen aus Nagetierpopulationen in Zentralasien nicht nur die Historiker bestätigen, die den Ursprung des „Schwarzen Todes“ im 14. Jahrhundert in China vermutet haben.
Eine weitere Studie konnte darüber hinaus nachweisen, dass der für die Hong-Kong-Pest und die folgende Pandemie Anfang des 20. Jahrhunderts verantwortliche Erregerstamm von der europäischen Linie abstammt, also nach der Zeit des „Schwarzen Todes“ wieder zurück nach Asien gewandert sein muss. 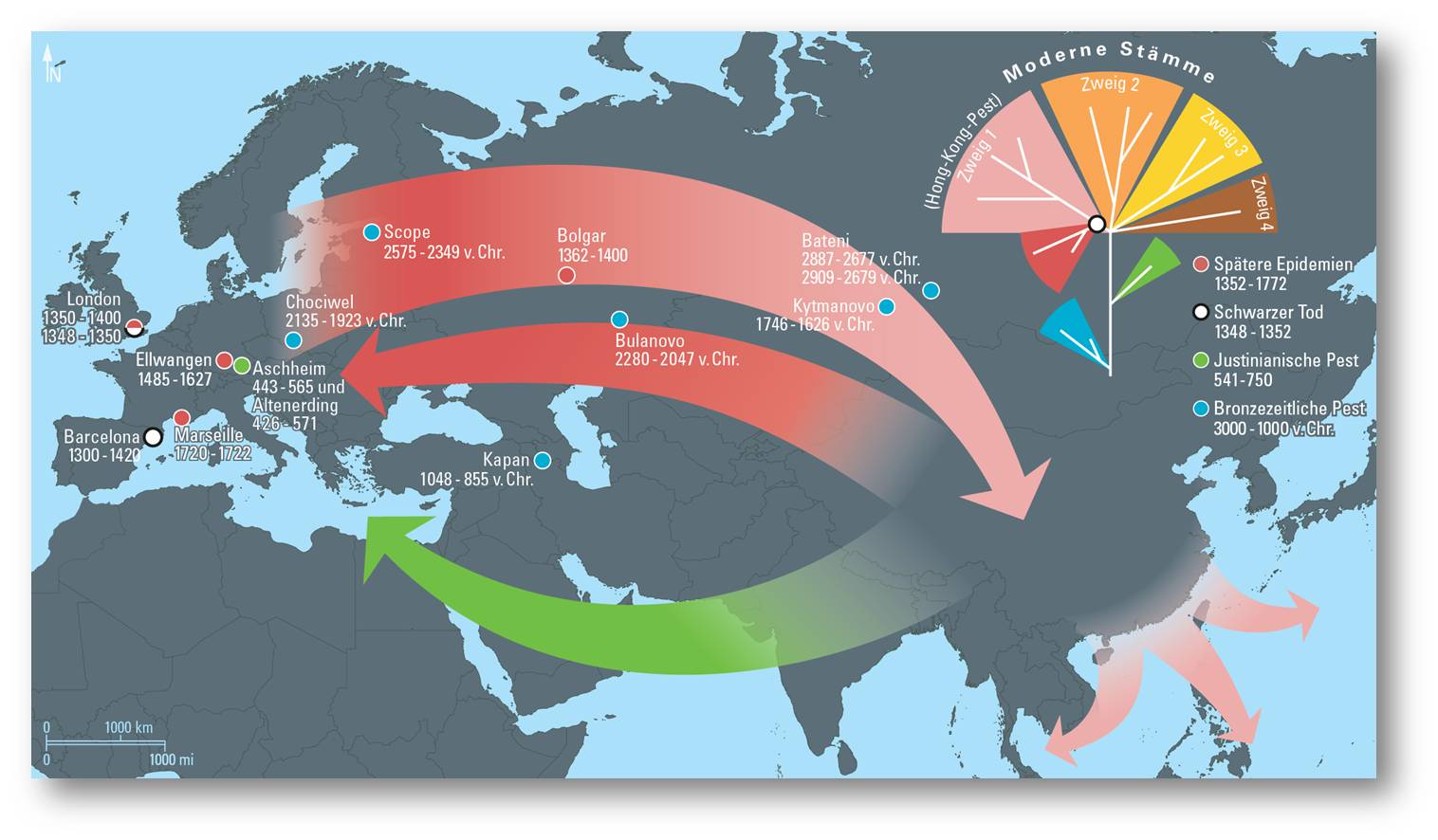
Abbildung 3. Ausbreitungskarte und schematischer Stammbaum des Pest-Erregers. Eingezeichnet sind alle bronzezeitlichen Nachweise sowie die Fundorte der bisher rekonstruierten Genome. © Annette Günzel, Max-Planck-Institut für Menschheitsgeschichte
Die ganze Stärke der Paläogenetik von Krankheitserregern kommt aber erst in der Vor- und Frühgeschichte zum Tragen, wenn nämlich schriftliche Quellen rar sind oder gänzlich fehlen. Das ist beispielsweise für die „Justinianische Pest“ der Fall, die zur Zeit des spätantiken Kaisers Justinian im Jahr 541 n. Chr. wütete. Während aus dem zerfallenden weströmischen und dem byzantinischen Reich zahlreiche zeitgenössische Berichte überliefert sind, verstummen die Quellen jenseits der Grenzen des römischen Reiches. Umso überraschender war schließlich der Nachweis des Pest-Erregers in merowingischen Gräberfeldern aus dem 6. Jahrhundert im heutigen Bayern, der nicht nur die bereits vermutete Identität des Erregers bestätigte, sondern auch den Beweis lieferte, dass die Pest bereits damals die Alpen überquert hatte. Vergleichende Analysen zeigten außerdem, dass diese erste historisch bezeugte Pestpandemie – unabhängig von der zweiten im Spätmittelalter – bereits ihren Ursprung im Fernen Osten hatte.
Blick in die Vorgeschichte
Völlig unerwartet war schließlich auch der Nachweis der Pest in bronzezeitlichen Gräbern von Osteuropa bis ins Altaigebirge. Anders als bei den späteren Pandemien handelte es sich hier jedoch um eine bis dato unbekannte „Urform“ der Pest, die zwar schon eine tödliche Sepsis auslösen konnte, aber vermutlich weder die charakteristischen Lymphknotenschwellungen der Beulenpest verursachte, noch an die effiziente Übertragung durch den Rattenfloh angepasst war. Die Rekonstruktion dieser jahrtausendealten Genome liefert somit Momentaufnahmen aus der Evolution eines vergleichsweise harmlosen Darmkeims zu einem der gefürchtetsten Erreger der Menschheitsgeschichte.
Tuberkulose und Lepra
Auch chronisch verlaufende Infektionskrankheiten wie Tuberkulose, verursacht durch Mycobacterium tuberculosis, können ihren genetischen Fingerabdruck im menschlichen Skelett hinterlassen. So wiesen Analysen an Skelettresten aus der präkolumbischen Neuen Welt nach, dass dort, noch bevor die Europäer Amerika erreicht hatten, Tuberkulosestämme von infizierten Tieren auf den Menschen übergesprungen waren. Andere Studien beschäftigten sich mit den Erregern der Lepra, Mycobacterium leprae und Mycobacterium lepromatosis. Die Infektionskrankheit Lepra verschwand in der Frühen Neuzeit langsam aus Europa, fordert aber in Entwicklungsländern bis heute Opfer. Den modernen Methoden der Genomsequenzierung kommt hier besondere Bedeutung auch für die klinische Forschung zu, da sich die Erreger der Lepra nicht im Labor kultivieren lassen.
Die Ergebnisse dieser Arbeiten revidierten die bisherigen Annahmen zur Evolution dieser Erreger, indem sie zeigen konnten, dass sich beide Pathogene erst in den letzten Jahrtausenden in der menschlichen Population verbreitet haben.
Gletschermumie mit Magenkeim
Das Bakterium Helicobacter pylori ist an die Lebensbedingungen im Magen angepasst und findet sich heute bei der Hälfte aller Menschen. Unter ungünstigen Bedingungen kann es Magengeschwüre und Krebs hervorrufen. Die Archäogenetiker am Max-Planck-Institut für Menschheitsgeschichte waren maßgeblich an der Entschlüsselung des Gastritis-Erregers Helicobacter pylori aus der 5.300 Jahre alten Gletschermumie Ötzi beteiligt. Es handelt sich um den derzeit ältesten Beleg des Bakteriums und dieser unterstützt die Theorie, dass der Mensch schon früh in seiner Geschichte mit dem Bakterium infiziert war, das erst vor etwa 30 Jahren als Verursacher von Magengeschwüren entdeckt wurde. Überraschenderweise ergab der Vergleich mit heutigen Helicobacter-pylori-Bakterien, dass der Stamm aus der Gletschermumie fast vollständig mit asiatischen und nicht mit europäischen Stämmen übereinstimmt. Dieses Ergebnis wirft neue Fragen zu den frühen Wanderungsbewegungen der Menschen in Europa auf.
Literaturhinweise
(bis auf 4. frei zugänglich)
1. Spyrou, M. A.; Tukhbatova, R. I.; Feldman, M.; Drath, J.; Kacki, S.; Beltrán de Heredia, J.; […] Krause, J. Historical Y. pestis Genomes Reveal the European Black Death as the Source of Ancient and Modern Plague Pandemics. Cell Host & Microbe 19 (6), 874–881 (2016). https://doi.org/10.1016/j.chom.2016.05.012
2. Bos, K. I.; Herbig, A.; Sahl, J.; Waglechner, N.; Fourment, M.; Forrest, S. A.; […] Krause, J.; Poinar, H. N. Eighteenth century Yersinia pestis genomes reveal the long-term persistence of an historical plague focus. eLife 5 (11), 949–955 (2016, published online). https://doi.org/10.7554/eLife.12994.002
3. Feldman, M.; Harbeck, M.; Keller, M.; Spyrou, M. A.; Rott, A.; Trautmann, B.; […] Krause, J. A High-Coverage Yersinia pestis Genome from a Sixth-Century Justinianic Plague Victim. Molecular Biology and Evolution 33 (11), 2911–2923 (2016). https://doi.org/10.1093/molbev/msw170
4. Bos, K. I.; Harkins, K. M.; Herbig, A.; Coscolla, M.; Weber, N.; Comas, I.; […] Krause, J. Pre-Columbian mycobacterial genomes reveal seals as a source of New World human tuberculosis. Nature 514 (7523), 494–497 (2014)
5. Singh, P.; Benjak, A.; Schuenemann, V. J.; Herbig, A.; Avanzi, C.; Busso, P.; […] Cole, S. T. Insight into the evolution and origin of leprosy bacilli from the genome sequence of Mycobacterium lepromatosis. Proceedings of the National Academy of Sciences 112 (14), 4459–4464 (2015). http://www.pnas.org/content/112/14/4459
6. Mendum, T. A., Schuenemann, V. J.; Roffey, S.; Taylor, G.; Wu, H.; Singh, P.; […] Stewart, G. R. Mycobacterium leprae genomes from a British medieval leprosy hospital: Towards understanding an ancient epidemic.BMC Genomics 15 (1), 270 (2014). https://bmcgenomics.biomedcentral.com/articles/10.1186/1471-2164-15-270
7. Schuenemann, V. J.; Singh, P.; Mendum, T. A.; Krause-Kyora, B.; Jäger, G.; Bos, K. I.; […] Krause, J. Genome-Wide Comparison of Medieval and Modern Mycobacterium leprae. Science 341 (6142), 179–183 (2013). http://science.sciencemag.org/content/341/6142/179
8. Maixner, F.; Krause-Kyora, B.; Turaev, D.; Herbig, A.; Hoopmann, M. R.; Hallows, J. L.; […] Zink, A.The 5300-year-old Helicobacter pylori genome of the Iceman. Science 351 (6269), 162–165 (2016). http://science.sciencemag.org/content/351/6269/162
* Der Artikel ist unter demselben Titel: "Den Seuchen auf der Spur: Genetische Untersuchungen zur Geschichte der Krankheitserreger" im Jahrbuch der Max-Planck-Gesellschaft 2017 erschienen und wurde mit freundlicher Zustimmung der Autoren und der MPG-Pressestelle ScienceBlog.at zur Verfügung gestellt. Der Artikel erscheint ungekürzt.
Weiterführende Links
Das Max-Planck-Institut für Menschheitsgeschichte in Jena wurde 2014 gegründet, um grundlegende Fragen der menschlichen Evolution und Geschichte seit der Steinzeit zu erforschen. Mit seinen drei interdisziplinären Abteilungen – der Abteilung für Archäogenetik (Direktor Johannes Krause), der Abteilung für Archäologie (Direktorin Nicole Boivin) sowie der Abteilung für Sprach- und Kulturevolution (Direktor Russell Gray) – verfolgt das Institut eine dezidiert integrierende Wissenschaft der Menschheitsgeschichte, die den traditionellen Graben zwischen Natur- und Geisteswissenschaften überwindet.
Projekte der Abteilung für Archäogenetik: u..a..
- Mittelalterliches Lepra-Genom-Projekt: https://www.shh.mpg.de/31729/medieval_leprosy_genome_project
- Frühe Tuberkuloseformen in der Neuen Welt und darüber hinaus https://www.shh.mpg.de/32987/pre-columbian_tuberculosis
- Evolution and Ecology of the Human Gut Microbiome https://www.shh.mpg.de/372095/Evolution-and-Ecology-of-the-Human-Gut-Microbiome
Videos & Interviews Ancient DNA and Human Evolution – Johannes Krause: Ancient European Population History. Video 22:47 min. Johannes Krause (Max Planck Institute for the Science of Human History) and his research team analyzed more than 200 ancient human genomes spanning the last 10,000 years of Western Eurasian pre-history. They found direct evidence for two major genetic turnover events at the beginning and at the end of the Neolithic time period in Europe, which they attribute to two major migrations (Standard Youtube license)
Das Geheimnis des Schwarzen Tods. Video 5:20 min. (Standard Youtube license)
Johannes Krause: Dunkle Haut - blaue Augen. dctp.tv - April 2017. Video 44 min.
Johannes Krause: Der Europäer ist auch genetisch ein Potpourri.
Johannes Krause im Gespräch mit Korbinian Frenzel (12.8.2016): "Zum Großteil stammen unsere Gene aus Afrika"