Menschliche Avatare auf Silikonchips - ersetzen sie Tierversuche in der Arzneimittel-Entwicklung?
Menschliche Avatare auf Silikonchips - ersetzen sie Tierversuche in der Arzneimittel-Entwicklung?Sa 04.03.2023 — Inge Schuster

![]() Ende Dezember 2022 hat der US-amerikanische Präsident ein Gesetz unterzeichnet, das die Zulassung neuer Medikamente ohne die bislang erforderlichen, aufwändigen Tierversuche ermöglicht. An deren Stelle können human-relevante alternative Methoden, wie menschliche Miniorgane - sogenannte Organoide -, Multiorganchips menschlicher Zellen und Computermodelle treten, sofern diese validierte Verfahren zum Nachweis von Wirksamkeit und Toxizität sind.
Ende Dezember 2022 hat der US-amerikanische Präsident ein Gesetz unterzeichnet, das die Zulassung neuer Medikamente ohne die bislang erforderlichen, aufwändigen Tierversuche ermöglicht. An deren Stelle können human-relevante alternative Methoden, wie menschliche Miniorgane - sogenannte Organoide -, Multiorganchips menschlicher Zellen und Computermodelle treten, sofern diese validierte Verfahren zum Nachweis von Wirksamkeit und Toxizität sind.
Seit Beginn des 20. Jahrhunderts haben wir einen beispiellosen Boom von neuen wirksamen Medikamenten erlebt. Gab es anfangs erst wenige Arzneistoffe (das sind die aktiven Wirkstoffe in Medikamenten), die diese Bezeichnung heute noch verdienen - etwa die aus Heilpflanzen aufgereinigten Naturstoffe Chinin oder Morphin oder chemisch modifizierte Naturstoffe wie Aspirin oder Pyramidon -, so halten wir nun bereits bei rund 15 000 Wirkstoffen (https://go.drugbank.com/stats). Die neuen, gegen verschiedenste Krankheiten wirksamen Medikamente haben uns Menschen (zumindest in der westlichen Welt) zu einer erhöhten Lebensqualität und fast zu einer Verdoppelung der Lebenszeit seit 1900 verholfen. Ursprünglich aus Apotheken und Farbstoffchemie entstanden, hatte die Pharmaindustrie alleVoraussetzungen für interdisziplinäre Forschung an der Schnittstelle von Medizin, Biowissenschaften, Chemie und Gesundheitsfürsorge. Ihre spektakulären Erfolge machten sie zu einem zentralen Player im globalen Gesundheitssystem und zu einem der umsatzstärksten Industriezweige; aktuell wird der der globale Umsatz auf rund 1 200 Milliarden US $ (49,1 % davon in Nordamerika) geschätzt.
Die Entwicklung der Pharmasparte ist alledings nicht ohne größere Pannen und Katastrophen verlaufen und hat in Folge zu einem streng regulierten und kontrollierten Prozess der Arzneimittel-Forschung und Entwicklung geführt.
Versuchstiere werden in der Arzneimittelentwicklung vorgeschrieben
Bis in die 1930er Jahre brauchte man für den Kauf von Medikamenten meistens noch kein Rezept und die Formulierungen wurden zumeist in der Apotheke nach den Angaben in den Arzneibüchern (Pharmakopöen) zusammengemischt. Nur in wenigen Staaten gab es bereits Behörden für die Zulassung neuer Arzneimittel; diese hatten aber kaum Befugnisse, um übertriebene Werbung zu untersagen und in die Medikamentenentwicklung einzugreifen.
1937 änderte sich die Situation, als in den USA die Antibiotika-Bereitung Elixir-Sulfanilamid Massenvergiftungen hervorrief und mehr als hundert Menschen starben . Unter den Toten waren viele Kinder, die den nach Himbeeren schmeckenden aber das hochtoxische Lösungsmittel Diethylenglykol enthaltenden "Erkältungssaft" geschluckt hatten. In Folge erließ der US-Kongress 1938 Gesetze (Federal Food, Drug, and Cosmetic Act), welche die Qualität der pharmazeutischen Bereitungen garantieren sollten und positiv verlaufende Sicherheitstests an Tieren vorschrieben, bevor neue Medikamente auf den Markt kommen durften; darüber hinaus erhielt die Arzneimittelbehörde der Vereinigten Staaten (FDA) weitreichende Befugnisse in den Forschungs-und Entwicklungsprozess von Arzneimitteln einzugreifen. Andere Länder schlossen sich diesen Regulierungen an.
Noch immer gab es keine obligatorischen Untersuchungen zur Wirksamkeit eines neuen Medikaments. Dazu wurden die Pharmaunternehmen erst 1962, nach dem Contergan-Skandal verpflichtet. Das Medikament war zwischen 1957 und 1961 schwangeren Frauen als Beruhigungs- und Schlafmittel empfohlen worden und hatte bei vermutlich mehr als 10 000 Neugeborenen zu schweren Missbildungen von Gliedmaßen und Organen geführt. Das US-Gesetz von 1938 wurde nun erweitert: alle Arzneimittel mussten sowohl wirksam als auch (in vertretbarem Ausmaß) sicher sein; Zulassungsanträge an die FDA mussten die Wirksamkeit im Tierversuch nachweisen und alle bei den Tests aufgetretenen Nebenwirkungen offenlegen. Ein spezielles Programm untersuchte diesbezüglich auch alle vor 1962 zugelassenen Medikamente - von 3 443 Produkten haben sich fast ein Drittel (1051) als unwirksam erwiesen!
Seit den 1960er Jahren wurden die erforderlichen Protokolle für die präklinischen Wirksamkeits- und Toxizitätstest und für die folgenden klinischen Studien weiter entwickelt und haben zu einem immer länger (und damit teurer) werdenden und stärker regulierten Forschungs- und Entwicklungsprozess geführt. Der heute geltende, aus mehreren aufeinanderfolgenden Phasen zusammengesetzte Prozess soll hier kurz dargestellt werden:
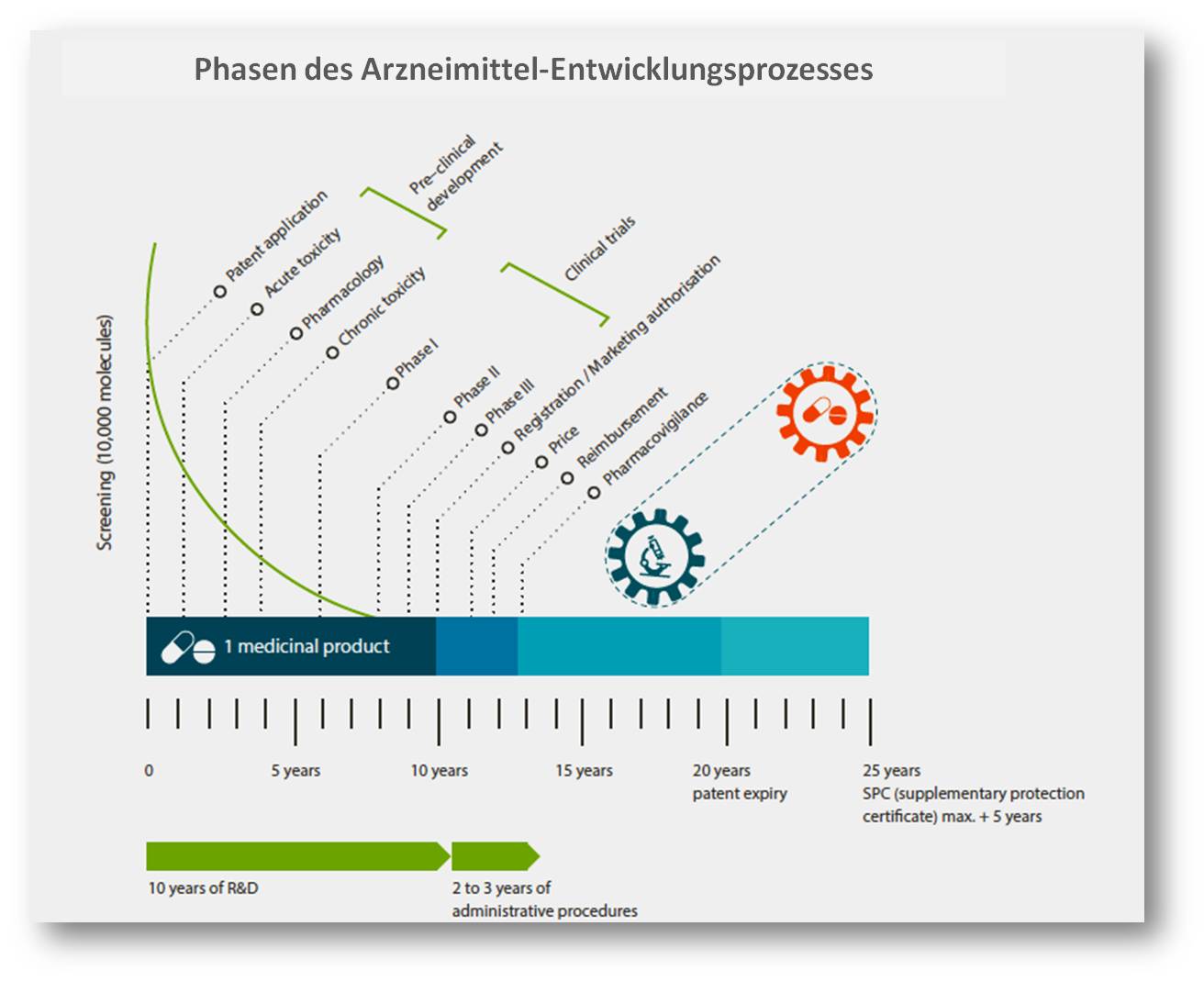
Der Prozess beginnt im Labor mit der Forschung nach den möglichen Ursachen einer Erkrankung und der Suche nach Molekülen , mit denen diese Ursachen beeinflusst werden können. Gelingt es derartige Substanzen zu identifizieren und sind diese patentierbar, so kann die erfolgversprechendste davon in die präklinische Entwicklung eintreten und falls sie diese übersteht, zur Prüfung am Menschen in 3 Phasen zugelassen werden; in Phase 1 erfolgt die Prüfung an einer kleineren Gruppe (20 -100) junger, gesunder Freiwilliger, in Phase 2 sind bis zu mehreren Hundert Patienten involviert, in Phase 3 bis zu mehreren Tausend Patienten. Abbildung 1. Vom Beginn der präklinischen Entwicklung an dauert es im Mittel rund 10 Jahre bis für einen erfolgreichen Arzneimittel-Kandidaten die Unterlagen zur Registrierung eingereicht werden können (Abbildung 1).
| Abbildung 1. . Aktuelles Schema des Arzneimittel-Entwicklungsprozesses ab der Identifizierung eines patentierbaren Entwicklungskandidaten und Zeitdauer der präklinischen Phasen zur Prüfung von Toxizität und Wirksamkeit (Pharmakologie) und der 3 klinischen Phasen der Untersuchungen am Menschen. (Quelle: efpia: The Pharmaceutical Industry in Figures, Key data 2022. www.efpia.eu). |
Zur präklinischen Prüfung
der Wirksamkeit dienen Tiermodelle, in denen die zu behandelnde menschliche Krankheit nachgebildet wurde, d.i. ähnliche Symptome wie beim Erkrankten hervorgerufen werden (ein nicht immer erfolgversprechender Ansatz). Um eine Vorauswahl unter mehreren potentiellen Entwicklungskandidaten zu treffen, werden in verstärktem Ausmaß auch aus menschlichen Zellen erzeugte in vitro-Modelle eingesetzt.
der Sicherheit, d.i. fehlender/tolerierbarer Toxizität, sind Untersuchungen an jeweils zwei Spezies, einem Nager - meistens Ratte oder Maus - und einem Nichtnager - zumeist dem Hund - vorgeschrieben. Je nach Dauer der geplanten Anwendung einer neuen Substanz umfassen die Toxizitätstests Untersuchungen mit einmaliger (akute Toxizität) und wiederholter subchronischer und chronischer Verabreichung, weiters Reproduktionstests und Genotoxizitätstests bis hin zu lebenslangen (d.i. bei Ratten rund 2 Jahre dauernden) Cancerogenitätstests. Auch hier wird die Vorauswahl unter mehreren potentiellen Entwicklungskandidaten häufig an Hand von in vitro-Modellen getroffen.
Bei Verwendung statistisch ausreichend großer Gruppen in den verschiedenen Dosierungen kann die Anzahl der dazu erforderlichen männlichen und weiblichen Tiere bis auf über 3000 steigen. Dazu kommen noch Hunderte Tiere für Studien zur Pharmakokinetik (sogenannte ADME-Studien) - d.i. zur Quantifizierung der Aufnahme (A) eines Wirkstoffs in den Organismus, seiner Verteilung (D) und seinem Metabolismus (M) im Organismus und seiner Ausscheidung (E) - und zur Pharmakodynamik, d.i. zu den Effekten eines Wirkstoffs auf den geplanten Wirkort. Hinsichtlich pharmakokinetischer Eigenschaften haben in vitro Modelle aus menschlichen Zellen eine hohe Vorhersagekraft und können das Scheitern diesbezüglich ungeeigneter Verbindungen in der Klinik verhindern (siehe unten).
.. und der klinischen Prüfung
Wenngleich der Aufwand für Tierversuche und die damit verbundenen Kosten auch enorm hoch sind, ist es ein leider millionenfach bestätigtes Faktum, dass Versuchstiere zwar in ähnlicher, nicht jedoch in derselben Weise auf Wirkstoffe reagieren und damit umgehen wie wir Menschen. Wenn neue Wirkstoff-Kandidaten nach erfolgreicher Testung an Tieren in die klinische Prüfung am Menschen eintreten dürfen - d.i. rund 6 Jahre nach Beginn der Entwicklung , so scheitern dort bis zu 95 % - hauptsächlich wegen geringer/fehlender Wirksamkeit und/oder nicht tolerierbaren Nebenwirkungen. Die meisten fallen in der zweiten klinischen Phase durch, der Phase in der erstmals an Patienten geprüft wird - bis dahin sind 8 - 9 Jahre vergangen und rund ein Drittel der Gesamtkosten von bis zu mehreren Milliarden US $ angefallen.
Bis in die 90er-Jahre sind bis zu 40 % der Substanzen in der Klinik wegen unbefriedigenden pharmakokinetischen (ADME) Eigenschaften gescheitert: Viele oral verabreichte Arzneistoffe wurden aus dem Magen-Darmtrakt viel schlechter aufgenommen als aus dem Tierversuch zu erwarten war und erwiesen sich auf Grund der zu niedrigen Konzentrationen im Organismus dann als unwirksam. Viele Substanzen wurden im menschlichen Körper viel schneller/ viel langsamer abgebaut als im Tier und waren dann im ersten Fall unwirksam oder zeigten auf Grund zu hoher, langlebiger Konzentrationen im zweiten Fall schwerwiegende Nebenwirkungen. Mit der Verfügbarkeit von aus menschlichen Darmzellen bestehenden Resorptionsmodellen und aus menschlichen Leberzellen erzeugten Metabolismus-Modellen scheitern heute nur mehr wenige Prozent der Substanzen wegen ungünstigen ADME Eigenschaften.
Tierschützer wie auch einige Pharmaunternehmer sehen Tierversuche als eine Vergeudung von Leben, Kosten und Zeit und drängen darauf das veraltete System der wenig treffsicheren Tierversuche durch alternative humanbasierte Testverfahren zu ersetzen.
Reichen die derzeitig verfügbaren Moodelle aber dazu aus?
Die US-Arzneimittelbehörde FDA besteht nicht mehr auf Tierversuchen
Ende Dezember 2022 hat der amerikanische Präsident Biden den FDA Modernization Act 2.0 als Gesetz unterzeichnet. Mit diesem Gesetz, das auch den Reducing Animal Testing Act enthält, wird die überholte, aus den Jahren 1938 und 1962 stammende FDA-Vorschrift abgeschafft, wonach Arzneimittel-Kandidaten an Tieren getestet werden müssen, bevor sie in klinischen Studien am Menschen eingesetzt werden. In anderen Worten: Anträge zur Zulassung zu klinischen Studien können nun auf Basis tierversuchsfreier Verfahren akzeptiert werden.
Das Gesetz sieht allerdings kein vollständiges Verbot von Tierversuchen in der Entwicklung von Arzneimitteln vor; vielmehr ermöglicht es die Anwendung human-relevanter alternativer Methoden, sofern dies realisierbar ist. Als Beispiel dient hier ein von der Firma Hesperos Inc. (Florida) und Kollegen entwickeltes Neuropathie-Krankheitsmodell, das - aus induzierten pluripotenten Stammzellen und Schwannschen Zellen aufgebaut - in einem mikrofluiden System (siehe unten) eingesetzt wurde. In diesem Modell normalisierte die Behandlung mit speziellen Antikörpern (von Sanofi) die neuronale Funktion; die FDA akzeptierte dies als Nachweis der Wirksamkeit und gestattete, mit der klinischen Prüfung zu beginnen.
Auf der Humanbiologie basierende alternative Methoden
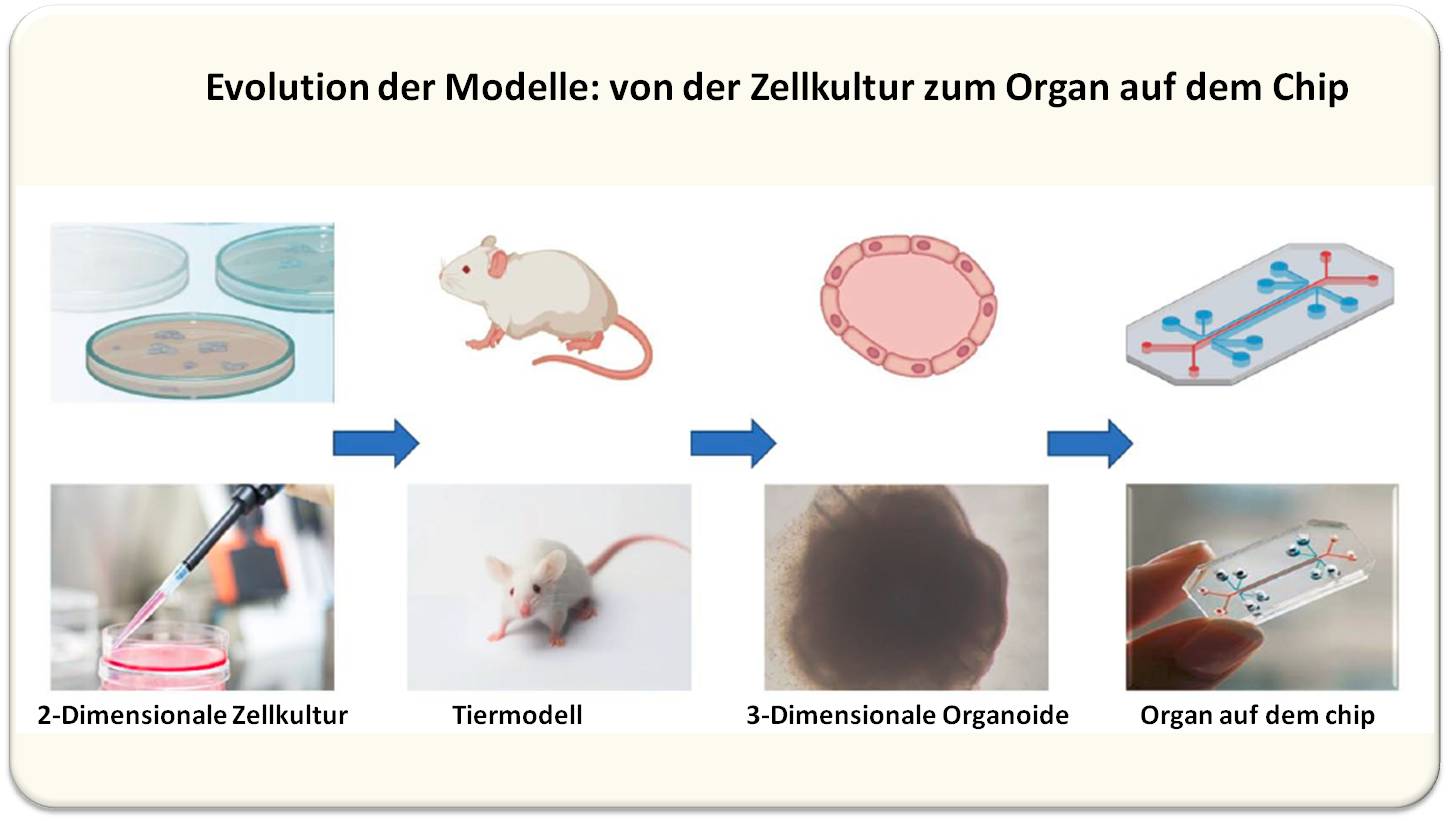
sind in den letzten 10 Jahren in der akademischen Forschung, in Biotech-Unternehmen und auch in behördlichen Forschungseinrichtungen in zunehmendem Maße entwickelt worden. Es sind dies zellbasierte in vitro Assays (Abbildung 2). Nach den 2-dimensionalen Zellkulturen, wie sie bereits seit Jahrzehnten angewandt werden, liegt nun der Fokus auf
- Organoiden - aus pluripotenten Stammzellen gezüchtete Gruppen unterschiedlicher Zelltypen eines Organs, die sich selbst zu 3-dimensionalen hohlen Mikrostrukturen organisieren, die dem Organ im Aufbau und Funktion ähneln (beispielsweise Mikrohirne) - und
- "Organ-on-a-Chip" - mikrophysiologischen Systemen, bei denen Organoid-ähnliche Kokulturen in mikrofluide Chips eingebettet sind.
Ausgangsmaterial dieser Assays sind aus verschiedenen Organen entnommene primäre menschliche Zellen und Biopsien, menschliche Zelllinien und adulte, embryonale und induzierte pluripotente Stammzellen.
| Abbildung 2. . Wesentliche Modelle in der Arzneimittelforschung und Entwicklung. Beschreibung: siehe Text. Abbildung modifiziert nach [1] Liancao Jiang et al., Bioengineering2022. https://www.mdpi.com/2306-5354/9/11/685 (Lizenz: cc-by) |
"Organ-on-a-Chip"
ist eine bereits fortgeschrittene Technologie mit einem ungeheuer breiten Spektrum an biologischen und biomedizinischen Anwendungsmöglichkeiten, die von Grundlagenforschung bis zu Personalisierter Medizin reichen [2].
Das Kernstück ist ein durchsichtiger, flexibler Chip aus einem Kunststoff auf Silikonbasis , der die Größe eines USB-Memory Sticks hat (Abbildung 2: ganz rechts) und ein Organ oder auch ein Organsystem nachahmen soll: Der Chip ist von hohlen mikrofluiden Kanälen durchzogen, die durch eine poröse Membran in zwei Kompartimente geteilt sind. Auf dieser Membran ordnen sich die Zellen eines bestimmten Organs organoid-ähnlich an, das angrenzende Kompartiment simuliert die funktionsbestimmende Umgebung des Organs - beispielsweise das Lumen des Darms. Das andere Kompartiment wird von Flüssigkeiten (Blutersatz) durchströmt; es kommen ihm - wie den Blutkapillaren im Gewebe - die mikrofluide Versorgung mit Nährstoffen und Entsorgung von Stoffwechselprodukten der Gewebezellen zu und es grenzt sich von diesen auch durch Endothelzellen ab.
Das durchsichtige Material ermöglicht morphologische Veränderungen kontinuierlich mikroskopisch zu verfolgen, in der ausströmenden Flüssigkeit können (biochemische) Indikatoren für diverse physiologische und pathologische Vorgänge (u.a. Wirkungsmechanismen und toxische Nebenwirkungen) gemessen werden.
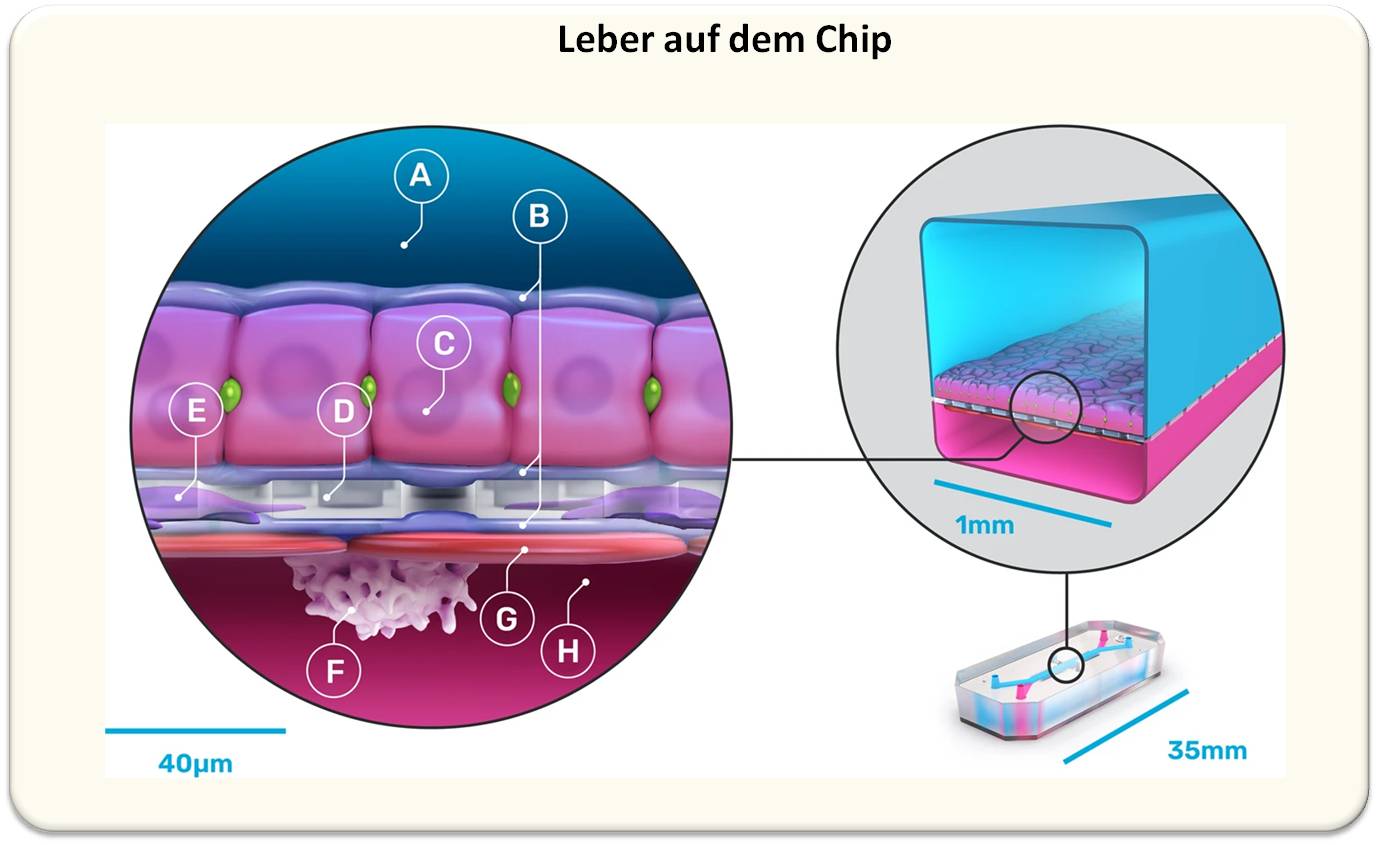
Die Leber als zentrales Organ im Abbau von Fremdstoffen - u.a. den Medikamenten - ist häufig von deren toxischen Nebenwirkungen betroffen. Abbildung 3 illustriert das Design der "Leber auf dem Chip", das zu einem essentiellen Modell in der Pharmaentwicklung werden kann.
Eine kürzlich erschienene Untersuchung hat diesem Lebermodell ein hohes Potential für die korrekte Vorhersage von Leber-toxischen Substanzen bescheinigt. In einem verblindeten Set von 27 bekannten Leber-toxischen und untoxischen Verbindungen erkannten die Chips 87 % der toxischen Substanzen richtig und keine der untoxischen Substanzen als toxisch [3].
| Abbildung 3 . Schematische Darstellung eines "Leber auf dem Chip" Modells. Das Modell enthält alle wesentlichen Zelltypen der menschlichen Leber in der für das Organ charakteristischen Anordnung:. Die typischen Leberzellen (C; Hepatozyten) sitzen begrenzt von extrazellulärer Matrix (B) auf einer porösen Membran (D) innerhalb des oberen Kanals (A; blau). Der untere, dem Blutgefäß entsprechende (vaskuläre) Kanal (H; rot) wird von Endothelzellen ausgekleidet (G), die Fett und Vitamin A speichernden Sternzellen (E) sind im Raum zwischen Hepatozyten und Endothel angesiedelt, die Kupferzellen - Makrophagen oder Fresszellen - der Leber (F) im Gefäßraum. (Bild aus [1]: Lorna Ewart et al., Communications Medicine, 2022. https://doi.org/10.1038/s43856-022-00209-1 (Lizenz: cc-by) |
Das Tissue Chip for Drug Screening Programm
Initiative der NIH und FDA
Mit dem Ziel Sicherheit und Wirksamkeit von Arzneimittelkandidaten besser vorherzusagen zu können, haben die US-National Institutes of Health (NIH) gemeinsam mit der FDA bereits 2012 das Programm "Tissue Chip for Drug Screening" (Gewebechips für das Arzneistoffscreening) ins Leben gerufen [4]. Die Förderungen galten vorerst der Entwicklung von 3-D-Chips aus menschlichem Gewebe, die die Struktur und Funktion menschlicher Organe genau nachahmten.
2014 schlossen sich Forscher zusammen, um einzelne "Organs-on-a-Chip" zu einem Multiorgan Modell zu entwickeln, das nun auch die Wechselwirkungen zwischen den Organen berücksichtigen sollte (beispielsweise wurden Pharmakokinetik-Modelle entwickelt, die alle Aspekte von Aufnahme, Verteilung, Abbau und Eliminierung eine Arzneimittels erfassen konnten) .2016/2017 begannen die NIH Projekte zu fördern, die Chips zur Modellierung von Krankheiten und Testung der Wirksamkeit von Behandlungen designten. Es folgte die Förderung von Modellen für Schmerz und Opioidabhängigkeit und von Ansätzen zur Modellierung des Immunsystems.
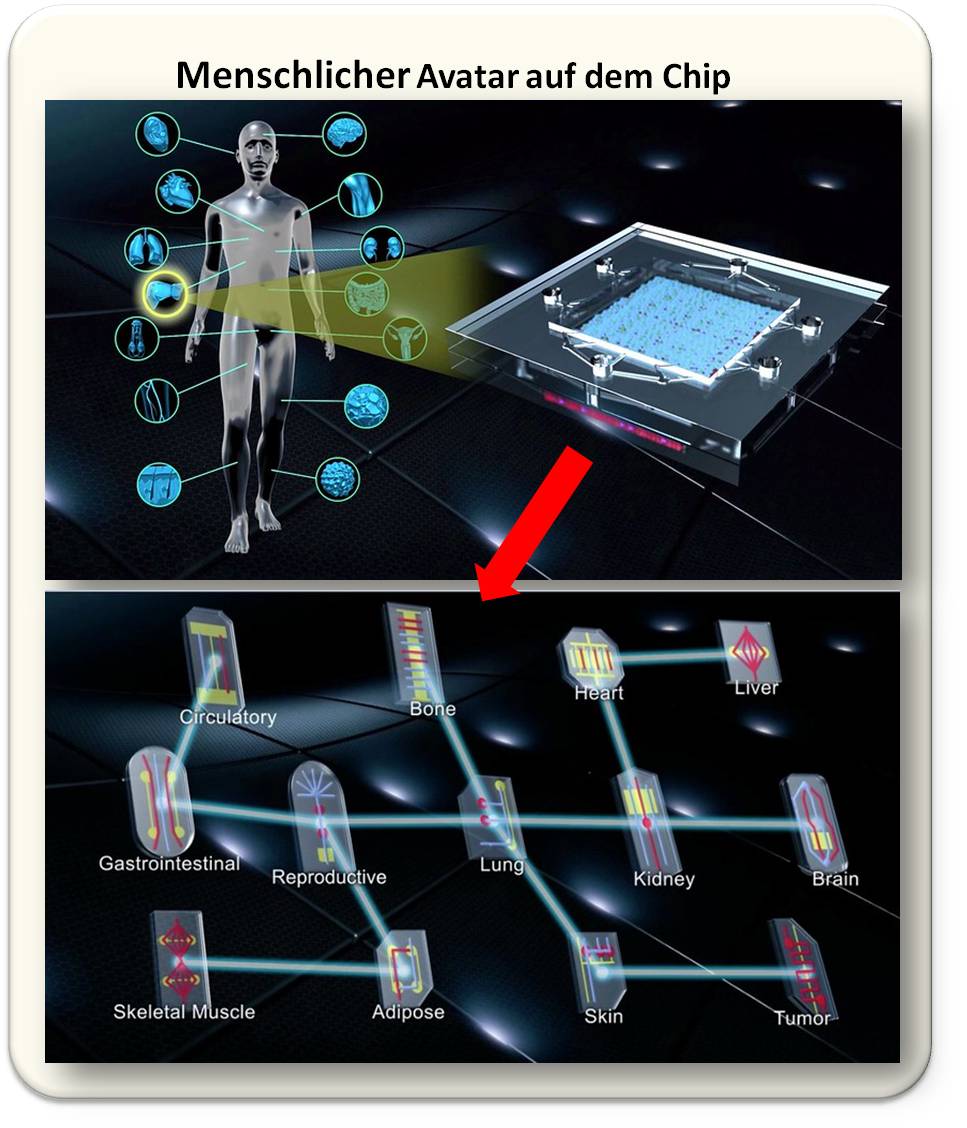
Schlussendlich sollen alle wesentlichen Organe zu einem "Human-Body-on- a Chip" also einem menschlichen Avatar vernetzt werden. Abbildung 4.
| Abbildung 4. . Zukunftsmusik: Wesentliche "Organs-on-a-Chip" werden zu einem System zusammengeschlossen, das den "Human Body on a Chip simuliert.(Bild: NIH, National Center for Advancing Translational Sciences; Lizenz: gemeinfrei). |
Das Budget der FDA unterstützt ein FDA-weites Programm, um diese alternativen Methoden zu evaluieren. Die Forscher wollen damit einerseits die humanspezifische Physiologie von Geweben oder Organen modellieren, anderseits Methoden für regulatorische Zwecke vorantreiben, welche die Effizienz der Arzneimittelentwicklung erhöhen und Tierversuche ersetzen, reduzieren und verbessern ("replace, reduce, refine") können.
Können die derzeitigen alternativen Methoden bereits Tierversuche ersetzen?
Ein beträchtlicher Teil der bis jetzt entwickelten Modelle kann sicherlich in frühen Entwicklungsphase von Arzneistoffen zur sogenannten Leadoptimierung eingesetzt werden, d.i. wenn aus mehreren möglichen Kandidaten die erfolgversprechendste Verbindung in puncto Sicherheit und möglicherweise auch Wirksamkeit ausgewählt werden soll.
Das Lebermodell kann frühzeitig Lebertoxizität feststellen, das Multiorgan-Modell der Pharmakokinetik erlaubt konkrete Prognosen über Verfügbarkeit, Spiegel , Metabolisierung und Verweildauer neuer Substanzen im Organismus. Das reduziert die Entwicklungszeit, die Zahl der Versuchstiere und die Kosten.
Allerdings spiegeln die bis jetzt entwickelten alternativen Modelle die komplexe pharmakologische Situation unseres Körpers nur bedingt wider. Toxizitäten können auch in Organen auftreten, die von den Testsystemen nicht erfasst werden, die Rolle des Immunsystems wird in den Modellen noch unbefriedigend abgebildet. Am Kunststoff-Material der Chips können Substanzen hängen bleiben (adsorbiert werden) und damit niedrigere Konzentrationen (und damit geringere Nebenwirkungen) vortäuschen. Ein ganz wesentliches Problem der Multi-Organ Chips und damit schlussendlich des Body-on-a-Chip - eines menschlichen Avatars - ist das Skalieren der einzelnen Komponenten, d.i. der korrekten Verweilzeit der durchströmenden Flüssigkeit und damit der Testsubstanzen in den Organmodellen. Natürlich ist es auch entscheidend wie weit die Funktionsfähigkeit in den Zellen über die Versuchsdauer erhalten bleibt. Noch zahlreiche weitere Fragen sind offen.
Viele der bestehenden Probleme erscheinen lösbar und rücken uns dem Ziel näher immer verlässlichere Prognosen über die Auswirkungen von Fremdstoffen - darunter Medikamenten - auf den menschlichen Organismus zu erhalten, als es jetzt mit Versuchstieren der Fall ist.
Trotz der begrenzten Übertragbarkeit von Ergebnissen im Tierversuch auf den Menschen, dürften die Tierstudien in der präklinischen Entwicklungsphase noch nicht durch Alternativen ersetzbar sein. Die europäische Arzneimittelbehörde EMA hat eine Arbeitsgruppe eingerichtet, die die neuen Verfahren erst einmal evaluieren soll und sieht den Zeitpunkt für den Ersatz der Tierversuche noch nicht gekommen.
[1] Liancao Jiang et al., Bioengineering 2022. https://www.mdpi.com/2306-5354/9/11/685
[2] Ingber, D.E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nat Rev Genet 23, 467–491 (2022). https://doi.org/10.1038/s41576-022-00466-9
[3] Lorna Ewart et al., Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Communications Medicine, 2022. https://doi.org/10.1038/s43856-022-00209-1
[4] Tissue Chip Initiatives & Projects:https://ncats.nih.gov/tissuechip/projects
Zum Arzneimittelforschungs-und Entwicklungsprozess im ScienceBlog
- Inge Schuster; 24.02.2019: Pharma im Umbruch
- Inge Schuster; 15.04.2016: Big Pharma - ist die Krise schon vorbei?
- Redaktion; 24.04.2015: Wie entstehen neue Medikamente? Pharmazeutische Wissenschaften
- Christian R. Noe; 01.01.2015: Neue Wege für neue Ideen – die „Innovative Medicines Initiative“(IMI)
- Peter Seeberger; 16.05.2014: Rezept für neue Medikamente
- Inge Schuster; 08.03.2012: Zur Krise der Pharmazeutischen Industrie