Die Großhirnrinde, ein hochdimensionales, dynamisches System
Die Großhirnrinde, ein hochdimensionales, dynamisches SystemDo, 15.12.2016 - 03:48 — Wolf Singer & Andreea Lazar
Wie schafft es unser Gehirn aus einer Vielzahl an optischen, klanglichen und haptischen Sinneseindrücken einheitliche Wahrnehmungen zu erzeugen? Wie können daraus kohärente Bilder der Welt entstehen? Wolf Singer (Direktor em. am Max-Planck-Institut für Hirnforschung und Leiter des Ernst Strüngmann Instituts für Neurowissenschaften; Frankfurt/M), einer der weltweit profiliertesten Neurowissenschafter, und Andreea Lazar (Postdoc am Max-Planck-Institut für Hirnforschung) zeigen hier auf , dass die Funktionsabläufe in unserem Gehirn nicht zentral organisiert sind, sondern in hohem Maße parallel erfolgen. Dass in der Großhirnrinde ein Prinzip der Informationskodierung und Verarbeitung verwirklicht ist, welches auf der hohen Dimensionalität dynamischer Zustände von rekurrierend gekoppelten Netzwerken basiert.*
Wahrnehmen beruht auf Rekonstruktion
Damit Sinnessignale Wahrnehmungen werden können, müssen sie unter Hinzuziehung von Vorwissen, das im Gehirn gespeichert ist, geordnet und interpretiert werden. Ein erheblicher Anteil dieser Rekonstruktionen wird von der Großhirnrinde erbracht. Wie einzigartig diese Leistung ist, wird deutlich, wenn man bedenkt, dass zum Beispiel auf der Netzhaut des Auges durch den optischen Apparat lediglich eine zweidimensionale, kontinuierliche Verteilung elektromagnetischer Wellen erzeugt wird, die sich in ihrer Intensität und Wellenlänge unterscheiden.
Aus dieser Information, die über die Nervenzellen in der Netzhaut in neuronale Erregungen verwandelt und an die Hirnrinde weitergeleitet wird, erzeugt das Gehirn dann das, was wir wahrnehmen: dreidimensionale Objekte, die voneinander und dem Hintergrund deutlich abgegrenzt und damit identifizierbar sind. Es ist dies eine Leistung, die selbst von den besten derzeit verfügbaren technischen Mustererkennungssystemen nur unter eingeschränkten und relativ stereotypen Bedingungen erbracht werden kann. Unser Gehirn löst diese Aufgabe mühelos und in Bruchteilen einer Sekunde.
Eine notwendige Voraussetzung für diesen Verarbeitungsschritt, der als Szenen- oder Bildsegmentierung benannt wird, ist der Vergleich der einlaufenden Sinnessignale mit gespeicherten Modellen über die Struktur der Sehwelt. Das Gehirn weiß bereits, wie Objekte beschaffen sind und nutzt dieses Vorwissen, um die verfügbaren Sinnessignale zu ordnen und miteinander so zu verbinden, dass voneinander abgegrenzte Gestalten erkennbar werden. Schon in den Dreißigerjahren des letzten Jahrhunderts haben Gestaltpsychologen wie Wertheimer, Koffka und Köhler, die unter anderem in Frankfurt tätig waren, diejenigen Gestaltprinzipien herausgearbeitet, nach denen unsere Gehirne Objekte voneinander abgrenzen.
So zeichnet sich ein Objekt dadurch aus, dass es eine kontinuierliche, geschlossene Umrandung aufweist, dass sich alle seine Konturen mit der gleichen Geschwindigkeit in die gleiche Richtung bewegen, wenn sich das Objekt bewegt, dass seine Bestandteile gewisse Merkmale gemein haben, beispielsweise miteinander verbunden zu sein, oder die gleiche Farbe oder Textur zu haben. Viele psychophysische Experimente verweisen darauf, dass diese Regeln im Gehirn abgespeichert sind und über alle Spezies hinweg große Ähnlichkeiten aufweisen. Letzteres ist nicht verwunderlich, da wir alle in der gleichen Welt leben, mit den gleichen Wahrnehmungsproblemen konfrontiert sind und sich im Laufe der Evolution der Arten eine optimale Strategie herausgebildet hat.
"Wir bilden nicht ab, wir konstruieren"
Das Wissen über Gestaltprinzipien ist zum großen Teil angeboren und in der Verschaltung der Großhirnrindenareale niedergelegt, die sich mit der Verarbeitung von Sinnessignalen befassen. Uns ist nicht bewusst, dass wir über diese Regeln verfügen, da sie über evolutionäre Ausleseprozesse optimiert, in den Genen gespeichert und in der Architektur unseres Nervensystems niedergelegt wurden. Ein Teil der Gestaltkriterien wird jedoch im Laufe der frühen Hirnentwicklung durch Erfahrung erlernt und ebenfalls durch strukturelle Veränderungen in den entsprechenden Neuronennetzen gespeichert und steht dann genauso wie das angeborene Vorwissen für die Interpretation von Sinnessignalen zur Verfügung.
Eine zentrale und noch weitestgehend ungelöste Frage ist nun, wie die Verrechnung der eingehenden Sinnessignale mit dem gespeicherten Vorwissen erfolgt. Einige Randbedingungen, die im Folgenden erläutert werden, lassen erahnen, dass es sich hier um einen ganz außergewöhnlichen Vorgang handeln muss, für den es keine triviale Erklärung geben kann.
Ein geheimnisvolles Speichermedium
Zur Veranschaulichung des Problems muss in Erinnerung gerufen werden, dass Menschen, aber das gilt auch für die meisten anderen Tierarten mit hoch differenzierten Sehsystemen, etwa viermal in der Sekunde die Blickrichtung wechseln, um die Sehwelt zu erkunden oder Bilder auf ihren Gehalt hin abzutasten. Dies bedeutet, dass die Vergleichsoperationen zwischen einlaufenden Sinnessignalen und dem gespeicherten Vorwissen in etwa 200 Millisekunden erfolgen muss. Wenn der Segmentierungsprozess ein vertrautes Objekt isoliert, ist auch der Erkennungsprozess innerhalb von wenigen hundert Millisekunden abgeschlossen. Dies bedeutet, dass auch das gesamte im Gehirn gespeicherte Wissen über Objekte, denen man im Laufe des Lebens begegnet ist, in einem Speicher abgelegt sein muss, der es erlaubt, auf beliebige Inhalte innerhalb von Bruchteilen einer Sekunde zuzugreifen.
In den heute für die Musterverarbeitung verwendeten Computersystemen ist für jeden gespeicherten Inhalt ein adressierbarer Speicherplatz reserviert und die Suche nach dem gewünschten, für den Abgleich erforderlichen Speicherinhalt erfolgt im Wesentlichen seriell. Diese einfache Strategie ist hoch effizient, weil Elektronenrechner mit sehr hoher Taktfrequenz arbeiten können und deshalb die Suchzeiten erträglich sind.
…ein parallel strukturierter Suchprozess
Im Gehirn kann eine solche Strategie keinesfalls realisiert sein, da die Zeitkonstanten, mit denen Neuronen arbeiten, um viele Größenordnungen länger sind als die von Transistoren. Es muss also ein anderes Prinzip verwirklicht sein. Es muss ein Speicherplatz konfiguriert werden, in dem eine unvorstellbare Zahl von Inhalten so gestapelt werden kann, dass auf sie ein parallel strukturierter Suchprozess angewandt werden kann, sodass die Zugriffszeit nur unwesentlich von der Lage des zu suchenden Inhaltes abhängt.
Bei einer seriellen Anordnung wie in den Speichern von Elektronenrechnern dauert die Suche nach Inhalten am Ende der Liste naturgemäß länger als für solche, die am Anfang stehen. Dies scheint bei dem im Gehirn realisierten Speicherprozess nicht der Fall zu sein. Es muss also ein Raum geschaffen werden, der die Überlagerung einer sehr großen Zahl von Inhalten erlaubt - es ist leicht zu sehen, dass ein solcher Raum eine sehr hohe Dimensionalität aufweisen muss. Der dreidimensionale kartesianische Raum, in diesem Fall also eine anatomisch segregierte Anordnung von Inhalten, scheidet aus. Hochdimensionale Räume können jedoch erschlossen werden, wenn die Zeit als Kodierungsdimension hinzugezogen wird und der Raum durch distinkte Zustände eines dynamischen Systems definiert wird. In diesem Fall muss dafür gesorgt werden, ein dynamisches System zu erzeugen, dass eine sehr, sehr große Zahl unterschiedlicher Zustände annehmen kann. Jedem dieser Zustände könnte dann ein ganz bestimmter Inhalt zugeordnet werden. Es muss dann lediglich eine Möglichkeit gefunden werden, dass dieses System beim Eintreffen der Suchsignale, in unserem Fall der Signale von Sinnesorganen, sehr schnell in den Zustand einschwingt, der einem gespeicherten Inhalt entspricht.
Die Arbeitshypothese, die wir in Frankfurt seit geraumer Zeit verfolgen,
geht davon aus, dass die Großhirnrinde (Abbildung 1) als ein dynamisches System verstanden werden kann, das die geforderten Eigenschaften aufweist.
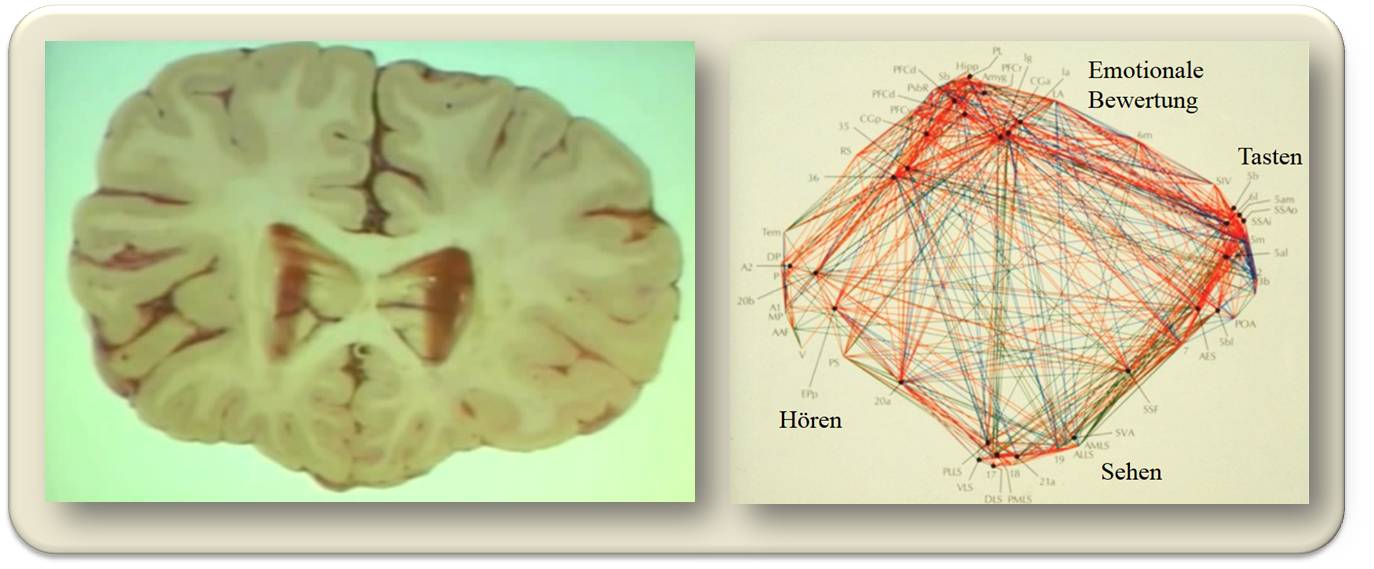 Abbildung 1. Das Gehirn. Links: Querschnitt des menschlichen Gehirns. Die wenige Millimeter dicke Großhirnrinde (Cortex), Teil der grauen Substanz, ist dicht gepackt mit Nervenzellen- rund 60 000 je mm3 - von denen jede mit bis zu 20 000 anderen Nervenzellen "spricht" und von ebenso vielen aus der Nachbarschaft und von weiter entfernten Bereichen "angesprochen" wird. Die in allen Bereichen nahezu identische interne Struktur der Großhirnrinde weist auf nahezu idente, darin ablaufende Verarbeitungsprozesse hin, die Bereiche erhalten jedoch unterschiedliche Eingangsinformationen. Rechts: Verschaltung der sensorischen Hirnrindenareale (Punkte) von Katzen; neuronale Verkopplungen (Linien) von Milliarden Neuronen.
Abbildung 1. Das Gehirn. Links: Querschnitt des menschlichen Gehirns. Die wenige Millimeter dicke Großhirnrinde (Cortex), Teil der grauen Substanz, ist dicht gepackt mit Nervenzellen- rund 60 000 je mm3 - von denen jede mit bis zu 20 000 anderen Nervenzellen "spricht" und von ebenso vielen aus der Nachbarschaft und von weiter entfernten Bereichen "angesprochen" wird. Die in allen Bereichen nahezu identische interne Struktur der Großhirnrinde weist auf nahezu idente, darin ablaufende Verarbeitungsprozesse hin, die Bereiche erhalten jedoch unterschiedliche Eingangsinformationen. Rechts: Verschaltung der sensorischen Hirnrindenareale (Punkte) von Katzen; neuronale Verkopplungen (Linien) von Milliarden Neuronen.
Eines der dominierenden Verschaltungsprinzipien ist, dass Neuronengruppen in der Großhirnrinde reziprok miteinander verbunden sind, sich also gegenseitig beeinflussen können. Wegen der riesigen Zahl von Neuronen, die in einem bestimmten Hirnrindenareal miteinander wechselwirken können, entsteht eine ungeheuer komplexe, hochdimensionale Dynamik, die den erforderlichen Kodierungsraum bereitstellen könnte. Hinzukommt, und das ist eine Entdeckung, die wir in Frankfurt vor mehr als zwanzig Jahren machten, dass lokale Gruppen von Neuronen – die Knoten im Netzwerk – wie Oszillatoren schwingen können (Abbildung 2). Dies erhöht noch einmal mehr die Komplexität der möglichen Dynamik, da auch der Phasenraum zur Kodierung mit genutzt werden kann.
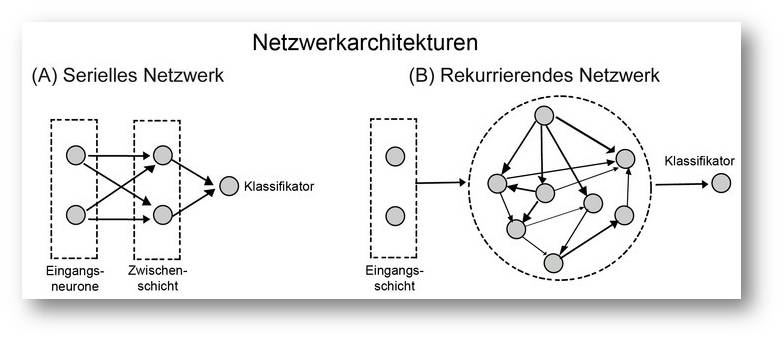 Abbildung 2. (A) Ein klassisches neuronales Netz, wie es in vielen Mustererkennungssystemen verwendet wird. Eingangssignale werden auf eine Schicht von Neuronen verteilt und durch divergente Verschaltungen in Zielneuronen rekombiniert. Dadurch entsteht ein spezifisches Aktivitätsmuster, das dann von Ausgangsneuronen klassifiziert wird. Die Verbindungen von der Zwischenschicht auf die Ausgangsneuronen werden durch einen maschinellen Lernvorgang so gewichtet, dass auf ein gegebenes Muster in der Zwischenschicht nur ein bestimmtes Neuron in der Ausgangsschicht erregt wird. (B) Die Zwischenschicht wurde durch ein rekurrierend gekoppeltes Netzwerk ersetzt. Dieses entwickelt hoch komplexe, dynamische Zustände, die jedoch nach wie vor für die Eingangsmuster spezifisch sind. Die Aktivität einiger dieser Netzwerkknoten wird wiederum auf Ausgangsneurone verteilt, die dann ebenfalls über einen Lernvorgang zu Klassifikatoren für die komplexen Muster ausgebildet werden.© Ernst-Strüngmann Institut/Singer, Lazar, Benzaid
Abbildung 2. (A) Ein klassisches neuronales Netz, wie es in vielen Mustererkennungssystemen verwendet wird. Eingangssignale werden auf eine Schicht von Neuronen verteilt und durch divergente Verschaltungen in Zielneuronen rekombiniert. Dadurch entsteht ein spezifisches Aktivitätsmuster, das dann von Ausgangsneuronen klassifiziert wird. Die Verbindungen von der Zwischenschicht auf die Ausgangsneuronen werden durch einen maschinellen Lernvorgang so gewichtet, dass auf ein gegebenes Muster in der Zwischenschicht nur ein bestimmtes Neuron in der Ausgangsschicht erregt wird. (B) Die Zwischenschicht wurde durch ein rekurrierend gekoppeltes Netzwerk ersetzt. Dieses entwickelt hoch komplexe, dynamische Zustände, die jedoch nach wie vor für die Eingangsmuster spezifisch sind. Die Aktivität einiger dieser Netzwerkknoten wird wiederum auf Ausgangsneurone verteilt, die dann ebenfalls über einen Lernvorgang zu Klassifikatoren für die komplexen Muster ausgebildet werden.© Ernst-Strüngmann Institut/Singer, Lazar, Benzaid
Falls die Großhirnrinde tatsächlich hochdimensionale Dynamik nutzt, um den Abgleich von einlaufenden Signalen mit gespeicherten Inhalten vorzunehmen, dann müssen eine Reihe von überprüfbaren Voraussagen zutreffen. Bei der Formulierung dieser Voraussagen standen die Ergebnisse von theoretischen Arbeiten und Simulationsstudien über künstliche neuronale Netzwerke Pate.
Die Eigenschaften solcher Netzwerke werden seit etwa einer Dekade untersucht, weil sie wegen ihrer hochdimensionalen Dynamik bestimmte Vorteile für die maschinelle Klassifizierung von raumzeitlich strukturierten Mustern aufweisen. Diese informationsverarbeitende Strategie wurde unter dem Namen "reservoir computing" bekannt. Wenn raumzeitlich strukturierte Eingangssignale an einige Knoten solcher Netzwerke verteilt werden, findet man, dass aufgrund der Wechselwirkungsdynamik die Information über den verwendeten Reiz eine Weile gespeichert bleibt und dass sich die Aktivitätsmuster von sequenziell dargebotenen Reizen überlagern, sodass zu einem bestimmten Zeitpunkt die Information über mehrere Reize gleichzeitig verfügbar ist. Und schließlich erweist sich, dass solche Systeme wegen der hohen Dimensionalität ihres Zustandsraumes die Trennung und Klassifizierung von Eingangsmustern sehr erleichtern.
Bestätigte Voraussagen und Überraschungen
Ein Schwerpunkt unserer Arbeiten lag in den vergangenen Jahren darauf, die oben aufgeführten Voraussagen zu testen. Hierzu ist es erforderlich, die Aktivität einer großen Zahl (>50) von Neuronen (Knoten) der Großhirnrinde gleichzeitig zu erfassen, Sinnesreize darzubieten, die resultierende Netzwerkdynamik zu analysieren und mit Hilfe von Methoden aus dem Bereich des maschinellen Lernens dahingehend zu prüfen, ob reizspezifische Informationen in der raumzeitlichen Verteilung der neuronalen Aktivitätsmuster zu finden sind. Um diese Messungen durchführen zu können, werden Tieren in Vollnarkose haarfeine Elektroden in die Großhirnrinde implantiert, über die später die Aktivität der Nervenzellen registriert werden kann. Die hierbei eingesetzten Verfahren ähneln im Detail jenen, die bei Patienten angewandt werden, die aus diagnostischen Gründen Elektroden implantiert bekommen oder um Hirnstrukturen zu reizen, wie das bei der Therapie der Parkinsonschen Erkrankung routinemäßig erfolgt. Die Messungen selbst sind schmerzfrei und bedeuten für die Tiere keine wesentliche Einschränkung, da das Gehirn schmerzunempfindlich ist und die sehr feinen und flexiblen Elektroden bei sachgemäßer Implantation keine Schäden verursachen. Mit Hilfe solcher Untersuchungen konnten wir im Laufe der letzten Jahre die oben aufgeführten Voraussagen bestätigen und die eingangs formulierte Hypothese stützen (Abbildung 3).
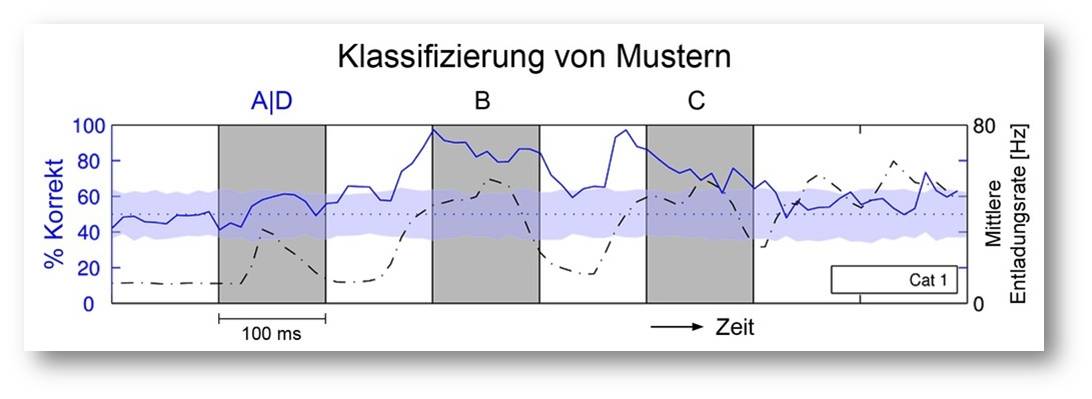 Abbildung 3. Hier wurde überprüft, ob sich aus der Aktivität von 60 zufällig ausgewählten Neuronen der Sehrinde einer Katze rückschließen lässt, welcher Reiz (A oder D) zu Beginn einer Serie von Reizen (A/D, B, C) dargeboten wurde. Linke Ordinate: Prozentsatz der richtigen Klassifizierungen (durchgezogene Linie); Rechte Ordinate: Gemittelte Aktivität der Neuronen (gestrichelte Linie); Abszisse: Zeitverlauf der Reizdarbietung. Etwa 100 Millisekunden nach Darbietung des ersten Reizes lässt sich mit fast 100%iger Sicherheit aus dem Erregungsmuster der Neuronen feststellen, welches der erste Reiz (A oder D) war, und diese Information ist auch nach Darbietung des zweiten Reizes (B) noch fast vollständig erhalten. Erst nach dem dritten Reiz (C) sinkt die Klassifizierbarkeit auf das Zufallsniveau ab (graues Band). © Ernst-Strüngmann Institut/Singer, Lazar, Benzaid
Abbildung 3. Hier wurde überprüft, ob sich aus der Aktivität von 60 zufällig ausgewählten Neuronen der Sehrinde einer Katze rückschließen lässt, welcher Reiz (A oder D) zu Beginn einer Serie von Reizen (A/D, B, C) dargeboten wurde. Linke Ordinate: Prozentsatz der richtigen Klassifizierungen (durchgezogene Linie); Rechte Ordinate: Gemittelte Aktivität der Neuronen (gestrichelte Linie); Abszisse: Zeitverlauf der Reizdarbietung. Etwa 100 Millisekunden nach Darbietung des ersten Reizes lässt sich mit fast 100%iger Sicherheit aus dem Erregungsmuster der Neuronen feststellen, welches der erste Reiz (A oder D) war, und diese Information ist auch nach Darbietung des zweiten Reizes (B) noch fast vollständig erhalten. Erst nach dem dritten Reiz (C) sinkt die Klassifizierbarkeit auf das Zufallsniveau ab (graues Band). © Ernst-Strüngmann Institut/Singer, Lazar, Benzaid
Wie so oft in der Grundlagenforschung zeigten die Daten aber auch vollkommen Unerwartetes. Es stellte sich heraus, dass es im Verlauf der Untersuchungen zunehmend leichter wurde, die von den dargebotenen Reizen erzeugten Aktivitätsmuster zu klassifizieren und den Reizen zuzuordnen. Dies konnte nur bedeuten, dass das kortikale Netzwerk bestimmte, reizspezifische Merkmalskombinationen gelernt und dem Fundus von Vorwissen hinzugefügt hat. Offenbar bewirkte die wiederholte Darbietung der Reizmuster eine Veränderung der Netzwerkeigenschaften, die ihrerseits dafür sorgten, dass die entstehenden hochdimensionalen Muster im Netzwerk weniger überlappten und deshalb besser voneinander unterscheidbar wurden. Diese Vermutung erhält ihre direkte Bestätigung durch eine mathematische Analyse der respektiven Muster.
Als Mechanismus für diese lernbedingten Veränderungen vermuten wir eine aktivitätsabhängige Veränderung der Effizienz der reziproken Verbindungen zwischen den Neuronen. Hinweise für solche erfahrungsabhängigen Veränderungen der synaptischen Effizienz eben dieser Verbindungen hatten wir bereits vor Jahren in Experimenten erhalten, bei denen die Auswirkung von Umweltreizen auf die Ausreifung der Großhirnrinde untersucht wurde. Einen direkten und komplementären Hinweis für das Vorliegen eines solchen Mechanismus lieferte schließlich die Beobachtung, dass die neuronalen Netzwerke auch spontan und ohne jede Reizung die Aktivitätsmuster erzeugen, die von oft gesehenen Reizen hervorgerufen werden. Obgleich weder antizipiert noch gezielt gesucht, bilden diese zusätzlichen Befunde eine starke Stütze für die Hypothese, dass die hochdimensionale Dynamik kortikaler Netzwerke tatsächlich genutzt wird, um sensorische Signale mit gespeicherten Vorwissen zu vergleichen und im Falle der Stimmigkeit zu klassifizieren.
Plausibilitätskontrollen durch Simulationen
Jetzt stand es an zu klären, ob reizspezifische Veränderungen in der Stärke der reziproken Koppelungsverbindungen zwischen den Neuronen (Knoten) tatsächlich eine Verbesserung der Klassifizierungsleistungen solcher Netzwerke mit sich bringen. Hierzu haben Andreea Lazar und Jochen Triesch auf konventionellen Rechnern rückgekoppelte Netzwerke simuliert und die Koppelverbindungen mit adaptiven Synapsen ausgestattet, die ihre Effizienz in Abhängigkeit von der Struktur der auftretenden Aktivierungsmuster verändern können (Abbildung 4).
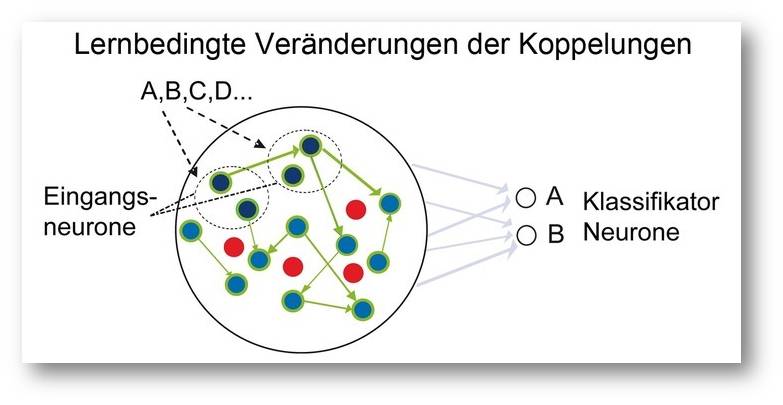 Abbildung 4. Schematische Darstellung des Effektes wiederholter Reizdarbietung in einem simulierten Netzwerk. Die ursprünglich gleich effizienten Verbindungen zwischen den Neuronen im Netzwerk werden entsprechend den verschiedenen Reizen verstärkt (dicke Verbindungen) oder abgeschwächt (dünne oder fehlende Verbindungen), wodurch die von verschiedenen Reizen induzierten, dynamischen Muster sich zunehmend voneinander unterscheiden und besser klassifizierbar werden. © Ernst-Strüngmann Institut/Singer, Lazar, Benzaid
Abbildung 4. Schematische Darstellung des Effektes wiederholter Reizdarbietung in einem simulierten Netzwerk. Die ursprünglich gleich effizienten Verbindungen zwischen den Neuronen im Netzwerk werden entsprechend den verschiedenen Reizen verstärkt (dicke Verbindungen) oder abgeschwächt (dünne oder fehlende Verbindungen), wodurch die von verschiedenen Reizen induzierten, dynamischen Muster sich zunehmend voneinander unterscheiden und besser klassifizierbar werden. © Ernst-Strüngmann Institut/Singer, Lazar, Benzaid
Diese Modifikationen erfolgten nach Regeln, die bereits bei Untersuchungen von Lernvorgängen an realen neuronalen Strukturen erarbeitet worden waren. Die simulierten Netzwerke mit adaptiven Verbindungen wurden daraufhin mit unterschiedlichen Reizsequenzen aktiviert und es zeigte sich, dass sich die Klassifizierungsleistung dieser sich selbst adaptierenden Netzwerke mit wiederholter Reizdarbietung, man könnte auch sagen mit zunehmender Erfahrung, deutlich verbesserte und weit über das hinaus ging, was konventionelle rekurrierende Netzwerke zu leisten vermögen.
Diese Kongruenz von experimentellen und simulierten Daten macht es in unseren Augen sehr wahrscheinlich, dass in der Großhirnrinde ein Kodierungsprinzip verwirklicht ist, das sich deutlich von allen bisher entweder postulierten oder in künstlichen Systemen realisierten Musterverarbeitungsprozessen unterscheidet. Sollte sich diese Vermutung in zukünftigen Untersuchungen bestätigen, wären wir einen Schritt weiter im Verständnis der nach wie vor rätselhaften Funktion der Großhirnrinde. Vielleicht, so die Hoffnung, wird uns das helfen, die ebenfalls rätselhaften Mechanismen besser zu verstehen, die jenen psychischen Erkrankungen zu Grunde liegen, die auf Störungen von Großhirnrindenfunktionen beruhen.
Mit Sicherheit wird es möglich sein, die gewonnenen Erkenntnisse für die Entwicklung völlig neuartiger informationsverarbeitender Systeme zu nutzen.
Literaturhinweise
1. Lazar, A.; Pipa, G., Triesch, J. SORN: a self-organizing recurrent neural network . Frontiers in Computational Neuroscience 3:23 (2009)
2. Nikolic, D.; Häusler, S.; Singer, W.; Maass, W. Distributed fading memory for stimulus properties in the primary visual cortex. PLOS Biology 7: e1000260 (2009)
3. Singer, W. Cortical dynamics revisited. Trends in Cognitive Sciences 17: 616-626 (2013)
*Der unter dem Titel "Die Großhirnrinde, ein hochdimensionales, dynamisches System" im Jahrbuch der Max-Planck Gesellschaft 2016 erschienene Artikel (https://www.mpg.de/9974873/ESI_JB_2016?c=10583665 ) wurde mit freundlicher Zustimmung des Autors und der MPG-Pressestelle ScienceBlog.at zur Verfügung gestellt. Er erscheint hier leicht gekürzt (Abbildung 3 des Originals wurde weggelassen) und für den Blog adaptiert (Für's leichtere Scrollen wurden einige Untertitel und Absätze eingefügt. Zur Erläuterung von Hirnrinde und Verschaltung der sensorischen Hirnrindenareale wurde Abbildung 1 von der Redaktion eingefügt, die beiden Bilder stammen vom Autor.) .
Weiterführende Links
AIL-Talk: Wolf Singer - Neuronale Grundlagen des Bewusstseins. Video 1:29:27 from Angewandte Innovation Lab. 07.09.2016. https://vimeo.com/184970876
Wolf Singer: The encoding of semantic relations. Conference: East-West Connections, NTU Para Limes. Video (englisch) 1:19:15; 11.11.2016. (Standard Youtube Lizenz) Wolf Singer - Vom Bild zur Wahrnehmung. Iconic Turn - Felix Burda Memorial Lectures. Video 2:03:05; 22.08.2012.(Standard Youtube Lizenz) Wolf Singer: Hirnentwicklung und Umwelt oder Wie Wissen erworben und gespeichert wird.

