Wenn das angepeilte Target nicht das tatsächliche Target ist - ein Grund für das klinische Scheitern von Wirkstoffen gegen Krebs
Wenn das angepeilte Target nicht das tatsächliche Target ist - ein Grund für das klinische Scheitern von Wirkstoffen gegen KrebsDo, 28.11.2019 — Ricki Lewis

![]() Der Entwicklung neuer Arzneimittel geht die Suche nach Zielstrukturen - Targets - voraus, die essentiell in das Krankheitsgeschehen involviert sind und gegen die dann Wirkstoffe designt werden können. Der allergrößte Teil der solcherart gegen Krebserkrankungen entwickelten Stoffe scheitert aber in der klinischen Prüfung, wobei mangelnde Wirksamkeit einer der Hauptgründe ist. Unter Anwendung der CRISPR-Cas Technologie deckt eine neue Studie an einer Reihe von klinischen Entwicklungssubstanzen nun auf, dass deren postulierte Targets und damit die Wirkungsmechanismen unrichtig sind und eine bereits in der Präklinik erfolgende Validierung der echten Targets die Zahl unwirksamer klinischer Studien reduzieren könnte. Die Genetikerin Ricki Lewis berichtet über diese Studie.*
Der Entwicklung neuer Arzneimittel geht die Suche nach Zielstrukturen - Targets - voraus, die essentiell in das Krankheitsgeschehen involviert sind und gegen die dann Wirkstoffe designt werden können. Der allergrößte Teil der solcherart gegen Krebserkrankungen entwickelten Stoffe scheitert aber in der klinischen Prüfung, wobei mangelnde Wirksamkeit einer der Hauptgründe ist. Unter Anwendung der CRISPR-Cas Technologie deckt eine neue Studie an einer Reihe von klinischen Entwicklungssubstanzen nun auf, dass deren postulierte Targets und damit die Wirkungsmechanismen unrichtig sind und eine bereits in der Präklinik erfolgende Validierung der echten Targets die Zahl unwirksamer klinischer Studien reduzieren könnte. Die Genetikerin Ricki Lewis berichtet über diese Studie.*
Siebenundneunzig Prozent der potenziellen neuen Krebsmedikamente erreichen nie den Markt; sie fallen in den klinischen Studien durch, wenn sie die Kriterien für Sicherheit oder Wirksamkeit nicht erfüllen.
"Wir haben keine Ahnung, warum das so ist. Die extrem hohe Ausfallsrate deutet aber meiner Meinung darauf hin, dass einige grundlegende Probleme in der Art und Weise bestehen, wie neue Zielstrukturen (Targets) für Wirkstoffe untersucht und neue Wirkstoffe charakterisiert werden “, meinte der Molekularbiologe Jason Sheltzer (Fellow am Cold Spring Harbor Laboratory, Long Island, NY) und beschloss diesbezüglich Untersuchungen anzustellen.
CRISPR - ein präzises Instrument
In der Zeitschrift Science Translational Medicine vom September 2019 berichten Sheltzer und sein Team, dass man die "Genschere"( Gen-Editing-Tool) CRISPR-Cas9 eingesetzt habe, um zu prüfen, ob 10 experimentelle Krebsmedikamente genau so wirken, wie ihre Entwickler es angekündigt hatten [1] (Abbildung 1). Und sie fanden, dass die Art und Weise, wie diese Substanzen für Targets gesucht hatten, mit einem Tunnelblick erfolgt war, was erklären könnte, warum bestimmte Patienten nicht so wie erhofft reagieren.
Wie ein Pfeil, der in einem Baum landet anstatt im Zentrum der Schießscheibe, können manche Krebsmedikamente ihre Targets tatsächlich nicht erreichen- allerdings waren viele Studien nicht dazu angelegt dies aufzudecken. Sehen Ergebnisse erfolgversprechend aus, so durchläuft die Entwicklungsverbindung das Labyrinth bis zur FDA-Zulassung.
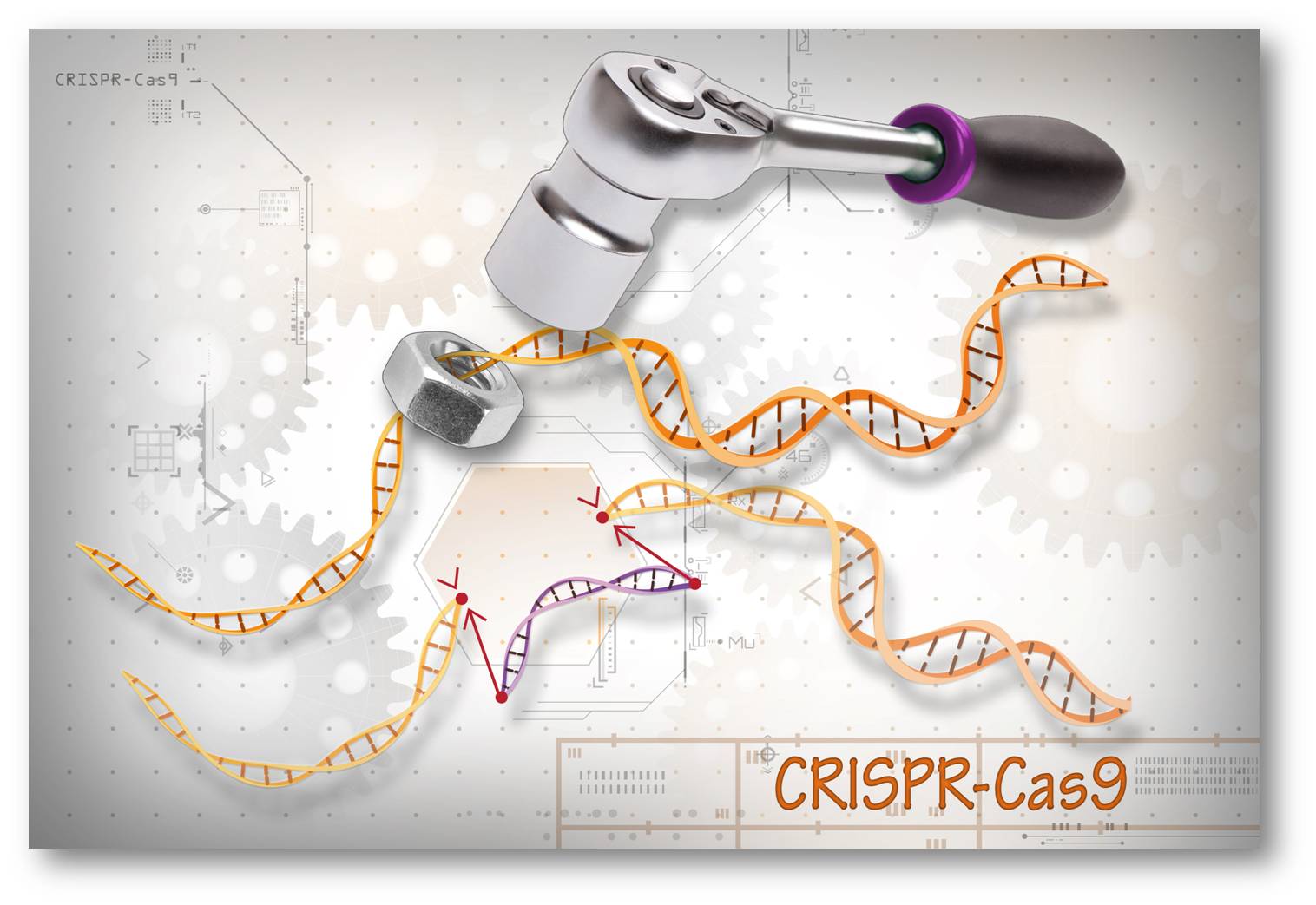 Abbildung 1. Die CRISPR-Cas Technologie führt gezielt Doppelstrangbrüche in der DNA ein und ermöglicht ein präzises Manipulieren - Löschen, Korrigieren oder Ersetzen - von Genen in jeder Zelle.
Abbildung 1. Die CRISPR-Cas Technologie führt gezielt Doppelstrangbrüche in der DNA ein und ermöglicht ein präzises Manipulieren - Löschen, Korrigieren oder Ersetzen - von Genen in jeder Zelle.
Die Strategie von Sheltzer war einfach: Man wendet CRISPR an, um das Target der Wahl zu entfernen. Falls das Medikament dann immer noch wirkt, ist dieses Target nicht das wirkliche Target. Die Forscher testeten Wirkstoffe, die sich in klinischen Studien befinden oder einst befunden haben oder in präklinischen Studien (an Tieren oder menschlichen Zellen) - jedoch keine Krebsmedikamente, die derzeit auf dem Markt sind. Die Experimente wurden an von Krebspatienten stammenden Standardzelllinien durchgeführt.
„Das Konzept bei vielen dieser Wirkstoffe ist, dass sie die Funktion eines bestimmten Proteins in Krebszellen blockieren. Wir konnten allerdings zeigen, dass die meisten dieser Medikamente nicht dadurch wirken,dass sie die Funktion des als Target angegebenen Proteins blockieren“, erklärte Sheltzer.
Mit Hilfe von CRISPR wird eine genauere Bestimmung potenzieller Wirkstofftargets möglich als mit der älteren Methode, der RNA-Interferenz (RNAi). RNAi unterbindet die Genexpression, anstatt wie CRISPR ein Gen auszuschneiden.
Könnte ein kleines Molekül an mehr als eine Art von Targets binden, so wie wenn man Pfeile losschießt, die auf Bäume, Büsche und auch in das Zentrum der Schießscheibe treffen? Was in vitro ein validiertes Target für einen Wirkstoff darstellt, ist manchmal nicht gerade das, was in einem Körper passiert.
Allerdings kann ein Medikament zugelassen werden, ohne dass irgendjemand genau weiß, wie es wirkt. Dies trifft auf Antidepressiva zu, welche die Wiederaufnahme von Serotonin selektiv hemmen (SSRI). Bilder in Inseraten zeigen neuromuskuläre Synapsen, in denen das Medikament an die Wiederaufnahmeproteine bindet und so Serotonin länger verfügbar in Synapsen hält und damit vermutlich ein die Symptomatik auslösendes Defizit ausgleicht. Googelt man aber nach SSRI, so erhält man die Antwort: "der genaue Wirkungsmechanismus von SSRIs ist nicht bekannt".
Vom "Brandroden" zum Treffen von Targets
Einige der neuen Krebsmedikamente zielen auf Moleküle ab, die für Krebszellen spezifisch sind (Abbildung 2) Unter diesen finden sich:
- Rezeptoren von Wachstumsfaktoren oder Hormonen
- Enzyme, die in der Zellteilung eine entscheidende Rolle spielen - wie Cycline und Kinasen
- Immun-Checkpoint-Hemmer, welche die von Krebszellen verursachte Unterdrückung der Immunantwort aufheben.
 Abbildung 2. Medikamente, die zielgerichtet ihr Target treffen.
Abbildung 2. Medikamente, die zielgerichtet ihr Target treffen.
Diese zielgerichteten Medikamente bieten eine Alternative oder Ergänzung zu herkömmlichen Medikamenten, die nicht nur die Krebszellen zerstören sondern ganz allgemein viele Typen von sich schnell teilenden Zellen.
Den Anfang der auf Targets abzielenden Medikamente hat 1998 Herceptin gemacht; seine Erfinder wurden kürzlich mit dem Lasker-Preis geehrt. Ein weiteres ungemein erfolgreiches Krebsmedikament, Gleevec, wurde 2001 in nur wenigen Monaten nach der Einreichung von der FDA zugelassen. Heute wird in Inseraten salbungsvoll das neue Arsenal an Krebstherapien vorgestellt: Zelboraf, Tafinlar, Keytruda, Opdivo.
Auf ein Target zugeschnittene Medikamente können allerdings versagen, wenn eine neue Mutation das Target verändert oder wenn Krebszellen einen alternativen Weg finden, der die Zellteilungsrate erhöht.
Zurück zum Sheltzer-Experiment
Die Forscher verfolgten einen zweifachen experimentellen Ansatz basierend auf den Überlegungen:
- Man entfernt das Target (beispielsweise ein Protein an der Zelloberfläche) in Krebszellen. Wenn sich die Zellen dennoch weiter teilen, war das Target nicht essentiell.
- Man fügt Krebszellen, in denen das Target entfernt worden war, den Wirkstoff zu. Wenn die Zellen trotzdem sterben, dann trifft die Substanz irgendetwas anderes.
Das erste getestete Medikament
Bereits früher hatte Sheltzer ein Protein namens MELK (“maternal embryonic leucine zipper kinase”) untersucht, gegen welches das Unternehmen, OncoTherapy Science, einen Inhibitor mit der Bezeichnung OTS167 entwickelt. Da MELK in vielen Tumorarten reichlich vorkommt, nahm man an, dass es für deren Wachstum essentiell und damit ein Target für Medikamente ist. Als aber nun mit CRISPR das für das MELK-Protein kodierende Gen entfernt wurde, passierte gar nichts.
"Zu unserer großen Überraschung starben die Krebszellen nicht ab, als wir diese Proteine eliminierten, Im Gegensatz zu früheren Veröffentlichungen wuchsen die Krebszellen lustig weiter. MELK war ihnen einfach egal“, sagte Sheltzer.
Die Sheltzer-Gruppe veröffentlichte die Ergebnisse zu MELK im Jahr 2017 [2] und wies dabei auf die Möglichkeit hin, dass OTS167 möglicherweise den falschen Baum anbellt. Die Entwicklungsverbindung befindet sich nun in einer klinischen Phase-1-Studie (Sicherheitsprüfung) für solide Tumoren und rekrutiert Patienten für eine Phase-1-Studie bei dreifachnegativem und metastasiertem Brustkrebs.
Die MELK-Geschichte inspirierte die Gruppe, ihre „Strategie zur genetischen Target-Abklärung“ anzuwenden, um herauszufinden ob 10 weitere Wirkstoffe ihre mutmaßlichen Targets tatsächlich erreichen. In klinischen Studien erhalten insgesamt an die tausend Krebspatienten eines dieser Präparate verabreicht.
Eine andere Fehlannahme führt zur Entdeckung eines neuen Targets
In der erwähnten neuen Veröffentlichung [1] prüften die Forscher einen weiteren Wirkstoff - OTS964 - , der zur Behandlung bestimmter Lungen- und Brustkrebserkrankungen entwickelt wurde. Dabei haben sie ein neues Target für Krebsmedikamente entdeckt. Abbildung 3.
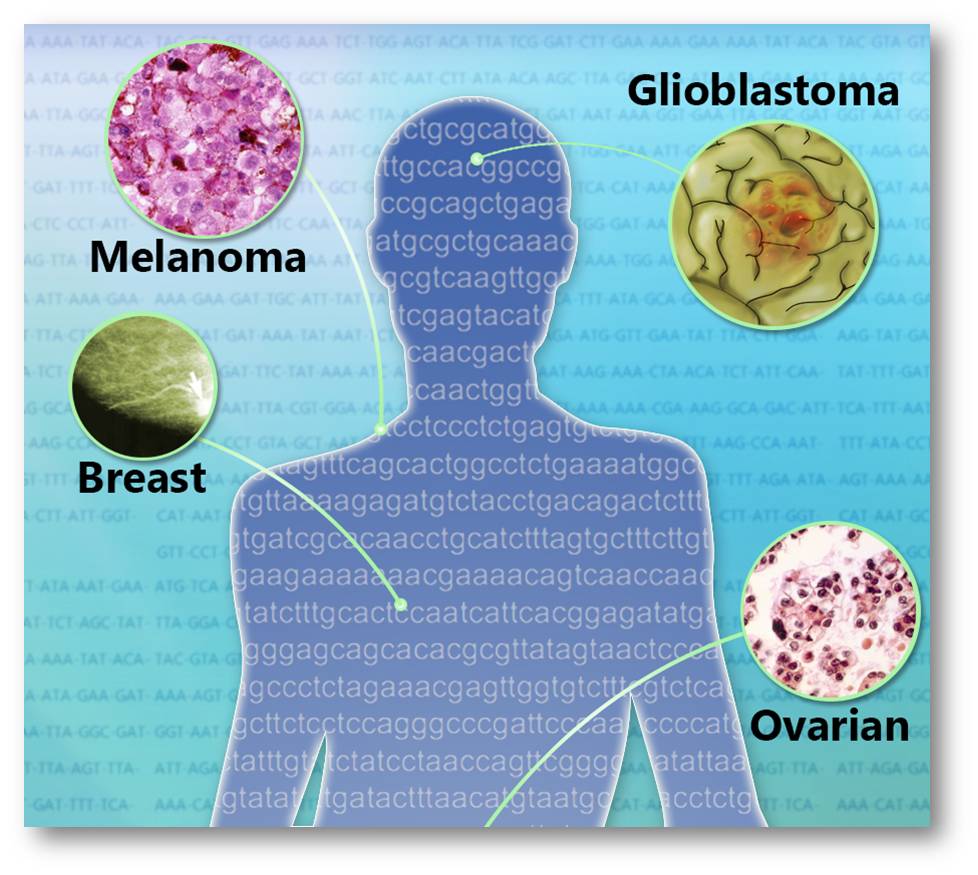 Abbildung 3. Auf Targets abzielende Krebstherapien basieren auf Mutation des Targets und nicht auf seine Lokalisierung in einem Organ (Bild: NHGRI)
Abbildung 3. Auf Targets abzielende Krebstherapien basieren auf Mutation des Targets und nicht auf seine Lokalisierung in einem Organ (Bild: NHGRI)
Versuche mit Interferenz-RNA hatten darauf hingewiesen, dass die Zielstruktur von OTS964 ein Protein namens PBK ist. Aber CRISPR hat dann eine andere Geschichte erzählt- "es stellte sich heraus, dass die Wechselwirkung mit PBK nichts damit zu tun hat, wie der Wirkstoff tatsächlich Krebszellen abtötet", sagte Sheltzer.
Um herauszufinden, wie die auf PBK abzielende Substanz wirkt, versetzten die Forscher die Krebszellen mit einen hohen Überschuss davon und ließen den Zellen dann Zeit Mutationen zu generieren, die es ihnen ermöglichen würden, resistent gegen den Wirkstoff zu werden. Krebsgenome sind von Natur aus instabil und mutieren häufig. Wenn eine Mutation eine Zelle resistent gegen ein Medikament macht, so hat diese Zelle einen Vorteil und beginnt bald den Tumor zu dominieren.
Zu entdecken, wie eine Zelle gegen ein Medikament resistent wird, ist unbezahlbare Information.
Die Resistenz-Experimente haben gezeigt, dass die Verwundbarkeit der Krebszellen durch den Wirkstoffkandidaten OTS964, nicht PBK zuzuschreiben ist, sondern einem Gen, welches für das Protein CDK11 codiert. Dies ist eine sogenannte "Cyclin-abhängige Kinase", ein Enzym, das eine Komponente des Pfades ist, der zur Zellteilung führt.
Beginnend mit Ibrance im Februar 2015 hat die FDA hat bereits Inhibitoren der Cyclin abhängigen Kinase CDK4/6 zugelassen, um bestimmte Formen von Brustkrebs zu behandeln. CDK11 ist ein brandneues und möglicherweise bedeutendes Target.
Was kommt als nächstes?
Auf einer Pressekonferenz sind die Forscher auf Befürchtungen eingegangen, dass sich ihre Ergebnisse auf Menschen auswirken werden, die bereits auf Targets abzielende Krebsmedikamente einnehmen. Ihr Argument war, dass ihre Untersuchungen keine zugelassenen Medikamente betrafen, die auf Bäume statt auf Schießscheiben zielten.
Wie sieht es aber mit laufenden klinischen Studien an Krebswirkstoffen aus?
Sheltzer hat versucht die Leute, welche die Studien durchführen, aufmerksam zu machen. „Ich habe einen FOIA (Freedom of Information Act) bei der FDA eingereicht, um zu versuchen zusätzliche Informationen zur Sicherheit und Wirksamkeit dieser Prüfsubstanzen zu erhalten. Die FDA lehnte es ab, diese Daten weiterzugeben, und sagte, dass diese bis zur Zulassung der Medikamente durch sie geheim bleiben müssten.“
Sheltzer wandte sich auch an die Unternehmen, welche als Sponsoren der klinischen Studien auftraten; auch diese gaben keinerlei Information weiter.
„Ich denke, dass Geheimhaltung und Intransparenz in diesem Abschnitt der Arzneimittelentwicklung den wissenschaftlichen Fortschritt wirklich beeinträchtigen. Viele der an Krebspatienten getesteten Medikamente bringen diesen tragischerweise keine Hilfe. Würde man entsprechende Evidenz routinemäßig sammeln, bevor Entwicklungsprodukte in klinische Studien eintreten, wären wir besser in der Lage den Patienten Therapien zuzuweisen, welche diesen höchstwahrscheinlich einigen Nutzen bringen. Mit derartigem Wissen können wir meines Erachtens das Versprechen einer Präzisionsmedizin besser erfüllen “, sagte Sheltzer.
Die Pharmaunternehmen würden gut daran tun auf Grundlagenforscher mehr zu hören, die herausfinden, wie Dinge funktionieren oder eben nicht funktionieren (wie beispielsweise Shelzer). Die CRISPR-Technologie ermöglicht Forschern "eine verbesserte Suche nach den zentralen Genen im Krebsgeschehen und eine bessere Validierung des Wirkungsmechanismus eines Arzneimittels an seinem Target. Wir glauben, dass eine derartige präklinische Grundlage den Klinikern helfen wird, bessere klinische Studien zu designen, um die Ausfallrate neuer Medikamente zu senken “, schloss Sheltzer.
[1] Ann Lin et al., Off-target toxicity is a common mechanism of action of cancer drugs undergoing clinical trials. Science Translational Medicine (2019): 11, 509, eaaw8412. DOI: 10.1126/scitranslmed.aaw8412
[2] Ann Lin et al., CRISPR/Cas9 mutagenesis invalidates a putative cancer dependency targeted in on-going clinical trials. eLife. 2017; 6: e24179. doi: 10.7554/eLife.24179
* Der Artikel ist erstmals am 24. Oktober 2019 in PLOS Blogs - DNA Science Blog unter dem Titel "When the Target Isn’t Really the Target: One Way Cancer Drugs Fall Out of Clinical Trials " erschienen (https://blogs.plos.org/dnascience/2019/10/24/when-the-target-isnt-really-the-target-one-way-cancer-drugs-fall-out-of-clinical-trials/) und steht unter einer cc-by Lizenz . Die Autorin hat sich freundlicherweise mit der Übersetzung ihrer Artikel durch ScienceBlog.at einverstanden erklärt, welche so genau wie möglich der englischen Fassung folgen.
Weiterführende Links
Gen-editing mit CRISPR/Cas9 Video 3:13 min (deutsch) , Max-Planck Gesellschaft (2016) (Standard-YouTube-Lizenz )
Francis.S.Collins, 02.02.2017: Finden und Ersetzen: Genchirurgie mittels CRISPR/Cas9 erscheint ein aussichtsreicher Weg zur Gentherapie.