Transportunternehmen Zelle
Transportunternehmen ZelleFr, 11.10.2013 - 18:52 — Inge Schuster
 Die Verleihung des diesjährigen Nobelpreises für Medizin oder Physiologie an James E. Rothman, Randy W. Schekman und Thomas C. Südhof, zeichnet deren Entdeckungen zu einem essentiellen Transportsystem in unseren Zellen aus, nämlich die Organisation des Transports von Molekülen, verpackt in sogenannte Vesikeln. Auf Grund ihrer fundamentalen Bedeutung sind diese Forschungsergebnisse bereits als etablierter Wissensstandard in allen einschlägigen Lehrbüchern angeführt und unabdingbarer Bestandteil von biologischen (Einführungs)vorlesungen.
Die Verleihung des diesjährigen Nobelpreises für Medizin oder Physiologie an James E. Rothman, Randy W. Schekman und Thomas C. Südhof, zeichnet deren Entdeckungen zu einem essentiellen Transportsystem in unseren Zellen aus, nämlich die Organisation des Transports von Molekülen, verpackt in sogenannte Vesikeln. Auf Grund ihrer fundamentalen Bedeutung sind diese Forschungsergebnisse bereits als etablierter Wissensstandard in allen einschlägigen Lehrbüchern angeführt und unabdingbarer Bestandteil von biologischen (Einführungs)vorlesungen.
„In einem großen und geschäftigen Hafen sind Systeme notwendig, die sicherstellen, daß die korrekte Fracht zur richtigen Zeit an den korrekten Zielort geliefert wird.“ Mit etwa diesen Worten illustrierte Juleen Zierath, Vorsitzende des Komitees für den Medizin Nobelpreis, die Situation, in der sich Zellen höherer Organismen (Eukaryoten) befinden [1]
Zellen sind Fabriken, die - für den „Eigenbedarf“ oder auch für den Export - unterschiedlichste Biomoleküle produzieren, angefangen von Hormonen und Neurotransmittern bis hin zu großen Proteinen, welche exakt zur richtigen Zeit, an präzise definierten Stellen innerhalb der Zelle anlangen müssen oder aus der Zelle ausgeschleust werden um ihre Funktionen ausüben zu können. (Man denke hier beispielsweise an das Timing der Insulin-Ausschüttung zur Regulation unseres Blutzuckerhaushalts oder die Freisetzung von Neurotransmittern zur Signalübertragung von einer Nervenzelle zur benachbarten Nervenzelle.)
Die Reise von Molekülen quer durch die Zelle, vom Produktionsort zum Zielort, ist allerdings kein einfaches Dahinschwimmen im Zellsaft (Cytoplasma). Eukaryotische Zellen weisen komplexe interne Strukturen auf: unterschiedliche von Membranen umschlossene Kompartimente (Organellen) mit spezifischen Funktionen, die auf eine räumlich und zeitlich präzise Lieferung und Abfuhr spezifischer Substanzen angewiesen sind. Um in diese Organellen hinein oder heraus zu gelangen, müssen die Moleküle irgendwie deren Membranen durchqueren, Barrieren, die vor allem für große Moleküle vollkommen unpassierbar erscheinen.
Der in unseren Zellen realisierte Ausweg aus diesem Dilemma besteht darin Substanzen in sogenannte Vesikel – das sind winzige, von einer Membran umschlossene Bläschen – zu verpacken. Wenn diese Vesikel nun an die Membran einer Zellorganelle oder an die „Außenhaut“ der Zelle – die Zellmembran - stoßen, verschmelzen sie mit dieser und entleeren ihre Fracht in das Innere der Organelle oder in die Umgebung der Zelle. Die Existenz derartiger Vesikel und deren Fähigkeit Proteine von einem Zellkompartiment zum anderen zu transferieren, in die Zelle hinein oder aus der Zelle heraus zu schleusen wurde zwar schon vor Jahrzehnten entdeckt (u.a. durch die Arbeiten des berühmten Zellbiologen und Nobelpreiträger George E. Palade), die zugrundeliegenden Mechanismen der präzisen Organisation und Kontrolle dieser Transportvorgänge blieben jedoch lange unbekannt.
Die nun prämierten Forschungen erklären diese Mechanismen, welche für alle höheren Lebewesen Gültigkeit haben, von einzelligen Hefen bis zu höchst komplex aufgebauten Lebensformen (Abbildung 1).
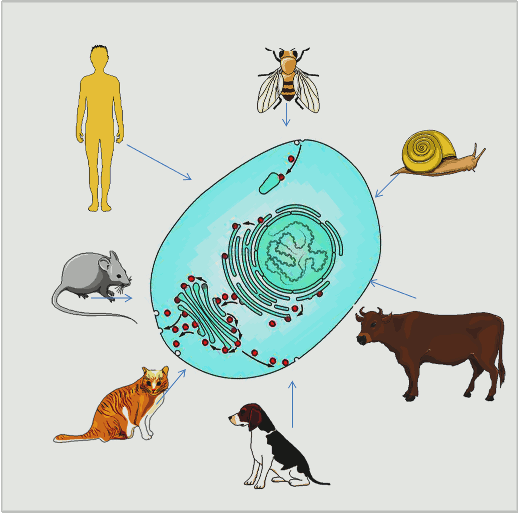 Abbildung 1. Die Zellen aller höheren Lebewesen weisen eine komplexe innere Struktur aus Kompartimenten mit unterschiedlichen Funktionen auf und sie benutzen das gleiche Vesikel-Transportsystem (rote Kreise) um Substanzen in die Kompartimente hinein und hinaus zu befördern. (Eingezeichnete Organellen: Zellkern , endoplasmatisches Retikulum, Golgiapparat; Bild modifiziert nach [1] und Servier Medical Art.)
Abbildung 1. Die Zellen aller höheren Lebewesen weisen eine komplexe innere Struktur aus Kompartimenten mit unterschiedlichen Funktionen auf und sie benutzen das gleiche Vesikel-Transportsystem (rote Kreise) um Substanzen in die Kompartimente hinein und hinaus zu befördern. (Eingezeichnete Organellen: Zellkern , endoplasmatisches Retikulum, Golgiapparat; Bild modifiziert nach [1] und Servier Medical Art.)
Um es mit der Metapher eines Postversands auszudrücken: die Moleküle werden verschickt in Pakete verpackt, mit der exakten Adresse des Empfängers beschriftet und mit dem exakten Liefertermin versehen.
Der Transportweg
Der Biochemiker Randy W Schekman (University of California at Berkeley), hat Hefezellen als Modell benutzt und bereits in den 1970-er Jahren begonnen den Prozeß zu untersuchen, wie Glykoproteine aus diesen Zellen ausgeschleust (sezerniert) werden. Dazu hat er Mutanten erzeugt, in denen einzelne Schritte im Vesikeltransport defekt waren. Derartige Defekte konnte er an Hand der sich nun in den Zellen aufstauenden Vesikel erkennen und in Folge die dafür verantwortlichen, insgesamt 23 Gene identifizieren. Systematische Untersuchungen wiesen diese Gene als Schlüsselgene für die einzelnen Schritte auf dem Transportweg der Vesikel aus - vom Ort der Beladung mit ihrer „Fracht“ über bestimmte Kompartimente der Zelle bis hin zur Fusion mit der Zellmembran an der Zelloberfläche .
Wie erkennen Transportvesikel wohin sie ihre Fracht bringen müssen?
Der Zellbiologe James E. Rothman (Yale University, New Haven, Conneticut ) hat (beginned in den 1980er Jahren) die wesentlich komplexeren Zellen von Säugetieren als Modelle für seine Untersuchungen verwendet. Er interessierte sich vor allem für den Fusionsprozeß von Vesikeln mit der jeweiligen Zielmembran und für die Kontrolle dieses Vorgangs durch Proteine. Dabei entdeckte er, daß sowohl die Vesikel als auch die Zielmembranen an ihren Oberflächen jeweils einen Proteinkomplex aufweisen. Beim Auftreffen eines Vesikels an den Zielort docken dort seine Proteine ineinandergreifend – wie bei einem Reißverschluß - an spezifische komplementäre Proteine auf der Zielmembran an und lösen damit den Fusionsprozeß aus (Abbildung 2). Da eine Vielzahl derartiger Proteine existiert, diese aber nur in spezifischen Kombinationen miteinander wechselwirken können, ist gewährleistet, daß die Fusion nur an der richtigen Stelle erfolgt, die „Fracht“ punktgenau an der korrekten Adresse entladen wird.
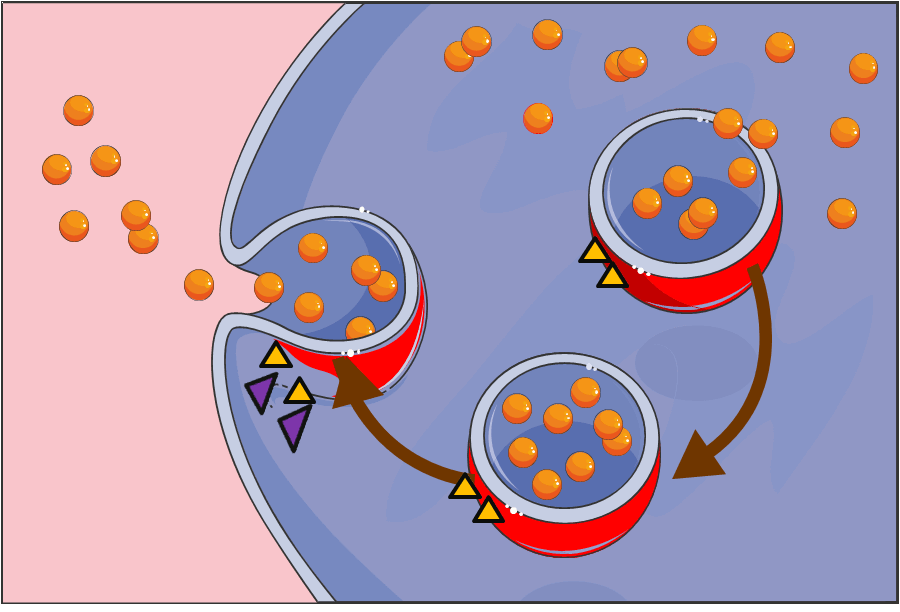 Abbildung 2. Schematische Darstellung des Vesikeltransports (Vesikel: rot, Molkül-Fracht: orange) und ihrer Fusion mit der Zellmembran (Bild modifiziert nach Servier Medical Art).
Abbildung 2. Schematische Darstellung des Vesikeltransports (Vesikel: rot, Molkül-Fracht: orange) und ihrer Fusion mit der Zellmembran (Bild modifiziert nach Servier Medical Art).
Ein sehr wichtiges Ergebnis zeigte, dass einige der Gene, die Schekman in der Hefe entdeckt hatte, mit denen korrespondierten, die Rothman in den Säugetierzellen identifizierte, daß also das vesikuläre Transportsystem bereits sehr früh in der Geschichte des irdischen Lebens entstanden war und über die Evolution beibehalten wurde.
Wie erfolgt das präzise Timing der Vesikel-Fusion?
Der Biophysiker Thomas C. Südhof (Stanford University, CA) setzt sich seit 3 Jahrzehnten mit der Signalübertragung der Nervenzellen auseinander. Die präzise und überaus rasche (in Millisekunden stattfindende) Weiterleitung der Signale ist die Grundlage jedweder Informationsverarbeitung in unserem Gehirn, also unseres Bewusstseins, unserer Emotionen, unseres Verhaltens.
Neuronen kommunizieren mit Hilfe von Botenstoffen, den Neurotransmittern (z.B. Dopamin, Acetycholin), über ihre Synapsen hinweg (d.i. den Kontakten zwischen dem knollenartigen Terminal des langen „Leitungskabels“ (Axon) einer Nervenzelle und den ebenfalls knolligen Terminals der verästelten Fortsätze (Dendriten) der Nachbarzelle). Ein elektrischer Impuls, der entlang des „Kabels“ läuft, bewirkt die Freisetzung der am Terminal in den Vesikeln gespeicherten Neurotransmitter, die dann über den Zwischenraum (dem synaptischen Spalt) hinweg an spezifischen Rezeptoren des Terminals der Nachbarzelle binden und damit deren Erregung auslösen (Abbildung 3).
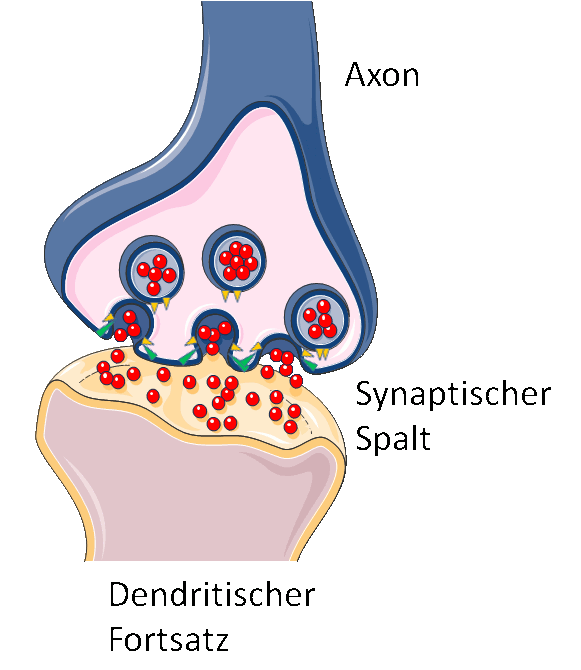 Abbildung 3. Signaltransfer an den Synapsen der Nervenzellen. Fusion der Vesikel mit der Membran des Terminals einer Nervenzelle und Sekretion der „Molekülfracht“ (rot) in den synaptischen Spalt (vereinfachte Darstellung, Bild modifiziert nach Servier Medical Art).
Abbildung 3. Signaltransfer an den Synapsen der Nervenzellen. Fusion der Vesikel mit der Membran des Terminals einer Nervenzelle und Sekretion der „Molekülfracht“ (rot) in den synaptischen Spalt (vereinfachte Darstellung, Bild modifiziert nach Servier Medical Art).
Südhof und seine Gruppe haben in den letzten dreissig Jahren den molekularen Mechanismus aufgeklärt, der die überaus rasche Fusion der Vesikel mit der Zellmembran des Terminals und die darauf folgende Freisetzung der Neurotransmitter auslöst: Durch das elektrische Signal werden kurzfristig Calciumkanäle geöffnet, durch welche Calcium von außen in das Terminal einströmt. Dies bewirkt, daß Proteine an der Oberfläche der Vesikel so nahe an korrespondierende Proteine an der Membran des Terminals gebracht werden, daß sie ineinandergreifend andocken und damit die Fusion auslösen.
Ähnliche Proteine wurden später entdeckt, die eine analoge Rolle in anderen physiologischen Vorgängen spielen – das Spektrum reicht von der Hormonsekretion (z.B.von Insulin) über die den Fertilisation von Eizellen bis hin zu den Vorgängen der Immunabwehr von Erregern.
Fazit
Die diesjährigen Nobelpreisträger haben mit unterschiedlichen Ansätzen den fundamentalen Prozeß des Vesikeltransports aufgeklärt, der für viele physiologische Vorgänge und in allen höheren Lebewesen Gültigkeit hat. Störungen in diesem Prozeß führen beim Menschen zu Erkrankungen des Nervensystems, des Immunsystems, des Hormonsystems (z.B. Diabetes). In der Presseaussendung des Nobel Assemblies heißt es dazu [3]:
“Without this wonderfully precise organization, the cell would lapse into chaos.”
[1] Bekanntmachung der Preisträger: Video 8 min http://www.nobelprize.org/mediaplayer/index.php?id=1949
[2] Scientific Background: http://www.nobelprize.org/nobel_prizes/medicine/laureates/2013/advanced-...
[3] Presse-Aussendung des Nobelpreis Komittees: http://www.nobelprize.org/nobel_prizes/medicine/laureates/2013/press.html
Weiterführende Links
The science behind Thomas Südhof's Nobel prize. http://med.stanford.edu/ism/2013/october/nobel-explainer-1007.html
Rothman Laboratory http://medicine.yale.edu/cellbio/rothman/index.aspx
Schekman Laboratory http://mcb.berkeley.edu/labs/schekman/index.html