Brennstoffzellen: Knallgas unter Kontrolle
Brennstoffzellen: Knallgas unter KontrolleDo, 02.12.2021 — Roland Wengenmayr
 Brennstoffzellen ermöglichen die direkte Umwandlung von chemischer Energie in elektrische Energie. Verglichen mit der von fossilen Brennstoffen ausgehenden Stromerzeugung haben Brennstoffzellen dementsprechend einen sehr hohen Wirkungsgrad. Die im folgenden Artikel beschriebene Zelle verwendet kontinuierlich zuströmenden Wasserstoff als Brennstoff, der Reaktionspartner ist Sauerstoff. Dabei entstehen Strom, Wasserdampf und Wärme. Wie diese Zelle funktioniert, wovon ihre Effizienz abhängt und wie sie praxistauglicher gemacht werden kann, erklärt der Physiker und Wissenschaftsjournalist DI Roland Wengenmayr*.
Brennstoffzellen ermöglichen die direkte Umwandlung von chemischer Energie in elektrische Energie. Verglichen mit der von fossilen Brennstoffen ausgehenden Stromerzeugung haben Brennstoffzellen dementsprechend einen sehr hohen Wirkungsgrad. Die im folgenden Artikel beschriebene Zelle verwendet kontinuierlich zuströmenden Wasserstoff als Brennstoff, der Reaktionspartner ist Sauerstoff. Dabei entstehen Strom, Wasserdampf und Wärme. Wie diese Zelle funktioniert, wovon ihre Effizienz abhängt und wie sie praxistauglicher gemacht werden kann, erklärt der Physiker und Wissenschaftsjournalist DI Roland Wengenmayr*.
„Houston, wir haben hier ein Problem.“ Mit dieser Meldung von Apollo 13 wurde die Brennstoffzelle schlagartig berühmt. Am 11. April 1970 war ein Sauerstofftank an Bord des Raumschiffs auf dem Weg zum Mond explodiert. Das Merkwürdige war, dass damit die Stromproduktion an Bord ausfiel. Was aber hat Sauerstoff mit elektrischer Energie zu tun? Die mitfiebernden Fernsehzuschauer erfuhren, dass eine „Brennstoffzelle“ aus Sauerstoff und Wasserstoff elektrischen Strom machte. Das Abfallprodukt war praktischerweise Trinkwasser für die Astronauten.
Die erste Brennstoffzelle bastelte 1838 Christian Friedrich Schönbein. Wasser kann man mit elektrischer Energie in Wasserstoff und Sauerstoff spalten, und diese Elektrolyse (Abbildung 1) drehte Schönbein um. Er steckte zwei Platindrähte in Salzsäure und umspülte den einen Draht mit Wasserstoff, den anderen mit Sauerstoff. Zwischen den Drähten konnte er eine elektrische Spannung messen. fast zur gleichen Zeit kam der Engländer Sir William Grove auf dieselbe Idee. Beide gelten heute als Väter der Brennstoffzelle. Welches Energiepotenzial eine Wasserstoff-Brennstoffzelle hat, vermittelt ein Schulversuch: Mischt man gasförmigen Wasserstoff mit Sauerstoff und entzündet dieses Knallgas, dann gibt es eine Explosion. Chemisch verbinden sich dabei jeweils zwei Wasserstoffatome mit einem Sauerstoffatom zu einem Wassermolekül. Dabei wird viel Energie als Wärme frei. eine Brennstoffzelle bringt diese heftige chemische Reaktion unter Kontrolle und zwingt sie, ihre Energie zum guten Teil in elektrisch nutzbarer Form abzugeben. Abbildung 1.
|
Abbildung 1: Knallgas unter Kontrolle |
Brennstoffzellen gehören, wie Batterien und Akkumulatoren, zu den elektrochemischen Zellen. Diese wandeln chemische Energie in elektrische Energie um. Akkus sind über den umgekehrten Prozess auch aufladbar. Im Unterschied zu Batterien müssen Brennstoffzellen permanent von außen mit den elektrochemisch aktiven Stoffen, Sauerstoff und Brennstoff, versorgt werden. Nur dann produzieren sie elektrische Energie.
Wie Batterien haben Brennstoffzellen zwei Elektroden, die über einen Elektrolyten Kontakt haben. Zusätzlich brauchen sie noch einen Anschluss für den Brennstoff, in der Regel reinen Wasserstoff. Durch eine weitere Öffnung müssen sie Sauerstoff aus der Luft aufnehmen können. Als Abgas entsteht in der Wasserstoff-Brennstoffzelle reiner Wasserdampf.
Die Elektroden der Zellen sind porös, damit Luft, der Brennstoff und das Abgas sie möglichst gut durchströmen können. Sie bestehen zum Beispiel aus mikroskopisch kleinen Kohlenstoffkörnern, die zusammengepresst sind. Diese Körnchen sind zusätzlich mit Katalysatorteilchen belegt, die ungefähr zehn Mal kleiner sind. als Reaktionsbeschleuniger spielt der Katalysator eine entscheidende Rolle. Wasserstoff-Brennstoffzellen benötigen hierfür Edelmetalle wie Platin, was teuer ist.
Das Team des Chemikers Klaus- Dieter Kreuer am Max-Planck-Institut für Festkörperforschung forscht an der Verbesserung von Niedertemperatur-Brennstoffzellen. Die Betriebstemperatur solcher Zellen liegt normalerweise unterhalb von 100 °C, dem Siedepunkt von Wasser unter Normaldruck. ihre kompakte Bauweise erlaubt enorme Leistungsdichten. im Gegensatz zu Hochtemperatur-Brennstoffzellen, die bei bis zu 1000 °c arbeiten, reagieren sie agil auf Lastwechsel, zum Beispiel beim Beschleunigen und Bremsen von Fahrzeugen. Das macht sie besonders geeignet für Elektroautos und elektrische Züge auf Strecken ohne Oberleitung.
Im Fokus von Kreuers Team steht ein zentrales Bauteil der Niedertemperatur-Brennstoffzellen: eine hauchdünne Kunststoffmembran. Diese muss beide Elektrodenräume der Brennstoffzelle effizient trennen. Deshalb heißen solche Zellen auch Polymermembran-Brennstoffzellen. „Heute sind solche Membranen bis zu zehn Mikrometer dünn“, erklärt Kreuer. Menschliches Kopfhaar ist grob zehnmal so dick. Da es an den bisher verwendeten Membranen noch Verbesserungsbedarf gibt, forschen die Stuttgarter Chemikerinnen und Chemiker seit vielen Jahren an neuen Membranmaterialien.
|
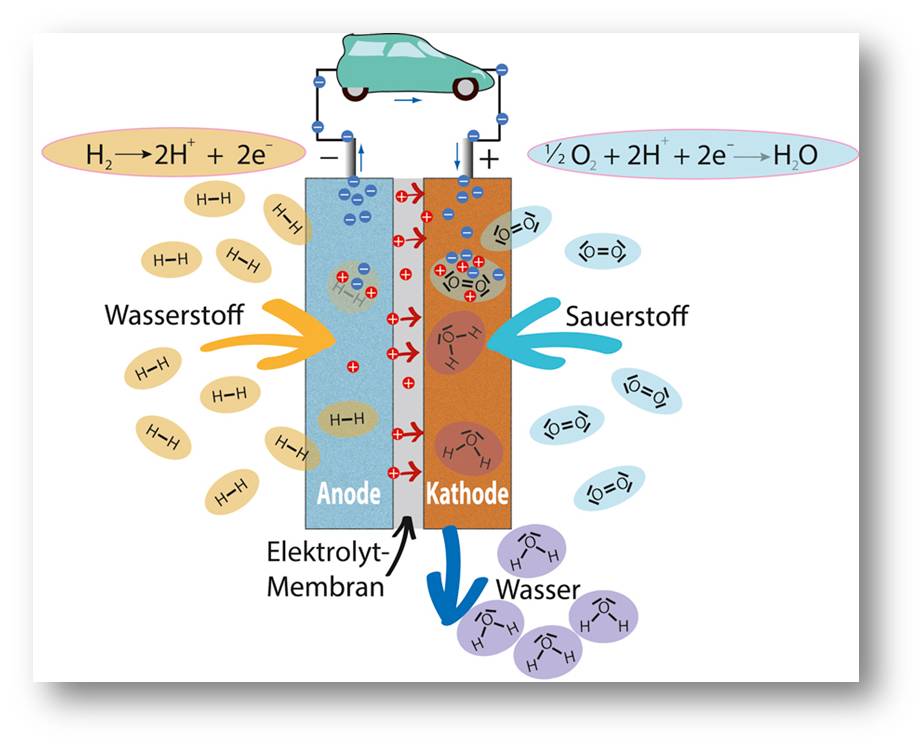
Abbildung 2: Grundprinzip der Wasserstoff-Niedertemperatur-Brennstoffzelle. In der Anode links wird das Wasserstoffgas H2 (H–H) in je zwei Protonen (H+, rot) und Elektronen (e–, blau) zerlegt. Die Elektronen fließen durch einen Verbraucher und leisten dort Arbeit. Die Protonen wandern durch die Membran als Elektrolyt in die Kathode (rechts). Dort treffen sie auf die vom Verbraucher kommenden Elektronen. Zusammen mit Sauerstoff ( O2) aus angesaugter Luft entsteht Wasser (H2O). © R. Wengenmayr / CC BY-NC-SA 4.0 |
Um zu verstehen, was eine solche Membran leisten muss, schauen wir uns zuerst an, wie eine Wasserstoff-Brennstoffzelle grundsätzlich funktioniert. In ihr laufen zwei einfache chemische Teilreaktionen ab, räumlich getrennt an den beiden Elektroden (Abbildung 2). An der Anode wird das Wasserstoffgas H2 elektrochemisch in zwei Wasserstoffatomkerne, also Protonen (H+), und zwei Elektronen (e–) zerlegt. Oxidation heißt eine solche Reaktion. Vom Anodenkontakt fließen die Elektronen (e–) durch den äußeren Stromkreis und leisten Arbeit. Sie treiben zum Beispiel den Elektromotor eines Autos an. Danach fließen sie über den Kathodenkontakt zurück in die Zelle. An der Kathode treffen die Elektronen wieder auf die Protonen. Über diese Elektrode saugt die Zelle auch Luft und damit Sauerstoff (O2) an. In der Kathode läuft die zweite Teilreaktion ab. Dabei wird das Sauerstoffmolekül an der Katalysatoroberfläche in zwei Sauerstoffatome zerlegt, die sich mit je zwei Protonen und zwei Elektronen zu Wassermolekülen (H2O) verbinden. Diese Teilreaktion stellt eine chemische Reduktion dar. Die Zelle gibt den reinen Wasserdampf zusammen mit überschüssiger Luft als Abgas ab. Theoretisch liefert so eine Zelle bei Raumtemperatur 1,23 Volt Spannung. Verluste durch elektrische Widerstände drücken diese aber in der Praxis unter 1 Volt.
Aber wie gelangen die Protonen in die Kathode? Hier kommt die Membran ins Spiel. Als Elektrolyt muss sie den Protonen eine möglichst gute Rennstrecke von der Anode zur Kathode bieten. Der Protonenstrom durch den Elektrolyten ist nämlich genauso hoch wie der Elektronenstrom durch den Verbraucher. Zugleich muss die Membran verhindern, dass Elektronen direkt durch die Zelle fließen – sie ist also ein Elektronen-Isolator. Ein elektronischer Kurzschluss in ihr wäre gefährlich. Außerdem sollen die Elektronen im Stromkreis außerhalb der Zelle Arbeit leisten. Also muss dieser äußere Stromkreis die Elektronen gut leiten. Dafür sorgen Metalle wie Kupfer in den Kabeln und zum Beispiel Motorwicklungen. Solche Metalle leiten wiederum keine Protonen, wirken also umgekehrt als Protonen-Isolatoren.
Je wärmer, desto effizienter
Gegenüber konventionellen Verbrennungsmotoren bieten Elektrofahrzeuge mit Brennstoffzellen prinzipielle Vorteile. Reine Wasserstoff-Brennstoffzellen emittieren kein klimaschädliches Kohlenstoffdioxid (CO2), wenn der Wasserstoff mit erneuerbaren Energiequellen erzeugt wurde. Das kann etwa mit überschüssigem Strom aus Windenergie- oder Photovoltaikanlagen geschehen. Damit zerlegt eine Elektrolyseanlage Wasser zu Wasserstoff und Sauerstoff. Es gibt auch die Möglichkeit, Brennstoffzellen mit Methanol zu betreiben, dann arbeiten sie aber nicht CO2-frei. Zudem muss das Methanol zu Wasserstoff und CO2 zersetzt werden, was den technischen Aufwand erhöht. Ein weiterer Vorteil der Brennstoffzelle ist ihr hoher Wirkungsgrad, der sich noch steigern lässt. Grob die Hälfte der im Treibstoff chemisch gespeicherten Energie könne eine moderne Niedertemperatur-Brennstoffzelle in nutzbare elektrische Energie umwandeln, erklärt Kreuer. Wegen weiterer Verluste, wie durch die Kompression des Wasserstoffs im Drucktank, sind es am Ende aber nur etwa 40 Prozent. Das ist zwar immer noch viel besser als Dieselfahrzeuge mit rund 25 Prozent Wirkungsgrad.
Doch dieser Vorsprung in der Effizienz und die Klimafreundlichkeit reichen noch nicht, um die Nachteile auszugleichen: Noch sind die Herstellungskosten hoch, und die Infrastruktur für den Wasserstoff von der Herstellung bis zur Tankstelle fehlt bislang. Wären Niedertemperatur-Brennstoffzellen noch effizienter und kostengünstiger, dann könnten sich Brennstoffzellenautos leichter durchsetzen. Eine Lösung bietet die Erhöhung der Betriebstemperatur. Je wärmer eine Zelle ist, desto schneller laufen die elektrochemischen Prozesse in ihr ab. Das steigert ihre Effizienz. Auf der anderen Seite ist eine zu hohe Temperatur gefährlich für die Zellen. Je nach Hersteller wird die Kunststoffmembran spätestens bei 100 °C weich und verliert durch Austrocknen einen Teil ihrer Protonenleitfähigkeit. In der Zelle entsteht auch Abwärme, die der Wasserdampf als Abgas nicht ausreichend nach außen abführt. Deshalb brauchen Niedertemperatur-Brennstoffzellen ein aufwendiges Kühlsystem. Eine höhere Arbeitstemperatur würde das vereinfachen. Zudem würde sie die Menge an teurem Platin als Katalysator reduzieren, weil die Reaktion besser abliefe. Das würde die Kosten eines Brennstoffzellensystems spürbar senken.
Die neue Stuttgarter Membran
Kreuers Team forscht deshalb an alternativen Kunststoffmaterialien. Vor einigen Jahren gelang ihm die Entwicklung einer Kunststoffmembran, die Temperaturen bis zu 180 °C aushält. Zudem verhindert sie viel effizienter, dass gasförmiger Wasserstoff und Sauerstoff durchdringen. Kommen diese auf den Katalysatoren zusammen, dann reagieren sie dort zu aggressiven Radikalen. „Die greifen die Membran an“, erklärt Kreuer. Noch vor etwa 15 Jahren hat das die Lebensdauer der Brennstoffzellen auf unter 2000 Stunden begrenzt. Heute werden Radikalfänger eingebaut, was die Lebensdauer auf praxistaugliche 10000 Stunden steigert.
Das Urmaterial der Membranen heißt Nafion. Damit sind alle heute eingesetzten Membranen chemisch verwandt. Entwickelt wurde das Material bereits in den 1960er- Jahren von amerikanischen Chemikern. Sie zwangen damals zwei gegensätzliche Partner zu einem Molekül zusammen: Teflon und Sulfonsäure. Teflon ist extrem wasserabweisend, hydrophob, während die Sulfonsäuregruppe extrem wasserliebend, hydrophil, ist. Sie wird in dem neuen Molekül zur Supersäure. Eine Supersäure ist stärker als konzentrierte Schwefelsäure.
|
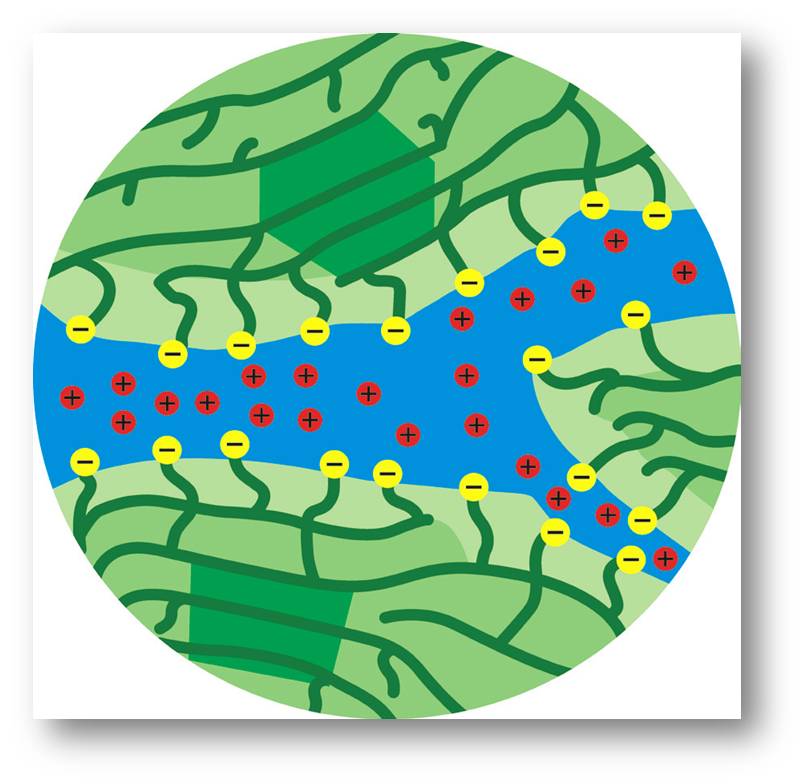
Abbildung 3: Mikrostruktur einer Nafion-Membran. Grün sind die hydrophoben Molekülketten, gelb die hydrophilen Supersäuren (Sulfonsäuregruppen), blau: Wasser, rot: positiv geladene Protonen. © MPI für Festkörperforschung / CC BY-NC-SA 4.0 |
Da sich beide ungleichen Partner eigentlich heftig abstoßen, organisieren sich die hydrophoben Teile der Moleküle zu einem feinen Netzwerk (Abbildung 3). Die Säuregruppen zwingen sie dabei an die Oberfläche dieses Netzwerks. In der Gegenwart von Wasser lagern die Säuregruppen Wassermoleküle an und bilden so eine Wasserstruktur, die sich durch das gesamte Netzwerk zieht. Wie alle Brønsted-Säuren geben diese Supersäuren liebend gerne Protonen an Wasser ab. Damit wird das feinverteilte Wasser in der Membran protonenleitend. Für den effizienten Betrieb in der Brennstoffzelle braucht die Membran einen optimalen Wassergehalt.
Allerdings hat der Teflonanteil im Nafion zwei Nachteile. Erstens ist er als Fluorchlorkohlenwasserstoff nicht umweltfreundlich. Zweitens sorgt diese chemische Struktur dafür, dass Nafion schon bei relativ niedrigen 80 °C kritisch weich wird. Modernere Varianten sind zwar temperaturstabiler, aber spätestens bei 100 °C ist Schluss. Die viel temperaturstabilere Stuttgarter Membran basiert auf einem umweltfreundlicheren Kohlenwasserstoff: Polyphenylen besteht als Polymer aus langen Ketten einzelner Phenylmoleküle. Jeder Grundbaustein (Monomer) enthält ebenfalls eine Sulfonsäuregruppe (Abbildung 4). Allerdings ist das Polymer viel steifer als Nafion. Damit können sich das Polymernetzwerk und der wässrige Teil mit den Ionen schlechter voneinander trennen. Als Folge lagern sich die Säuregruppen weniger gut zusammen. Das glich Kreuers Team durch einen Trick aus: sie bauten in das Material viel mehr Sulfonsäuregruppen ein, als Nafion enthält. Damit erreichten sie sogar eine höhere Leitfähigkeit für Protonen als im Nafion.
|
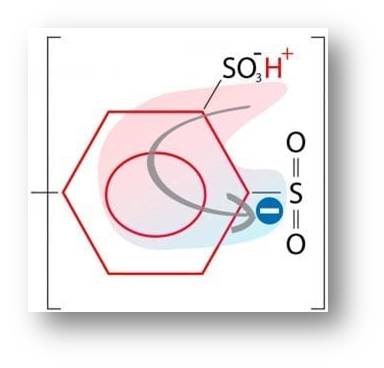
Abbildung 4: Ein Monomer-Baustein aus der Polymerkette des neuen Stuttgarter Membrankunststoffs. Rechts oben: Sulfonsäuregruppe. Sie wird zur protonenspendenden Supersäure, weil die SO2-Gruppe (rechts) über den Phenylring (Mitte) elektronische Ladung (blauer Punkt mit Minus) teilweise anzieht. Das lockert das Proton (H+) in der Sulfonsäuregruppe, das sich leicht lösen kann. © MPI für Festkörperforschung, R. Wengenmayr / CC BY-NC-SA 4.0 |
Eine große Gefahr im Betrieb von Polymermembran-Brennstoffzellen besteht darin, dass die Membran trockenfällt oder zu stark geflutet wird. Muss die Zelle dann volle Leistung bringen, altert das Membranmaterial vorzeitig. Das soll ein Diagnosesystem verhindern, das ein Team von Tanja Vidakovic-Koch am Max-Planck-Institut für Dynamik komplexer technischer Systeme in Magdeburg entwickelt hat. Herkömmliche Diagnosemethoden schicken elektrische Signale durch die Elektroden in die Brennstoffzelle und messen deren elektrische „Antwort“. Diese zeigt, ob es der Zelle gut geht oder ob sie ein Wasserproblem hat.
„Man kann aber nicht unterscheiden, ob die Membran ausgetrocknet oder geflutet ist“, erklärt die Ingenieurin. Mit der neuen Diagnosemethode gelingt das nun. Dazu rüsten die Magdeburger die Zelle mit einem Sensor aus, der den Fluss von Sauerstoff in sie hinein aufzeichnet. Aus den Messdaten bestimmt das Diagnosesystem auch den Fluss des Wassers durch die Zelle hindurch. Um deren Gesundheitszustand zu erfassen, braucht es noch einen Trick: Der Fluss von Sauerstoff und Wasser in die Zelle hinein muss wellenförmig an- und abschwellen.
Diese Wellen sind zum Beispiel sinusförmig. Die Brennstoffzelle reagiert darauf wie ein Musikinstrument: Je nach Frequenz schwächt oder verstärkt sie das Eingangssignal wie ein Resonanzkörper in ihrer elektrischen Antwort. Diese unterscheidet sich nun für die Fälle „zu trocken“ und „zu nass“. Damit könnte ein zukünftiges Diagnosesystem an Bord eines Autos automatisch erfassen, wie es der Brennstoffzelle geht. Erkenne es einen kritischen Zustand früh genug, dann ließen sich sogar anfängliche Schäden in der Membran „ausheilen“, erklärt die Wissenschaftlerin.
Optimal für schwere Elektrofahrzeuge
|
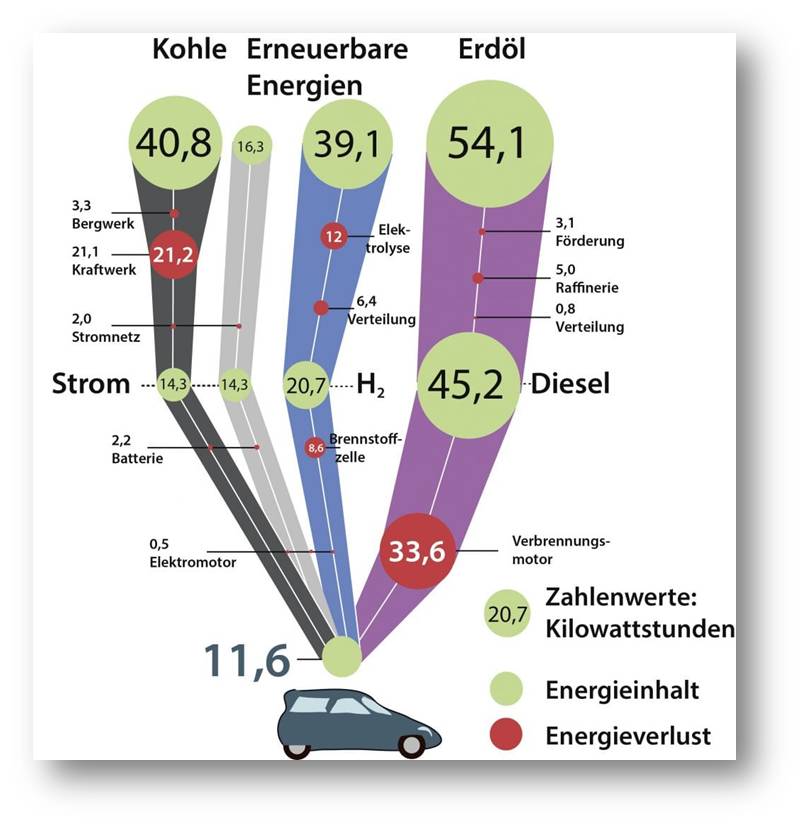
Abbildung 5: Von oben nach unten: Energiewandlungsketten vom Rohstoff zu der Energiemenge (11,6 kWh), die nötig ist, um das Auto 100 km weit fahren zu lassen. Aus erneuerbaren Energiequellen stammen der Wasserstoff (blaue Kette) und der Strom (hellgraue Kette). Je größer die oben eingekreiste Energiemenge ist, desto größer sind die Verluste. © Verändert nach: Gregor Hagedorn / CC BY 4.0; Daten: WELL-TO-WHEELS Report Version 4.1 European Commission, 2014 |
Im Verkehr haben Brennstoffzellen auch scharfe Konkurrenz durch die Batterie. Beide Systeme haben Vor- und Nachteile. In Brennstoffzellenautos wird das Wasserstoffgas in einem soliden Drucktank bei 700 bar gespeichert, der gegen Unfälle abgesichert ist. In diesem Zustand hat Wasserstoff eine fast 200 -mal höhere Energiedichte als Lithiumionen-Batterien. Auch wenn man das Gewicht des Drucktanks hinzurechnen muss, schleppt aber ein Elektroauto ein viel höheres Batteriegewicht im Verhältnis zur gespeicherten Energiemenge mit sich. Als Vorteil wiederum kann es Strom ohne größere Verluste speichern.
Für die Brennstoffzelle hingegen muss der Strom erst elektrolytisch Wasserstoff herstellen (Abbildung 5). Dieser muss dann wieder in der Brennstoffzelle elektrische Energie erzeugen. „Wegen dieses Umwegs ist der Wirkungsgrad vom Windrad bis hin zum Rad am Fahrzeug um den Faktor zwei- bis dreimal niedriger als beim Batteriefahrzeug“, erklärt Kreuer.
Diese Vor- und Nachteile hängen aber von der Größe und dem Gewicht beider Typen von Elektrofahrzeugen ab. Bei einem LKW wiegt eine Batterie, die brauchbare Reichweiten ermöglicht, viele Tonnen. Diese „tote“ Masse muss ein Brennstoffzellen- LKW nicht mitschleppen, außerdem braucht er kein so dichtes Wasserstoff-Tankstellennetz wie PKW. Busse, Bahn und LKW könnten also der Brennstoffzelle zum Durchbruch verhelfen.
* Der Artikel ist in aktualisierter Form unter dem Titel: "Knallgas unter Kontrolle - Brennstoffzellen für den breiten Einsatz fit gemacht" in TECHMAX 16 der Max-Planck-Gesellschaft erschienen, https://www.max-wissen.de/max-hefte/techmax-16-brennstoffzelle/ und steht unter einer CC BY-NC-SA 4.0 Lizenz. Der Artikel ist hier ungekürzt wiedergegeben.
Weiterführende Links
- Tuning für Brennstoffzelle: MPGVideo 9:44 min.
- Brennstoffzelle und Elektrolyse, MPG, Video 4:56 min.
Artikel im ScienceBlog:
- Redaktion, 19.09.2019: Umstieg auf erneuerbare Energie mit Wasserstoff als Speicherform - die fast hundert Jahre alte Vision des J.B.S. Haldane