Personalisierte Medizin: Die CAR-T-Zelltherapie
Personalisierte Medizin: Die CAR-T-ZelltherapieDo, 11.04.2019 - 07:06 — Norbert Bischofberger

![]() Die CAR-T-Zelltherapie ist eine auf den individuellen Patienten zugeschnittene Behandlungsform, welche mit einem gentechnisch modifiziertem T-Zellrezeptor (CAR) die Fähigkeit menschlicher T-Zellen zur Erkennung und Eliminierung von Tumorzellen verstärkt. Seit den ersten klinischen Erfolgen vor rund sieben Jahren und der kürzlich erfolgten Markteinführung von zwei CAR-Konstrukten (Kymriah™ von Novartis und Yescarta® von KitePharma/Gilead) haben klinische Studien über sensationelle Heilungen von bereits austherapierten Patienten mit rezidivierenden Leukämien und Lymphomen berichtet. Der Chemiker Norbert Bischofberger (ehem. Forschungsleiter des Top Pharmakonzerns Gilead, jetzt Präsident des Startups Kronos Bio ) berichtet über das neue immunologische Prinzip dieser Tumortherapie.*
Die CAR-T-Zelltherapie ist eine auf den individuellen Patienten zugeschnittene Behandlungsform, welche mit einem gentechnisch modifiziertem T-Zellrezeptor (CAR) die Fähigkeit menschlicher T-Zellen zur Erkennung und Eliminierung von Tumorzellen verstärkt. Seit den ersten klinischen Erfolgen vor rund sieben Jahren und der kürzlich erfolgten Markteinführung von zwei CAR-Konstrukten (Kymriah™ von Novartis und Yescarta® von KitePharma/Gilead) haben klinische Studien über sensationelle Heilungen von bereits austherapierten Patienten mit rezidivierenden Leukämien und Lymphomen berichtet. Der Chemiker Norbert Bischofberger (ehem. Forschungsleiter des Top Pharmakonzerns Gilead, jetzt Präsident des Startups Kronos Bio ) berichtet über das neue immunologische Prinzip dieser Tumortherapie.*
Ein kurzer Abriss der Krebstherapien
Lässt man die Behandlungsmethoden von Krebserkrankungen Revue passieren, so nahm die Chemotherapie in den 1940er Jahren ihren Anfang. Der erste Vertreter dieser Therapieform war Chlormethin - ein sogenannter Stickstofflost, der gleichermaßen gesunde wie entartete Zellen tötete (und ursprünglich als Kampfstoff entwickelt worden war; Anm. Redn). Zu einem Ersetzen der völlig unspezifisch wirkenden Substanzen kam es dann erst in den 1990er Jahren , mit sogenannten "Targeted Therapies" - zielgerichteten Ansätzen, in denen man Antikörper direkt gegen spezifische (übermäßig exprimierte) Moleküle auf der Oberfläche der Tumorzelle richtete, welche diese zur Teilung, zu unkontrolliertem Wachstum und zur Metastasierung anregen. Beispiele sind Antikörper wie Avastin, welcher die Angiogenese (Bildung neuer Blutgefäße) und damit die Versorgung des Tumors mit Sauerstoff und Nährstoffen blockiert, sowie Antikörper gegen den Rezeptor des Epithelialen Wachstumsfaktors (EGF), der eine zur Zellteilung führende Signalkaskade in den Tumorzellen auslöst.
Mit zunehmenden Einblicken in die Tumorbiologie kam es im letzten Jahrzehnt zu beachtlichen therapeutischen Fortschritten. Um 2010 wurden die ersten "Checkpoint Inhibitoren" eingeführt. Es werden dabei sogenannte Checkpoints des Immunsystems blockiert, an denen Tumorzellen die Immunantwort des Wirts abschalten können. Diese Checkpoint-Inhibitoren sind also Immunstimulantien; sechs derartige Medikamente - es sind Antikörper - sind in den US und auch in Europa zugelassen. Für ihre bahnbrechenden Arbeiten, die ein ganz neues Verfahren der Krebsbehandlung begründet haben, wurden James P. Allison und Tasuku Honjo mit dem Nobelpreis 2018 für Medizin ausgezeichnet. Die aktuelle, jüngste Entwicklung ist eine personalisierte, also für den Patienten maßgeschneiderte (individualisierte) Zelltherapie. Es ist eine Immuntherapie, bei der T-Lymphozyten (kurz T-Zellen) eines Patienten im Labor gentechnisch so verändert werden, dass sie spezielle Oberflächenproteine auf den Krebszellen erkennen und -in den Patienten zurückinfundiert - eine Immunantwort auslösen, die zur Zerstörung der Krebszellen führt. Zwei derartige Behandlungsformen - sogenannte CAR-T-Zelltherapien - wurden kürzlich in den USA und auch in der EU (im August 2018) zugelassen: Kymriah™(Novartis) zur Behandlung von akuter lymphatischer Leukämie bei Kindern und jungen Erwachsenen bis 25 Jahren und Yescarta® (Kite Pharma/Gilead) zur Behandlung erwachsener Lymphom-Patienten.
Wie erkennen T-Zellen aber Tumorzellen und zerstören diese dann?
Dazu müssen zwei Wechselwirkungen erfolgen, die Signale in der T-Zelle auslösen. Erst beide Wechselwirkungen zusammen führen zur Aktivierung der T-Zelle und diese zerstört in Folge die Tumorzelle (Abbildung 1).
- Signal 1: Der sogenannte T-Zell-Rezeptor (TCR), ein auf der Oberfläche der T-Zelle verankerter, aus mehreren Proteinen bestehender Komplex, erkennt ein Tumor-spezifisches Antigen (ein Peptid, das auf der Tumorzelle präsentiert wird) und bindet daran. Dies reicht aber zur Aktivierung der T-Zelle noch nicht aus.
- Signal 2: Es wird ein sogenanntes kostimulatorisches Signal benötigt, das durch Bindung des Oberflächenproteins CD28 der T-Zelle an das Protein CD80 auf der Tumorzelle bewirkt wird.
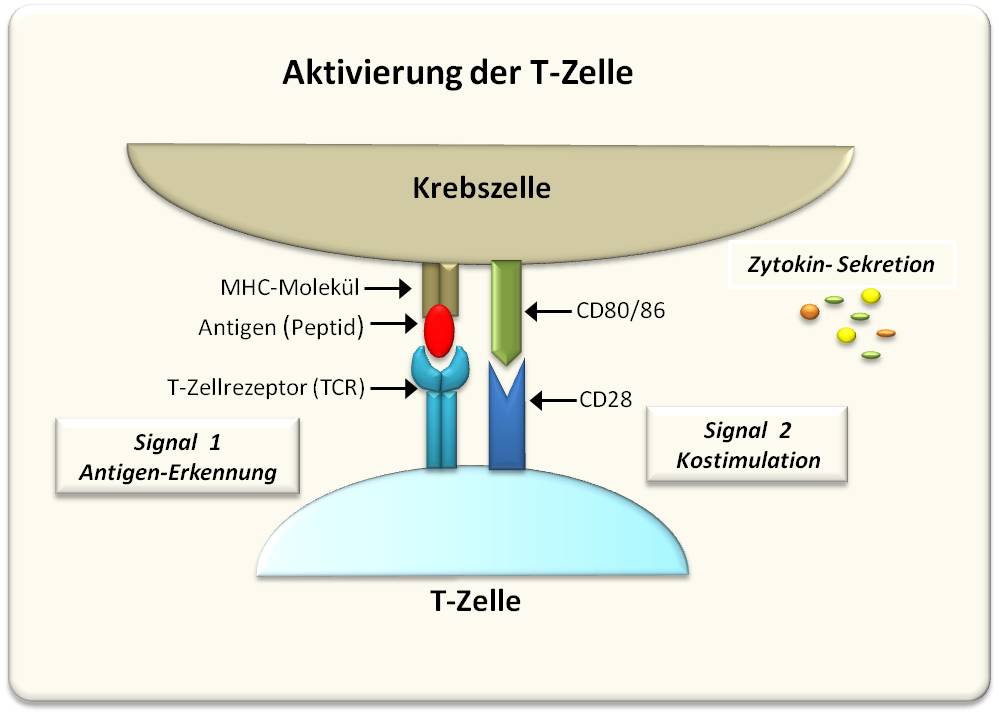 Abbildung 1. Die Aktivierung der T-Zelle benötigt 2 Signale. Die Bindung des an der Oberfläche der Tumorzelle präsentierten Antigens an den T-Zellrezeptor löst das erste Signal aus. Ein zweites, kostimulatorisches Signal wird durch die Wechselwirkung des Oberflächenproteins CD28 mit CD80 (CD86) auf der Tumorzelle generiert .In Folge werden Zytokine freigesetzt, welche die Immunantwort steuern.
Abbildung 1. Die Aktivierung der T-Zelle benötigt 2 Signale. Die Bindung des an der Oberfläche der Tumorzelle präsentierten Antigens an den T-Zellrezeptor löst das erste Signal aus. Ein zweites, kostimulatorisches Signal wird durch die Wechselwirkung des Oberflächenproteins CD28 mit CD80 (CD86) auf der Tumorzelle generiert .In Folge werden Zytokine freigesetzt, welche die Immunantwort steuern.
Vom T-Zellrezeptor (TCR) zum Chimären Antigenrezeptor (CAR)
Der TCR ist ein Komplex aus mehreren unterschiedlichen Proteinen (Abbildung 2a). Aus dem TCR wird ein sogenannter chimärer Antigenrezeptor" - CAR -erzeugt, indem die intrazelluläre Domäne aus dem TCR, die sogenannte Zeta-Domäne, mit einem Fragment aus der variablen Domäne eines Antikörpers kombiniert wird, das ein möglichst nur auf der Tumorzelle vorkommendes Antigen spezifisch bindet.
Anfängliche Versionen von so generierten CAR-T-Zellen waren allerdings wenig erfolgreich. Dies änderte sich erst als man erkannte, dass die kostimulatorische Domäne wichtig ist; man fügte die CD28- Domäne (und/oder auch die kostimulatorische Domäne 4-1BB) in den chimären Rezeptor ein. CAR-T-Zellen der 3. Generation arbeiten nun mit zwei kostimulatorischen Domänen; dadurch wird die Aktivierung der T-Zellen verstärkt. Die chimären Rezeptoren vereinigen also beide Funktionen: spezifische Antigen Bindung und T-Zell Aktivierung in einem Molekül (Abbildung 2B).
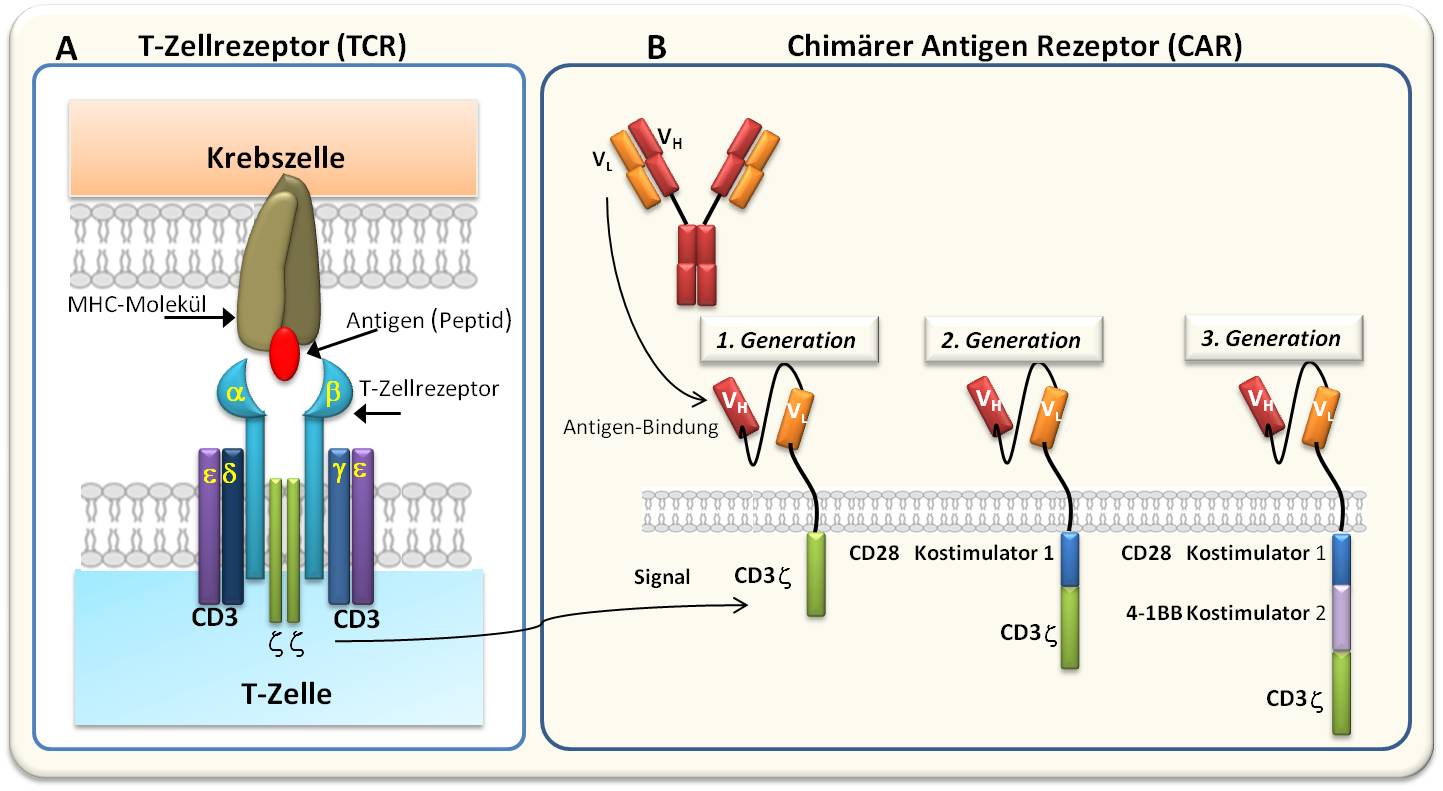 Abbildung 2. Vom T-Zellrezeptor zum chimären Antigenrezeptor (CAR). Das Design des CAR enthält eine extrazelluläre Domäne, welche mittels Antikörperfragmenten VL und VH ein auf der Tumorzelle präsentiertes Antigen spezifisch bindet, eine Transmembransequenz, die für die Verankerung in der Zellmembran verantwortlich ist und eine intrazelluläre Signalsequenz, welche die Aktivierung der T-Zelle auslöst.
Abbildung 2. Vom T-Zellrezeptor zum chimären Antigenrezeptor (CAR). Das Design des CAR enthält eine extrazelluläre Domäne, welche mittels Antikörperfragmenten VL und VH ein auf der Tumorzelle präsentiertes Antigen spezifisch bindet, eine Transmembransequenz, die für die Verankerung in der Zellmembran verantwortlich ist und eine intrazelluläre Signalsequenz, welche die Aktivierung der T-Zelle auslöst.
Der Beginn eines Erfolgs
Wie viele Dinge in der Medizin und in der Wissenschaft fing es mit einem Zufall an. Emily Whitehead, ein kleines Mädchen in Pennsylvania litt an der bei Kindern häufigsten Krebserkrankung, der akuten lymphatischen Leukämie (ALL). ALL ist mit Chemotherapie recht gut behandelbar, 85 % der Patienten sprechen darauf an und in den meisten Fällen bleibt ALL eine Kinderkrankheit. Für die 15%, die nicht darauf ansprechen, ist die Prognose allerdings sehr schlecht. Emily Whitehead gehörte zu diesen Unglücklichen; nach mehreren von Rückfällen gefolgten Zyklen Chemotherapie wurde ihr - wie so oft in der Medizin -empfohlen- nach Hause zu gehen, weil man nichts mehr für sie tun könne.
Die Eltern gaben aber nicht auf. Sie hörten von einer neuen Zelltherapie, die im Rahmen einer klinischen Studie am Cancer Center des Children Hospital of Philadelphia verfügbar war. Man ging dorthin, das Mädchen wurde mit der CAR-T -Zell Therapie behandelt und erlebte eine wundersame Genesung. (Seit mehr als 6 Jahren gilt sie als geheilt; Anm. Redn.)
Dazu gibt es allerdings eine Randbemerkung.
Derartige Zelltherapien sind nicht ohne Risiken, es kann sich ein lebensbedrohender Zustand daraus entwickeln. Das passierte auch in diesem Fall. Die Ärzte überwachten die Zytokinspiegel des Mädchens und beobachteten einen enormen Anstieg des sogenannten Interleukin 6 (IL-6; ein Schlüsselprotein in Entzündungsprozessen, Anm. Redn.). Durch puren Zufall hatte die Spitalsapotheke Tocilizumab - einen Antikörper gegen IL-6 - verfügbar, der eigentlich für die Behandlung von Rheumatoider Arthritis zugelassen ist. Damit konnte IL-6 blockiert und das Leben des Mädchens gerettet werden. Ohne einen solchen Antikörper wäre das Mädchen gestorben und mit ihm vermutlich das ganze neue CAR-TC-Gebiet.
Wie geht man in der CAR-T-Zelltherapie vor?
Diese Zelltherapie besteht aus fünf aufeinanderfolgenden Schritten, die in Abbildung 3 schematisch dargestellt sind. Erst wird das Blut eines Patienten abgenommen, einer Leukophorese unterzogen und es werden die T-Zellen isoliert (1). Dann wird das für ein Tumorantigen spezifische CAR-Konstrukt über einen Vektor in die DNA der T-Zellen eingebaut (2). Zellen, die nun an ihrer Oberfläche das CAR-Protein exprimieren werden anschließend in Kultur gebracht und vermehrt ("expandiert") (3) und schließlich in den Patienten infundiert (4). Hier binden die CAR-T-Zellen an die Tumorzellen und zerstören diese (5). (Da Abnahme des Bluts und Reinfundierung am selben Patienten erfolgen, spricht man von autologer T-Zelltherapie.)
 Abbildung 3. Personalisierte Krebstherapie: Wie T-Zellen verändert werden, sodass sie nun die Tumorzellen eines Patienten angreifen und zerstören. Die aufwendige, auf jeden Patienten zugeschnittene Herstellung der CAR-T-Zellenbedingt sehr hohe Therapiekosten: Das für ALL zugelassene Kymriah™(Novartis) wird um über 400 000 US$ gehandelt, Yescarta® (Kite Pharma/Gilead) zur Behandlung erwachsener Lymphom-Patienten mit rund 300 000 US$. (Bild und Text von der Redn.zugefügt; das Bild ist gemeinfrei und stammt aus: National Cancer Institute;CMS ID: 1126719; NCI Annual Plan and Budget Proposal FY 2020.)
Abbildung 3. Personalisierte Krebstherapie: Wie T-Zellen verändert werden, sodass sie nun die Tumorzellen eines Patienten angreifen und zerstören. Die aufwendige, auf jeden Patienten zugeschnittene Herstellung der CAR-T-Zellenbedingt sehr hohe Therapiekosten: Das für ALL zugelassene Kymriah™(Novartis) wird um über 400 000 US$ gehandelt, Yescarta® (Kite Pharma/Gilead) zur Behandlung erwachsener Lymphom-Patienten mit rund 300 000 US$. (Bild und Text von der Redn.zugefügt; das Bild ist gemeinfrei und stammt aus: National Cancer Institute;CMS ID: 1126719; NCI Annual Plan and Budget Proposal FY 2020.)
Erfolge der CAR-T-Zelltherapie bei malignen hämatologischen Erkrankungen
Sehr viele maligne hämatologische Erkrankungen - Lymphome, Leukämien - werden durch anormale B-Lymphozyten verursacht. B-Zellen, wie auch T-Zellen leiten sich von der lymphoiden Linie der auf eine Stammzelle zurückgehenden Blutzellen ab. (Die andere - myeloide - Linie generiert Granulozyten, Erythrozyten, Thrombozyten, Makrophagen und Mastzellen).
Betrachtet man die Differenzierung von B-Zellen - von der Stammzelle zur Plasmazelle - so findet man mit Ausnahme der Stammzelle das Oberflächenprotein CD19 auf der B-Zelle in allen Stadien der Differenzierung exprimiert. CD19 ist damit ein optimales Zielmolekül für CAR-T-Zellen - man will ja anormale B-Zellen und nicht die Stammzellen und damit das gesamte Knochenmark auslöschen.
In der CAR-T-Zell Therapie werden nun die isolierten T-Zellen eines Patienten mit einem gegen CD19 gerichteten CAR-Konstrukt (Anti-CD19-CAR) transfiziert, expandiert und dem Patienten dann wieder infundiert. Die Anti-CD19 T-Zellen erkennen die abnormen B-Zellen und töten sie ab.
Die bis jetzt mit CD19 CAR-T-Zellen erhobenen klinischen Ergebnisse an einer größeren Zahl von Patienten mit rezidivierter akuter lymphatischer Leukämie zeigen eine Therapie, die alles verändert: 80% der Patienten erreichen eine langfristige Remission (ich scheue mich das Wort Heilung zu verwenden); für Menschen, die sonst eine Lebenserwartung von durchschnittlich 3 Monaten gehabt hätten, ist dies ein Wunder.
Dass solche Zelltherapien nicht ohne Risiken sind, habe ich bereits erwähnt. Es gibt zwei Arten von lebensbedrohenden Nebenwirkungen: den sogenannten Zytokinsturm und schwerste neurotoxische Auswirkungen. In der Mehrzahl der Fälle lassen sich beide Nebenwirkungen beherrschen und sind dann reversibel - Ärzte haben gelernt, damit umzugehen. Die Häufigkeit solcher Nebenwirkungen hat sich seit den ersten Anwendungen der CAR-T-Zellen stark verringert.
Wie geht es weiter mit der T-Zell Therapie?
Die eigenen Immunzellen so modifizieren zu können, dass sie Krebszellen erkennen und effizient eliminieren, bedeutet eine Revolution in der Tumortherapie. Entsprechend intensiv wird an der Optimierung von CAR-Konstrukten für diverse Indikationen geforscht und mehrere Hundert klinische Studien mit CAR-T-Zellen sind in Planung und im Laufen. Abbildung 4.
Wesentliche Aspekte sind dabei Verbesserung und Kontrolle der T-Zellaktivierung, höhere Spezifität der T-Zellen, Verhinderung eines Entkommens der Tumorzellen, Reduktion der Nebenwirkungen und vor allem Ausweitung der Therapien auf solide Tumoren.
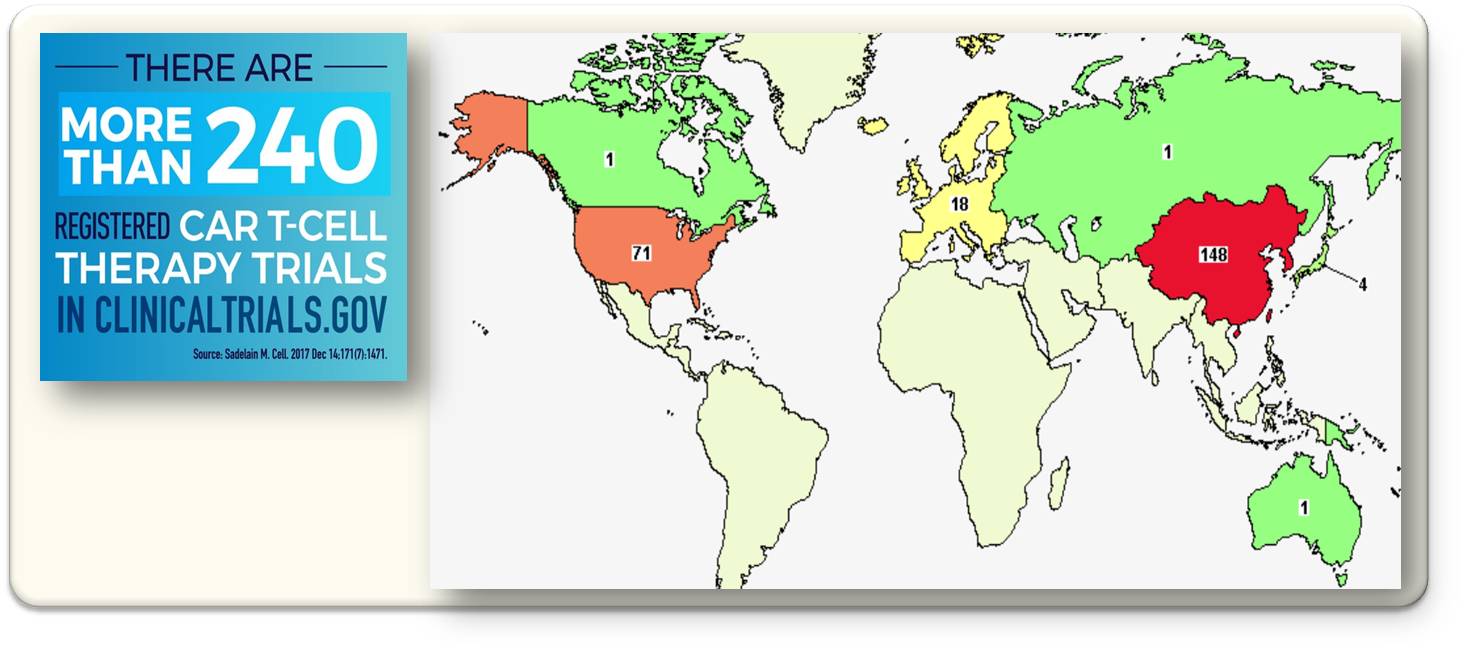 Abbildung 4. CAR T-Zell Therapie: Registrierte klinische Studien und wo diese stattfinden/ stattfanden. (Bild links: aus the NCI Annual Plan and Budget Proposal FY 2020; rechts: CAR-T-cell therapy - Results on Map - ClinicalTrials.gov. https://clinicaltrials.gov/ct2/results?cond=&term=CAR-T-cell+therapy&cntry=&state=&city=&dist=. gemeinfrei)
Abbildung 4. CAR T-Zell Therapie: Registrierte klinische Studien und wo diese stattfinden/ stattfanden. (Bild links: aus the NCI Annual Plan and Budget Proposal FY 2020; rechts: CAR-T-cell therapy - Results on Map - ClinicalTrials.gov. https://clinicaltrials.gov/ct2/results?cond=&term=CAR-T-cell+therapy&cntry=&state=&city=&dist=. gemeinfrei)
Anschalten der Aktivierung
Ein Problem der CAR-T-Zellen besteht darin, dass man die Kontrolle über sie verliert, sobald sie in den Patienten infundiert werden. Man kann gegen ihre schweren Nebenwirkungen vorgehen, aber man weiß nicht wirklich, was diese aktivierten Zellen tun. Eine Lösung dafür besteht darin das CAR-Konstrukt so zu organisieren, dass es erst in situ durch einen Schalter auf "on", d.i. auf Aktivierung der Zelle, gestellt werden kann. Technisch lässt sich dies so lösen, dass die beiden Domänen: extrazelluläre Domäne der Antigenerkennung und intrazelluläre Aktivierungsdomäne in der Zellmembran als separierte Fragmente vorliegen. Durch Zusatz von bestimmten bereits zugelassenen Arzneistoffen (beispielsweise funktionieren hier kleine Moleküle vom Typ des Rapamycin; Anm. Redn.) können die beiden Fragmente dann "vereinigt" - dimerisiert - und damit die CAR-T-Zellen aktiviert werden.
Erhöhung der Spezifität von CAR-T-Zellen
Ein erhebliche Limitierung für die CAR-T-Zelltherapie ist es ein Zielantigen zu finden, das ausschließlich auf der Tumorzelle vorkommt, aber auf keinem anderen der 200 Zelltypen des Menschen zu finden ist. Wird das Antigen auch auf einer normalen Zelle exprimiert, so kann dies zu schwersten Toxizitäten führen (wie beispielsweise im Fall einer Brustkrebspatientin, deren Tumor den Wachstumsfaktor HER-2 überexprimierte. Da HER-2 aber auch auf Lungenzellen vorkommt, griffen die CAR-T-Zellen auch diese Gewebe an und die Patientin starb an einem Lungenödem).
Eine mögliche Strategie ist hier in einer T-Zelle zwei unterschiedliche CAR gegen zwei verschiedene Tumorantigene zu exprimieren, wobei eine Aktivierung der T-Zelle nur dann eintritt, wenn beide Antigene auf der Tumorzelle exprimiert sind (die Bezeichnung dafür: AND-gate stammt aus der Halbleitertechnik).
Das ultimative Ziel: Immunotherapie solider Tumoren…
Solide Tumoren sind ungleich komplexer als maligne hämatologische Erkrankungen. Wenn man - z.B durch Abtasten oder durch Magnetresonanzuntersuchung - einen soliden Tumor feststellt, so hat dieser bereits einen Durchmesser in der Größenordnung von 2 cm, besteht aus über einer Milliarde Zellen, hat sich differenziert und ist viele Male mutiert (in vielen Tumoren bewegt sich die sich die Zahl der Mutationen zwischen 15 und 150 pro exprimiertem Gen; Anm. Redn). Geeignete Zielantigene zu identifizieren ist - wie oben erwähnt - sehr schwierig; auch können Krebszellen im Lauf der Differenzierung solche Antigene verlieren und damit der Immuntherapie entkommen.
Eine Möglichkeit besteht hier darin die Taktik zu nutzen, mit der unser körpereigenes Überwachungssystem - in Form patrouillierender T-Zellen - laufend normale und entartete Zellen erkennt und die entarteten eliminieren kann.
…via Erkennung von Neoantigenen
Diese Erkennung erfolgt über Fragmente - kurze Peptide -, die beim Abbau der zellulären Proteine entstehen und an der Oberfläche der Zellen gebunden an die Proteine des Haupthistokompatibilitätskomplex (MHC) präsentiert werden. Während der T-Zellrezeptor mit den aus körpereigenen Proteinen entstandenen Peptid-Komplex nicht interagiert (sogenannte Selbsttoleranz), bindet er an solche aus mutierten (und fremden) Proteinen und kann so die Zerstörung der entarteten Zelle einleiten. Solche Neoantigene sind also tumorspezifisch - nicht auf anderen Zelltypen anzutreffen - und damit als Zielmoleküle für das Design von effizienten CAR-Konstrukten ohne Organtoxizität besonders geeignet.
Der Weg zu solchen Konstrukten ist allerdings sehr aufwendig: Die Identifizierung des großen Repertoires an Mutationen erfolgt aus dem Tumormaterial des Patienten mittels hochsensitiver Sequenzierung (deep sequencing) des Exoms (d.i. dem Protein-kodierenden Teils des Genoms). Daraus werden dann mittels analytischer Verfahren (Massenspektrometrie) und auch durch in silico Methoden und Modellierungen solche Fragmente herausgefiltert, die wahrscheinlich als potente Neoantigene in Frage kommen, die dann in Funktionstests validiert werden.
Fazit: Mutationen, die zu Entstehung und Wachstum eines soliden Tumors führen, können also auch Zielstrukturen für die Immunzellen darstellen, um den Tumor in Schach zu halten.
* Dies ist der dritte Teil einer Artikelserie des Autors, die sich im Teil 1 "Auf dem Weg zu einer Medizin der Zukunft" mit dem sich abzeichnenden Paradigmenwechsel in der Medizin – Abgehen von Therapien nach dem Schema "Eine Größe passt allen" hin zu einer zielgerichteten, personalisierten Behandlung - befasst hat (24.05.2018:Auf dem Weg zu einer Medizin der Zukunft.). Teil 2 hat über Künstliche Intelligenz in biomedizinischer Forschung, Diagnose und Therapie berichtet (16.08.2018:Mit Künstlicher Intelligenz zu einer proaktiven Medizin) Über das gesamte Thema hat Norbert Bischofberger am 6. Dezember 2017 einen Vortrag "The future of medicine: Technology and personalized therapy" in der Österreichischen Akademie der Wissenschaften gehalten.
Weiterführende Links
Immunonkologie – Dr. Johannes Wimmer erklärt die CAR-T-Zell-Therapie 3:08 min.
Publikationen zur CAR-T-Zelltherapie:
https://www.creative-biolabs.com/car-t/references.aspx