Ein modifiziertes Poliovirus im Kampf gegen bösartige Hirntumoren
Ein modifiziertes Poliovirus im Kampf gegen bösartige HirntumorenDo, 02.11.2017 - 8:47 — Ricki Lewis

![]() Der als Vater der Immuntherapie geltende amerikanische Chirurg William Coley hat bereits vor mehr als hundert Jahren Krebspatienten mit bestimmten Bakterien ("Coley-Toxins") infiziert, worauf die einsetzende Immunantwort Tumoren zum Verschwinden bringen konnte. Über lange Zeit wurde diese, über die Stimulierung des Immunsystems verlaufende Strategie ignoriert und erst jüngst von Forschern der Duke University wieder aufgegriffen: diese konnten einige an fortgeschrittenem Glioblastom erkrankte Patienten mittels eines modifizierten Poliovirus erfolgreich behandeln. Wie dabei das Immunsystem stimuliert und zum Kampf gegen Tumorzellen umdirigiert wird, ist Gegenstand neuester Studien, welche die Genetikerin Ricki Lewis hier zusammenfasst..*
Der als Vater der Immuntherapie geltende amerikanische Chirurg William Coley hat bereits vor mehr als hundert Jahren Krebspatienten mit bestimmten Bakterien ("Coley-Toxins") infiziert, worauf die einsetzende Immunantwort Tumoren zum Verschwinden bringen konnte. Über lange Zeit wurde diese, über die Stimulierung des Immunsystems verlaufende Strategie ignoriert und erst jüngst von Forschern der Duke University wieder aufgegriffen: diese konnten einige an fortgeschrittenem Glioblastom erkrankte Patienten mittels eines modifizierten Poliovirus erfolgreich behandeln. Wie dabei das Immunsystem stimuliert und zum Kampf gegen Tumorzellen umdirigiert wird, ist Gegenstand neuester Studien, welche die Genetikerin Ricki Lewis hier zusammenfasst..*
Bestimmte Dinge haben eine natürliche Abfolge: so kommt das Frühstück vor dem Mittagessen, die Kindheit vor dem Erwachsenwerden, der Herbst vor dem Winter. Ich war deshalb überrascht als ich letzte Woche über Versuche an der Duke University gelesen habe, in denen man Krebs in menschlichen Zellen und in Mäusen mit einem manipulierten Poliovirus behandelt hat. Es hatte doch bereits im Jahr 2015 die TV News-Show "60 Minutes" über vier Patienten berichtet, deren Hirntumoren auf eben derartige Weise behandelt worden waren!
Finden denn präklinische Untersuchungen - an Zellkulturen und Tiermodellen - nicht vor den klinischen Untersuchungen am Menschen statt?
Ich begann zu recherchieren.
Der immunologische Background
Die Idee, eine gegen ein Pathogen gerichtete Immunantwort umzuleiten, um so Krebs zu bekämpfen, geht auf das späte 19. Jahrhundert zurück. Damals hatte William Coley, ein Arzt aus Manhattan, bemerkt, dass der Nackentumor eines Patienten geradezu dahin schmolz, als dieser sich eine schlimme Streptokokkeninfektion der Haut (ein Erysipel, Anm. Red.) zugezogen hatte. Nachdem Coley Beschreibungen mehrerer derartiger Fälle entdeckt hatte, begann er zu experimentieren indem er einigen Krebspatienten einen von Bakterien durchsetzten Schleim in Risse ihrer Haut rieb. Daraufhin schrumpften jedes Mal die Tumoren. Dieser Ansatz - unter Coley's Toxine bekannt - blieb aber viele Jahrzehnte lang unbeachtet.
Das Immunsystem hat zwei Verteidigungslinien
mit denen es Pathogene inklusive Viren und ebenso Krebszellen und transplantierte Zellen bekämpft:
- eine unmittelbare Antwort, die allgemeiner Art und angeboren ist und
- eine langsamere Antwort, die adaptiv und spezifischer ist.
Die Abwehr beginnt damit, dass ein Pathogen auf "Wächter"zellen (sogenannte Antigen-präsentierende Zellen) trifft, d.i. auf Makrophagen und dendritische Zellen. Diese Zellen sind an ihren Oberflächen mit Rezeptorproteinen (sogenannten Toll-like Rezeptoren) überzogen, die wie Klettverschlüsse an Moleküle unterschiedlicher Pathogene binden. Eine derartige Bindung löst nun Kaskaden von biochemischen Signalen aus, welche die angeborene Immunantwort starten: die Zellen schütten antivirale Moleküle aus (Komplement, Collectine, Interferone) und leiten die adaptive Immunantwort ein, welche T-Zellen triggert mehr Interferone auszuschütten und Antikörper produzierende B-Zellen zu aktivieren.
Gliazellen als Ausgangsort von Hirntumoren
Das Gewebe des Zentralnervensystems besteht aus den Nervenzellen (Neuronen) und den noch zahlreicheren Gliazellen. Abbildung 1. Eine Immuntherapie gegen Hirntumoren zielt auf die Gliazellen, speziell auf die sternförmigen Astrozyten, ab. Früher hatte man angenommen, dass Gliazellen nur dazu da sind um Lücken zu füllen und Neuronen zu unterstützen (etwa wie in den 50er Jahren die Rolle der Hausfrau wahrgenommen wurde), tatsächlich sind sie aber ein essentieller Teil des Signalsystems im Gehirn.
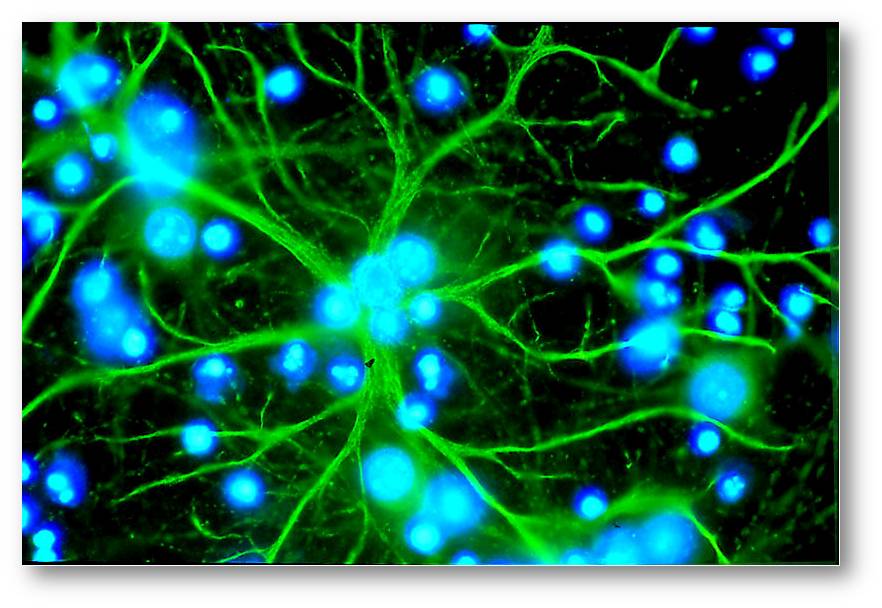 Abbildung 1. Ein sternförmiger Astrozyt (hellgrün gefärbt). Die blauen Signale (DNA-Färbung) stammen von Zellkernen benachbarter Zellen.
Abbildung 1. Ein sternförmiger Astrozyt (hellgrün gefärbt). Die blauen Signale (DNA-Färbung) stammen von Zellkernen benachbarter Zellen.
Neuronen teilen sich üblicherweise nicht mehr; deren DNA hat daher nicht mehr die Gelegenheit in eine Krebs -Form zu mutieren. Die Gliazellen proliferieren aber und Krebs-entartete Glias - Gliome - teilen sich explosionsartig.
Der Einsatz eines modifizierten Poliovirus
In der Mitte der 1990er Jahre hatte Matthias Gromeier (damals an der Stony Broke University, NY) die Idee mit Hilfe von Polioviren rezidivierenden Gliomen den Kampf anzusagen und im Jahr 2000 beschrieb er in einem Artikel das, was heute unter PVSRIPO (Polio Virus Sabin-Rhinovirus Poliovirus) bekannt ist.
PVSRIPO ist eine veränderte, abgeschwächte ("Sabin") Polio Lebendvakzine, die nicht in Nervenzellen hineingehen kann. (Zusätzlich trägt PVSRIPO ein Stück des Rhinovirus, das beim Menschen Schnupfen verursacht.) Im Gegensatz dazu infiziert der Polio-Wildtyp Motorneuronen in Hirnstamm und Rückenmark von Primaten und verursacht bei 1 - 2 % der Menschen "schlaffe Paralyse". Das Polio- Virus infiziert auch Gliazellen indem es sich an ein Protein (CD 155) heftet, das in besonders hoher Dichte in den Zellmembranen von Glioma-Zellen sitzt. Abbildung 2. (Normalerweise - wenn es nicht an Polioviren bindet - bewirkt CD155 interzelluläre Verbindungen zwischen Epithelzellen.)
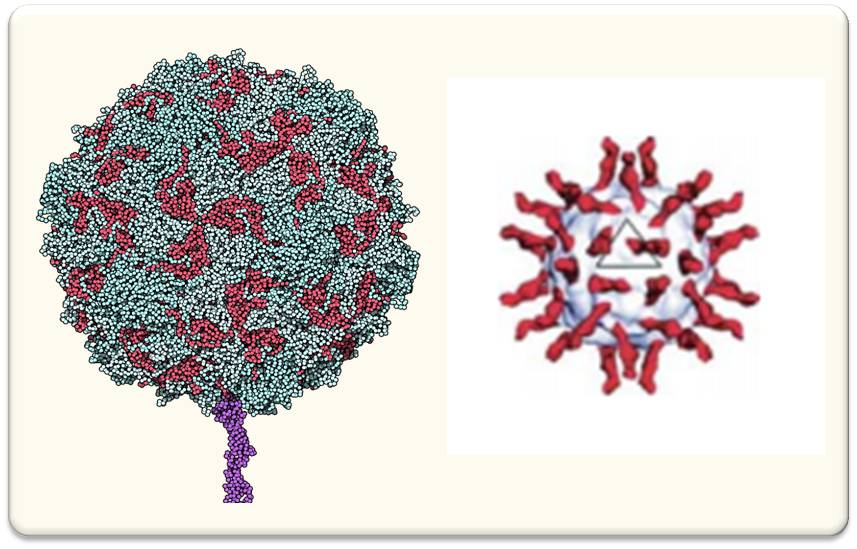 Abbildung 2. Wie das Poliovirus an das Rezeptorprotein CD155 bindet. Links: Der extrazelluläre Teil des CD155 (lila) bindet an ein Protein der Virushülle (Kapsid). Diese setzt sich aus Kopien von 4 Proteinen zusammen. (Bild: Kristallstrukturanalyse des Poliovirus; gemeinfrei). Rechts: CD155 kann an verschiedenen Stellen des Virus andocken. (Bild: Kryoelektronenmikroskopie, rekonstruiert; Nuris, Wikimedia Commons CC BY-SA 4.0 )
Abbildung 2. Wie das Poliovirus an das Rezeptorprotein CD155 bindet. Links: Der extrazelluläre Teil des CD155 (lila) bindet an ein Protein der Virushülle (Kapsid). Diese setzt sich aus Kopien von 4 Proteinen zusammen. (Bild: Kristallstrukturanalyse des Poliovirus; gemeinfrei). Rechts: CD155 kann an verschiedenen Stellen des Virus andocken. (Bild: Kryoelektronenmikroskopie, rekonstruiert; Nuris, Wikimedia Commons CC BY-SA 4.0 )
In den ersten Experimenten zeigte sich nun, dass PVSRIPO in vitro von Gliomazellen aufgenommen wurde, die man Patienten operativ entfernt und in Zellkultur gebracht hatte und in vivo im Modell Maus Gehirntumoren besiegte.
Das modifizierte Poliovirus PVSRIPO ist also nicht Verursacher von Polio, sondern eine Vakzine. Es generiert ein Heer von weißen Blutkörperchen -von Neutrophilen, dendritischen Zellen und T-Zellen -, welche denTumor direkt angreifen oder die Immunabwehr auf die Tumorzellen richten.
Ein monströser Tumor
Glioblastoma multiforme geht von Astrozyten aus und ist das Schlimmste vom Schlimmen ("der Terminator", wie er in einem Editorial zu dem Gromeier-Artikel im Jahr 2000 bezeichnet wurde). Abbildung 3.
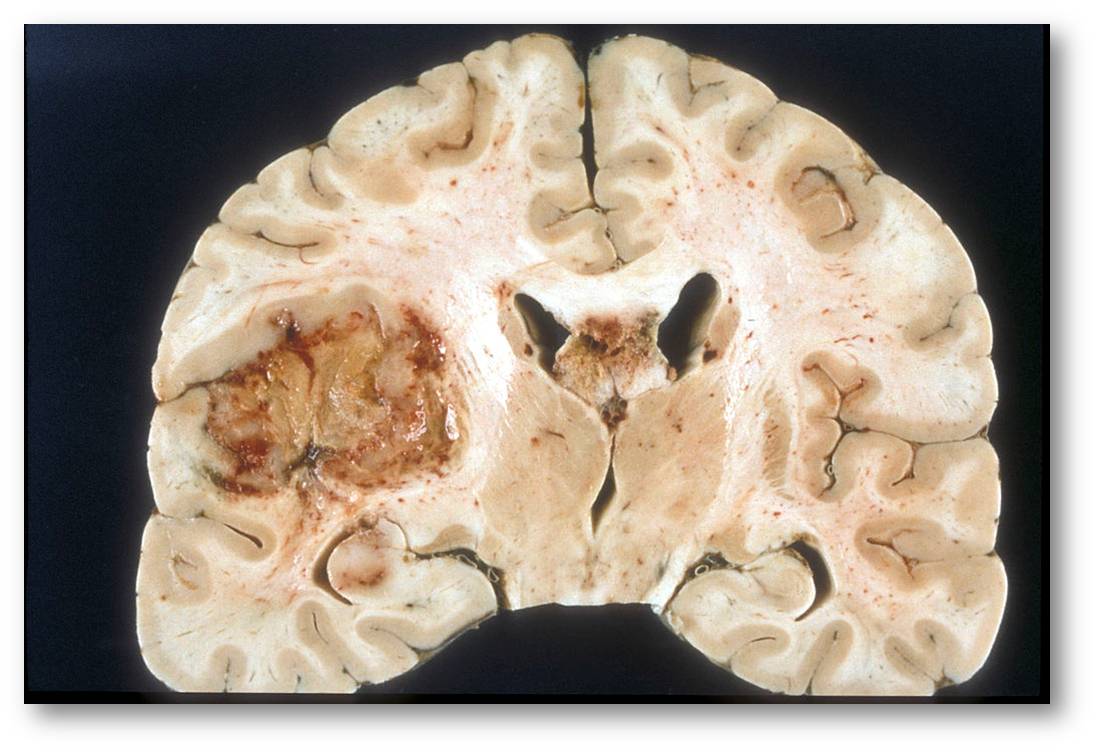 Abbildung 3. Glioblastoma multiforme. Koronare Schnittfläche. Der teilweise nekrotische Tumor links hat sich auch im Bereich des Balkens (Mitte) ausgebreitet. (Bild: Sbrandner, Wikimedia Commons, cc-by-sa 4.0)
Abbildung 3. Glioblastoma multiforme. Koronare Schnittfläche. Der teilweise nekrotische Tumor links hat sich auch im Bereich des Balkens (Mitte) ausgebreitet. (Bild: Sbrandner, Wikimedia Commons, cc-by-sa 4.0)
"Multiforme" bezieht sich dabei auf die unzähligen Wege, mit denen der Tumor das Hirn einnimmt. Er produziert Gebiete des Zerfalls oder von Blutungen, während sich überall mikroskopisch kleine Tentakeln entrollen - möglicherweise eine Reminiszenz an das schnelle Wachstum des Gehirns im Embryo. Eine Operation kann die Tumormasse verringern, Bestrahlungen und Chemotherapie (mit dem oralen Wirkstoff Temozolomid) können helfen - immer werden jedoch einige Tentakeln übrigbleiben. Die Genome der Tumorzellen sind übersät mit Mutationen. Veränderte, zusätzliche und fehlende DNA-Basen sabotieren die Signale, welche den Zyklus der Zellteilung regulieren.
Die im Jahr 2000 von Gromeier und Kollegen aufgestellte Hypothese war es nun, dass das Poliovirus eine Immunantwort gegen Glioma-Zellen erzeugen könnte. Ihrer Überzeugung nach würde das zu einem Zerplatzen oder Lysieren der Zellen führen. So entstand das "Onkolytische Poliovirus gegen Tumoren des Menschen", dem schließlich am 3. August 2017 ein Patent zugeteilt wurde. Es sollte sich herausstellen, dass dieses PVSRIPO viel mehr konnte, als die Entdecker im Jahr 2000 angenommen hatten.
Klinische Studien
Der Weg, der von einer überzeugenden Idee zu präklinischen Untersuchungen an Zell(kultur)en und Versuchstieren zu klinischen Studien führt, dauert üblicherweise ein Jahrzehnt und länger. Die PVSRIPO–Saga bildet dabei keine Ausnahme.
Die Phase 1 Studie in der Klinik, von der die TV-News 2015 berichteten und ein Jahr später dies aktualisierten, war 2011 bei den Behörden eingereicht worden und der erste Patient wurde im Mai 2012 behandelt. Für diese Studie waren insgesamt 61 Patienten vorgesehen, die TV-Show verfolgte vier davon. Alle hatten maligne Gliome Grad IV (d.i. die höchste Stufe) und erhielten das Virus über Katheter, die - unter MRI-Kontrolle - direkt in die Tumormasse geleitet wurden.
Um die Untersuchung zu sponsern, gründete das Forscherteam die Firma Istari Oncology.
Der aktuelle Status: man ist nun bereits in der 2. klinischen Phase und hat das Chemotherapeutikum Lomustin zugefügt, das früheren Patienten geholfen hat. Eine unabhängige Studie wird die Sicherheit und Wirksamkeit auch in Kindern prüfen, bei denen Gliome aber selten auftreten.
FDA: PVSRIPO ein therapeutischer Durchbruch
Die Ergebnisse waren so überzeugend, dass die FDA im Mai 2016 dem PVSRIPO den Status "Therapie Durchbruch" verliehen hat; dies beschleunigt vermutlich die weitere Entwicklung.
Aus den entsprechenden Daten geht hervor, dass die mittlere Überlebenszeit behandelter Patienten auf 12,6 Monate gestiegen war (gegenüber 10,5 Monaten unbehandelter "historischer Kontrollen") und nach zwei Jahren noch 23,3 % der behandelten Patienten am Leben waren (gegenüber 13,7 % der Kontrollen) . Nach Meinung der Forscher sollten höhere Dosen PVSRIPO zu einer noch besseren Wirksamkeit führen. (Allerdings, als die Dosis dann erhöht wurde, verursachte dies bei einer Patientin eine extrem starke Entzündung mit letalen Folgen.)
Ein erwähnenswerter Erfolg zeigte sich bei einer jungen Schwesternschülerin, Stephanie Lipscomb, die 2012 behandelt worden war. Sie ist in Facebook und es geht ihr heute offensichtlich gut: sie wurde Mutter, ist nun Krankenschwester und gilt in den Medien als "tumorfrei". Dass Mikrometastasen bestehen können, dass einige übriggebliebene Gliomzellen, die den Poliorezeptor nicht tragen, zu einer Rekurrenz des Glioms führen, kann zweifellos nicht ausgeschlossen werden.
Wie funktioniert PVSRIPO?
Um zu verstehen, wie PVSRIPO die Gliom-Zellen für das Immunsystem markiert/sichtbar macht, führt Gromeier zusammen mit dem Immunologen Smita Nair und anderen Kollegen Untersuchungen fort, die - wie eingangs erwähnt - an humanen Krebszellen in Zellkultur erfolgen:
PVSRIPO lässt - wie erwartet -die Zellen platzen. Unerwartet ist aber, dass auch die angeborene Immunantwort aktiviert wird und eine Entzündung auslöst. Dafür könnte das - eingangs erwähnte - Stückchen Rhinovirus verantwortlich sein, das dem modifizierten Poliovirus angefügt wurde. Dieses kann den Ball zum Rollen bringen, indem es dendritische Zellen aktiviert, worauf diese Interferone ausschütten und T-Zellen aktivieren und diese schließlich an die Antigene an der Tumoroberfläche andocken. Abbildung 4 fasst diese Kaskade von Reaktionen zusammen.
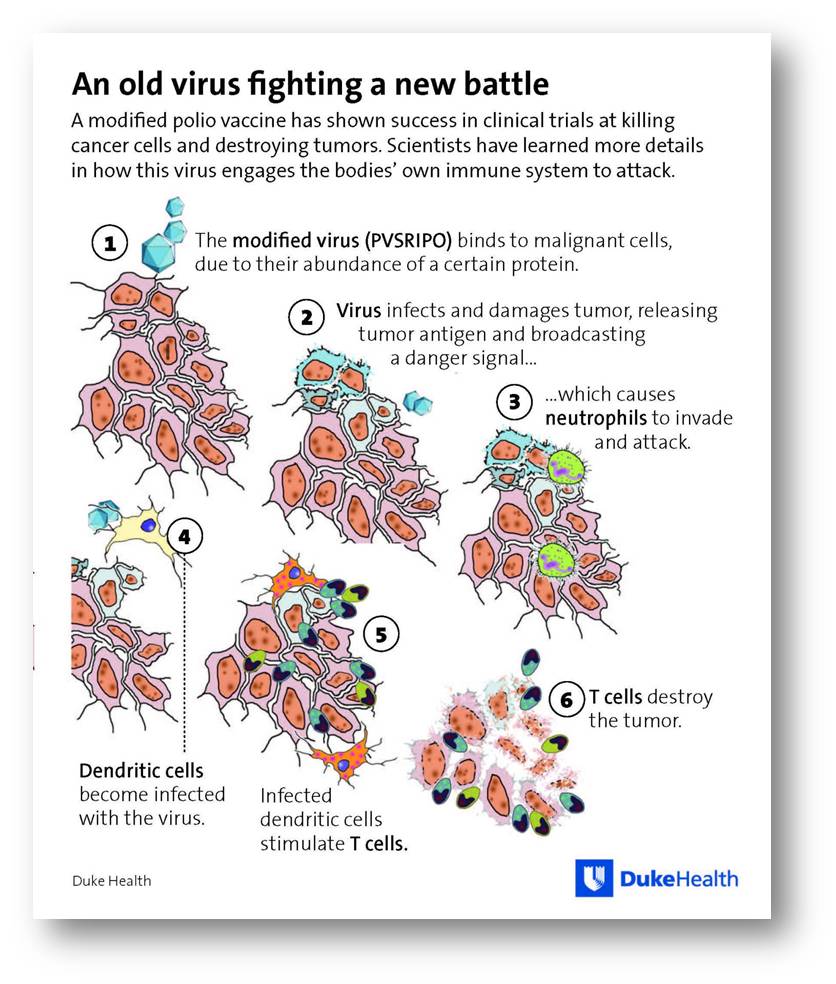 Abbildung 4. Wie das modifizierte Poliovirus PVSRIPO Tumorzellen bekämpft: 1) Direkter Angriff des Poliovirus erfolgt durch Bindung an die zahlreich auf den Tumorzellen vorhandenen CD155 Rezeptoren (1 - 3). 2) Infektion von dendritischen Zellen führt zur Stimulation von T-Zellen, die den Tumor zerstören (4 - 6).
Abbildung 4. Wie das modifizierte Poliovirus PVSRIPO Tumorzellen bekämpft: 1) Direkter Angriff des Poliovirus erfolgt durch Bindung an die zahlreich auf den Tumorzellen vorhandenen CD155 Rezeptoren (1 - 3). 2) Infektion von dendritischen Zellen führt zur Stimulation von T-Zellen, die den Tumor zerstören (4 - 6).
Das Poliovirus tötet also nicht nur die Tumorzellen auf direkte Weise, es infiziert auch die dendritischen (Antigen-präsentierenden) Zellen, die nun eine Antwort der T-Zellen auslösen, welche Tumorzellen erkennen und das Tumorgewebe infiltrieren können.
Die neuen präklinischen Befunde sind eine Basis für die nächste Runde an klinischen Untersuchungen. Eine erfolgversprechende Idee steht auf dem Prüfstand (wenngleich diese schon ein Jahrhundert auf dem Buckel hat): eine auf eine Infektion erfolgende Immunantwort umzuleiten, sodass sie nun Krebs bekämpft.
Literatur
Coley WB. Contribution to the knowledge of sarcoma. Ann Surg 1891;14:199-220. (open access).
Gromeier M et al., (2000). Intergeneric poliovirus recombinants for the treatment of malignant glioma. Proc Natl Acad Sci U S A. 2000 Jun 6;97(12):6803-8. (open access) Information zu Glioblastoma: http://www.abta.org/brain-tumor-information/types-of-tumors/glioblastoma...
Brown MC et al., (2017) Cancer immunotherapy with recombinant poliovirus induces IFN-dominant activation of dendritic cells and tumor antigen–specific CTLs . Science Translational Medicine 20 Sep 2017: Vol. 9, Issue 408, eaan4220 DOI: 10.1126/scitranslmed.aan4220
*Der Artikel ist erstmals am 28. September 2017 in PLOS Blogs - DNA Science Blog unter dem Titel "Poliovirus To Treat Brain Cancer: A Curious Chronology " erschienen ( (http://blogs.plos.org/dnascience/2017/09/28/poliovirus-to-treat-brain-ca... ) und steht unter einer cc-by Lizenz . Die Autorin hat sich freundlicherweise mit der Übersetzung ihrer Artikel durch ScienceBlog.at einverstanden erklärt. Der Artikel wurde geringfügig gekürzt; die Übersetzung folgt jedoch so genau wie möglich der englischen Fassung. Von der Redaktion eingefügt: Beschriftung der Abbildungen, Untertitel.
Weiterführende Links
Coley's Toxins: The History Of The Worlds Most Powerful Cancer Treatment. (englisch; 9:22; Standard-YouTube-Lizenz)
Targeting Cancer with Genetically Engineered Poliovirus. (u.a. M. Gromeier) (Englisch – 10:47; Standard-YouTube-Lizenz).