Eine neue Ära der Biochemie – Die Entwicklung der Kryo-Elektronenmikroskopie wird mit dem Chemienobelpreis ausgezeichnet
Eine neue Ära der Biochemie – Die Entwicklung der Kryo-Elektronenmikroskopie wird mit dem Chemienobelpreis ausgezeichnetDo, 05.10.2017 - 10:15 — Inge Schuster

![]() Die Kryo-Elektronenmikroskopie (Kryo-EM) hat das Tor zu einer neuen Ära der Biochemie geöffnet. Es ist damit möglich geworden Biomoleküle und auch größere zelluläre Strukturen darzustellen, ohne diese kristallisieren zu müssen oder Struktur verändernde Fixative oder Farbstoffe anzuwenden. Dies ermöglicht nun Visualisierungen der Moleküle im nativen Zustand - aufgelöst bis hin zu atomaren Details - und lässt damit deren Funktion besser verstehen. Für die Entwicklung dieser revolutionären Methode wurden Jacques Dubochet, Joachim Frank und Richard Henderson mit dem Nobelpreis für Chemie 2017 ausgezeichnet.
Die Kryo-Elektronenmikroskopie (Kryo-EM) hat das Tor zu einer neuen Ära der Biochemie geöffnet. Es ist damit möglich geworden Biomoleküle und auch größere zelluläre Strukturen darzustellen, ohne diese kristallisieren zu müssen oder Struktur verändernde Fixative oder Farbstoffe anzuwenden. Dies ermöglicht nun Visualisierungen der Moleküle im nativen Zustand - aufgelöst bis hin zu atomaren Details - und lässt damit deren Funktion besser verstehen. Für die Entwicklung dieser revolutionären Methode wurden Jacques Dubochet, Joachim Frank und Richard Henderson mit dem Nobelpreis für Chemie 2017 ausgezeichnet.
Erst in der Mitte des vergangenen Jahrhunderts ist es möglich geworden Strukturen von Biomolekülen zu bestimmen, mit atomarer Auflösung in ihr Inneres zu schauen. Seitdem wurden in zunehmendem Maße immer größere und immer komplexere Strukturen aufgeklärt - von Proteinen, Nukleinsäuren über enorm große Proteinkomplexe bis hin zu Organellen, wie dem Ribosom und ganzen Viren. Zum überwiegenden Teil setzt man dazu die Röntgenstrukturanalyse ein - Voraussetzung dafür ist allerdings, dass das Biomolekül/der Komplex in kristallisierter Form vorliegt und nicht - wie unter physiologischen Bedingungen - in wässriger Lösung. Mittels kernmagnetischer Resonanz (NMR)- Spektroskopie können Strukturen von Biomolekülen auch in Lösung bestimmt werden. Derartige Studien sind häufig sehr aufwendig, benötigen u.a. die Einführung spezifischer Isotope in das Molekül und im allgemeinen auf eine Molekülgrösse unter 30 000 beschränkt.
In der öffentlich zugänglichen Datenbank PDB (www.rcsb.org/pdb) sind aktuell rund 134 000 Strukturen von Biomolekülen (> 90 % sind Proteine) hinterlegt und es kommen jährlich mehr als 10 000 neue Strukturen dazu. Auf NMR-Analysen fallen davon insgesamt rund 12 000 Strukturen und jährlich werden 400 – 500 neue Strukturen hinterlegt.
Es gibt aber viele Biomoleküle, deren Struktur sich weder durch Röntgenstrukturanalyse noch durch NMR-Messungen bestimmen lässt. Hier bietet die Kryo-Elektronenmikroskopie einen revolutionären, neuen Weg: Biomoleküle, Komplexe und auch molekulare Maschinen bleiben in wässriger Lösung, werden nicht durch Modifikationen/Kristallisierung beeinträchtigt und können ihre gewohnten Funktionen ausführen (beispielsweise kann der Translationsprozess am Ribosom ablaufen). Das ungeheure Potential einer Methode, die es erlaubt Biomoleküle unter nativen Bedingungen zu charakterisieren, wurde rasch erkannt und führte zu einem Boom an Untersuchungen: unter dem Stichwort "cryo electron microscopy" verzeichnet die Literaturdatenbank PubMed 8052 Publikationen, In der erwähnten Datenbank PDB sind bereits 859 mit cryo EM aufgeklärte Strukturen hinterlegt. Einige davon sind in Abbildung 1 gezeigt. 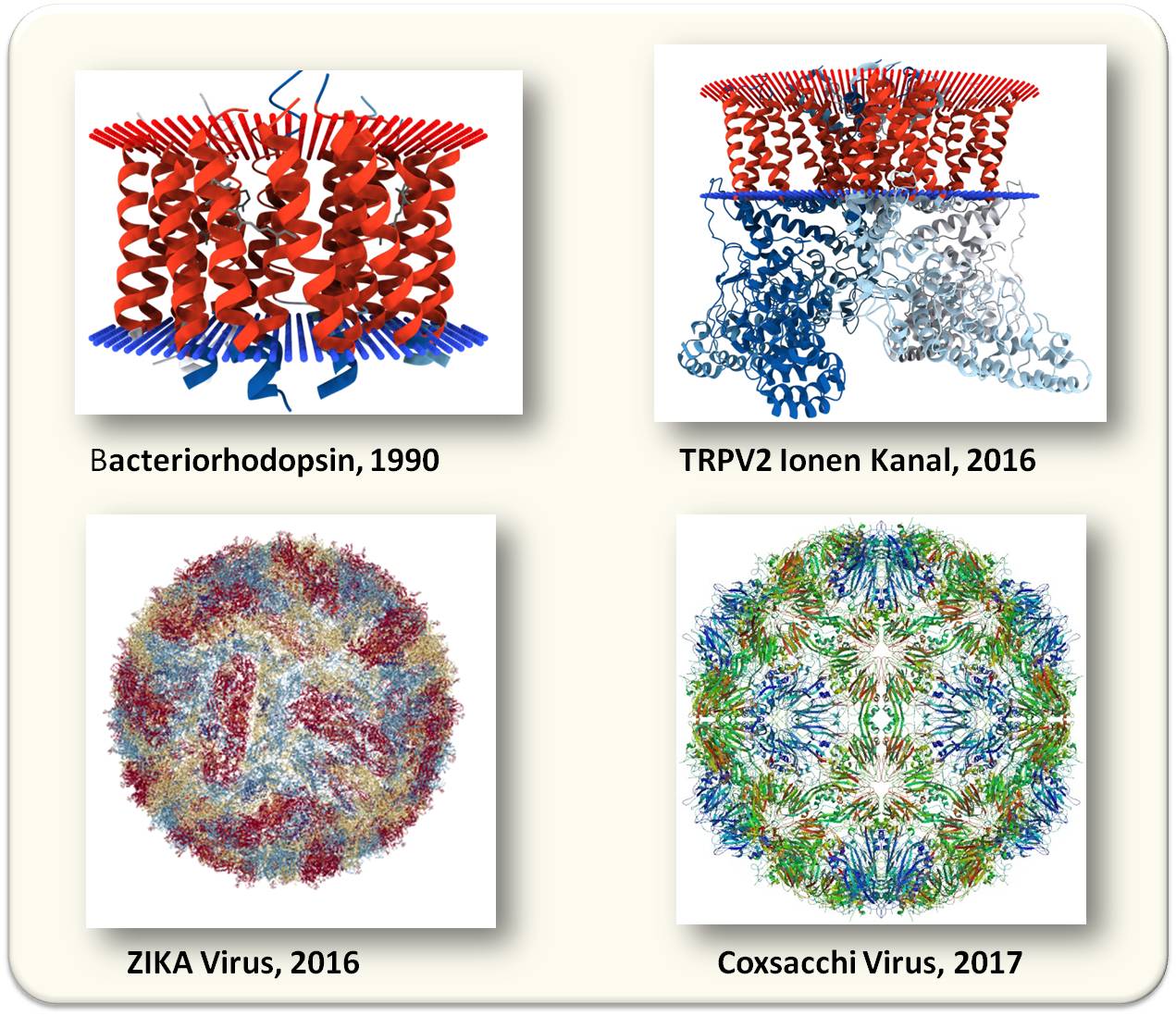
Abbildung 1. Mittels Cryo-EM aufgeklärte Strukturen. Oben links: Bacteriorhodopsin, eine in der (durch rote und blaue Linien gekennzeichneten) Membran von Halobakterien sitzende, Licht-getriebenen Protonenpumpe; es war die erste durch Cryo-EM aufgeklärte Struktur. Oben rechts: Der TRPV2 Ionenkanal des Kaninchens (der in der Zellmembran sitzende Teil ist durch rote und blaue Linien gekennzeichnet). Unten links: das aus 360 Untereinheiten(Heteromer) aufgebaute ZIKA-Virus wurde 2016 in der Gruppe von Michael Rossmann aufgeklärt, Unten rechts: das aus 180 Untereinheiten (Heteromer) bestehende Coxsacchi Virus vor wenigen Wochendurch eine chinesische Gruppe aufgeklärt. (Bilder: http://www.rcsb.org/pdb/results/results.do?tabtoshow=Current&qrid=E3CC1BD6 ; open access)
Für die Entwicklung dieser revolutionären Methode wurden der Schweizer Jacques Dubochet (Universität Lausanne), der Deutsch-Amerikaner Joachim Frank (Columbia University, NY) und der Schotte Richard Henderson (MRC Lab MolBiol, Cambridge, UK) mit dem Nobelpreis für Chemie 2017 ausgezeichnet.
Die Entwicklung der Kryo-Elektronenmikroskopie
Die zugrundeliegende Transmissions-Elektronenmikroskopie (EM) wurde bereits in den 1930er Jahren entwickelt. Da die durch die Probe gehenden schnellen Elektronen Materiewellen mit einer wesentlich kleinere Wellenlänge als sichtbares Licht sind, kann man damit Auflösungen im sub-Nanometer Bereich erzielen. Eine Anwendung bei Biomolekülen schien aber lang ausgeschlossen: unter den Vakuumbedingungen im Mikroskop wird Wasser entzogen, Biomoleküle trocknen aus und verändern ihre Struktur (denaturieren) und zusätzlich verschmoren die meisten Biomoleküle infolge der hohen Intensität des Elektronenstrahls.
Die erste Cryo-EM an einem Protein
Richard Henderson hatte seine Doktorarbeit in Cambridge, der Hochburg der Röntgenkristallographie gemacht. Als er sich 1975 an die Strukturaufklärung des Membranproteins Bacteriorhodopsin heranwagte, zeigte es sich, dass dieses sich nicht kristallisieren ließ. An eine Röntgenstruktur war also nicht zu denken. Henderson versuchte das Problem mit Hilfe der EM zu lösen. Er verwendete dazu das Protein in seiner nativen Umgebung, der Membran. Vor Austrocknung schützte eine Schicht Glukoselösung, vor dem Verschmoren ein Elektronenstrahl mit wesentlich gerigerer Intensität. Dies führte dennoch zu brauchbaren Beugungsbildern, da Bacteriorhodopsin in der Membran ja in sehr hoher Konzentration, regelmäßig gepackt und in die gleiche Richtung orientiert vorlag und alle diese Moleküle daher den Elektronenstrahl in praktisch derselben Weise streuten. So war es möglich ein Beugungsmuster zu erhalten, aus dem Henderson die Struktur mit einer (relativ niedrigen) Auflösung von 0,7 nm ermittelte.
Durch Verbesserungen in der Kryotechnologie und in den Linsen des Mikroskops konnte Henderson dann 1990 eine atomare Auflösung von 0,35 nm erzielen- dies war vergleichbar mit der Auflösung in Röntgenanalysen.
Algorithmen zur Bildanalyse
Eine essentielle Grundlage zur Bearbeitung der Beugungsaufnahmen kam von dem Biophysiker Joachim Frank. Dieser begann ebenfalls um 1975 ein Computer-gestütztes mathematisches Verfahren zu entwickeln mit dem wiederkehrende Muster in einer zufälligen Anordnung von Proteinmolekülen identifiziert werden, diese in die jeweiligen Gruppen sortiert und deren Informationen gemittelt werden. Dies führte zu zweidimensionalen Bildern, welche das Molekül mit hoher Auflösung unter verschiedenen Winkeln zeigten. Um dreidimensionale Bilder zu erhalten, erarbeitete Frank Algorithmen, welche die unterschiedlichen zweidimensionalen Bilder zueinander in Beziehung brachten.
Vitrifiziertes Wasser
Um wasserlösliche Biomoleküle im Vakuum des Elektronenmikroskops vor dem Austrocknen zu schützen, hatten Forscher versucht die Proben in gefrorenem Zustand zu untersuchen. Allerdings entstanden beim Einfrieren Eiskristalle, welche die Elektronen ablenkten und so die Messung scheitern liessen. Der Schweizer Biophysiker Jaques Dubochet fand dafür eine Lösung. Er kühlte die Proben sehr schnell in flüssigem Ethan, das seinerseits durch flüssigen Stickstoff bei -196oC gekühlt wurde, ab. Dabei entstand etwas Neues: glasartiges - "vitrifiziertes" Wasser. Dubochet beschreibt dies: "I am still unsure of what really happened with this specimen but, what is certain, is that frozen water was present and that the unstained biological material was more beautiful than anything I had seen before".
Dubochet wandte die Vitrifizerung an verschiedenen Viren an und zeigte wie scharf sich diese vom Untergrund des gläsernen Wasser abhoben.
Hohe Auflösung wird erreicht
Henderson, Frank und Dubochet hatten nun die wesentlichen Grundlagen für die Cryo-EM geschaffen. In den darauffolgenden Jahren verbesserte sich die Auflösung sukzessive. Ein enormer Fortschritt wurde 2013 mit einem neuen Typ eines Elektronendetektors (Direct Electron Detector DED) erreicht; ma erhielt damit die auch für Röntgenanalysen übliche Auflösung von 0,3 nm, d.i. im atomaren Bereich.
Die Methode erlebt seitdem einen "gold rush". Mit cryo-EM ist es vor allem einfach geworden Membranproteine zu charakterisieren. Dies hat eine besondere Bedeutung für die Entwicklung von neuen Arzneistoffen: der Großteil der heute gebräuchlichen und in Entwicklung befindlichen Pharmaka richtet sich gegen diverse Membranproteine, wie beispielsweise gegen Rezeptoren und Ionenkanäle.
Weiterführende Links
The Nobel Prize in Chemistry 2017 Announcement of the Nobel Prize in Chemistry 2017 .Video 42:34 min.
Artikel zu verwandten Themen im ScienceBlog:
- Stefan W. Hell, 06.07.2017: Grenzenlos scharf — Lichtmikroskopie im 21. Jahrhundert
- Redaktion, 04.09.2015: Superauflösende Mikroskopie zeigt Aufbau und Dynamik der Bausteine in lebenden Zellen
- Berhnhard Rupp, 26.01.2017: Die Proteindatenbank: Strukturen, Modelle und zwingend erforderliche Korrekturen
- Berhnhard Rupp, 04.04.2014: Wunderwelt der Kristalle — Von der Proteinstruktur zum Design neuer Therapeutika
- Berhnhard Rupp, 21.03.2014: Wunderwelt der Kristalle — Die Kristallographie feiert ihren 100. Geburtstag