Do, 15.03.2018 - 10:13 — Markus Schmidt

![]() Mykoplasmen sind winzige bakterielle Krankheitserreger, die bei Mensch und Tier schwere Infektionen im Atmungs- und Urogenitaltrakt hervorrufen. Die in der Nutztierhaltung dadurch entstehenden, enormen Schäden machen eine Anwendung von Antibiotika unabdingbar; gegen diese entstehen allerdings zunehmend Resistenzen. Um Antibiotika künftig ersetzen zu können, entwickelt das von der EU geförderte Projekt MycoSynVac , an dem auch der Biologe und Biosicherheitsforscher Markus Schmidt beteiligt ist, einen neuartigen Impfstoff. Mittels Synthetischer Biologie sollen Mykoplasmen genetisch umprogrammiert werden, sodass sie sich an den Wirtszellen noch festsetzen und damit eine immunstimulierende Reaktion des Wirtes auslösen können, jedoch keine Virulenzfaktoren mehr enthalten, die ansonsten Zellschäden und Entzündungsprozesse verursachen würden.
Mykoplasmen sind winzige bakterielle Krankheitserreger, die bei Mensch und Tier schwere Infektionen im Atmungs- und Urogenitaltrakt hervorrufen. Die in der Nutztierhaltung dadurch entstehenden, enormen Schäden machen eine Anwendung von Antibiotika unabdingbar; gegen diese entstehen allerdings zunehmend Resistenzen. Um Antibiotika künftig ersetzen zu können, entwickelt das von der EU geförderte Projekt MycoSynVac , an dem auch der Biologe und Biosicherheitsforscher Markus Schmidt beteiligt ist, einen neuartigen Impfstoff. Mittels Synthetischer Biologie sollen Mykoplasmen genetisch umprogrammiert werden, sodass sie sich an den Wirtszellen noch festsetzen und damit eine immunstimulierende Reaktion des Wirtes auslösen können, jedoch keine Virulenzfaktoren mehr enthalten, die ansonsten Zellschäden und Entzündungsprozesse verursachen würden.
Im Jahr 2010 veröffentlichten Forscher am J. Craig Venter Institut (JCVI) im Fachjournal Science ein sensationelles Ergebnis: Sie hatten erstmals eine Bakterienzelle erzeugt, die durch ein künstliches, durch chemische Synthese hergestelltes, Genom völlig kontrolliert wurde und sich kontinuierlich vermehren konnte [1]. Bei dieser "synthetischen" Zelle handelte es sich um die modifizierte Version eines ungewöhnlichen Bakteriums, eines Mykoplasmas.
Was sind Mykoplasmen?
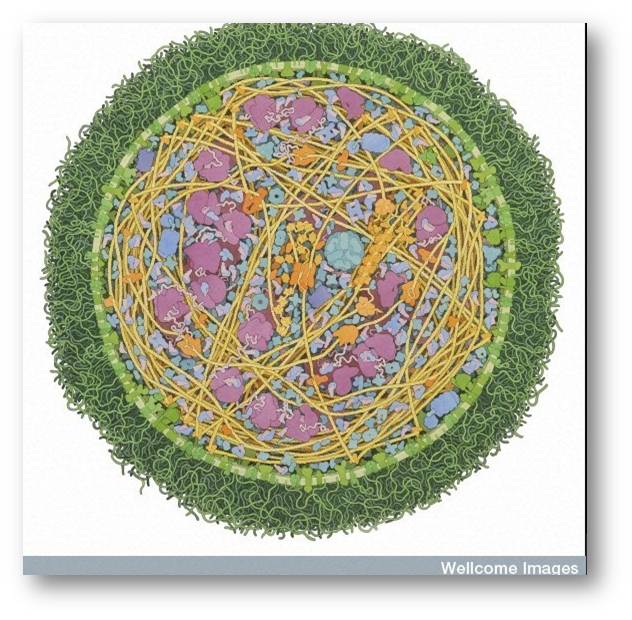
Mykoplasmen unterscheiden sich wesentlich von anderen Bakterien. Sie sind vor allem viel kleiner als andere Bakterien und besitzen ein außergewöhnlich kleines Genom, das aus weniger als 1 Million Basenpaaren besteht - das entspricht nur 500 - 1000 Genen (zum Vergleich: das bekannte Bakterium Escherichia coli enthält 4288 Gene) und demgemäß einer Minimalausstattung an Genprodukten, d.i. Proteinen und RNAs. Abbildung 1 gibt einen Überblick über wesentliche Komponenten einer Mykoplasmenzelle.
Abbildung 1. Querschnitt durch eine Mykoplasma mycoides Zelle. Der Durchmesser beträgt nur rund 300 Nanometer (0.0003 mm). An die Lipide der Zellmembran (hellgrün )sind nach außen lange Kohlehydratketten (dunkelgrün) geknüpft. Viele Transportproteine (grün) sind in die Zellmembran eingebettet. Im Innern der Zelle sieht man die DNA (gelbe Fäden) mit der Maschinerie für Replikation und Transkription (orange), Ribosomen (lila) und Enzyme (blau). (Quelle: Kolorierte Zeichnung von David S. Goodsell, RCSB Protein Data Bank. Wellcome Images.Lizenz: cc-by 4.0.https://www.flickr.com/photos/wellcomeimages/25714823042)
Ungewöhnlich ist auch, dass Mykoplasmen keine Zellwand besitzen; d.h. sie sind nur von der - normalerweise unter einer Zellwand liegenden - Zellmembran umgeben. Antibiotika wie beispielsweise Penicilline oder Cephalosporine, die sich gegen Komponenten der bakteriellen Zellwände richten, sind daher gegen Mykoplasmen unwirksam.
Für die Grundlagenforschung stellen Mykoplasmen faszinierende Modellsysteme dar. Auf Grund ihres kleinen Genoms - an der Grenze der Lebensfähigkeit - reduziert sich die ansonsten ungeheuer hohe Komplexität von Regulierungsvorgängen und man hofft durch Reduktion weiterer Komponenten und Prozesse (durch die Herstellung eines "Minimalgenoms") herausfinden zu können, welche davon unabdingbar sind, in anderen Worten: wie Leben funktioniert.
An Mykoplasmen erworbene Kenntnisse bieten aber auch eine Basis, um mittels Verfahren der Synthetischen Biologie neue, für spezifische Bedürfnisse zurechtgeschneiderte Anwendungen zu finden. Solche Grundlagen hat Luis Serrano, Leiter des Centre for Genomic Regulation (CRG) in Barcelona geschaffen, indem er Organisation, Regulation und Stoffwechsel der Mykoplasmenzelle in quantitativer Weise charakterisiert hat.
Mykoplasmen als Pathogene
Bei einem derart reduziertem Genom fehlen zahlreiche essentielle Stoffwechselwege - dementsprechend sind Mykoplasmen auf Wirtsorganismen angewiesen und nehmen von diesen Bausteine des Stoffwechsels auf, die sie selbst nicht synthetisieren können (Abbildung 2). Mehr als 200 dieser parasitär lebenden Mykoplasmen-Spezies sind in der Tier-und Pflanzenwelt bekannt. Eine Reihe davon befallen Menschen und Tiere, setzen sich an den Oberflächen von Schleimhäuten -vor allem im respiratorischen Trakt und im Urogenitaltrakt - und auch in Gelenken fest und können infolge ihres Stoffwechsels die Gewebe schädigen und viele, oftmals chronische Krankheiten auslösen.  Abbildung 2. Um Stoffwechselprodukte von Wirtszellen aufnehmen zu können, müssen Mykoplasmen an diesen andocken. Dies geschieht über eine polare Zellausstülpung, die sogenannte Attachment Organelle. Elektronenmikroskopische Aufnahmen: Links: Mycoplasma genitalium G37 (J.M. Hatchel and the Miami University Center for Advanced Microscopy and Imaging; in: Blogpost by Mitchell F. Balish. https://www.usomycoplasmology.org/single-post/2015/09/04/How-to-See-Mycoplasma). Rechts: Mycoplasma pneumoniae, das mit der rechten Ausstülpung an ein Kohlenstoffgitter bindet. (Bild aus: Daisuke Nakane et al.,2015; Systematic Structural Analyses of Attachment Organelle in Mycoplasma pneumoniae; Lizenz: cc-by. http://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1005299)
Abbildung 2. Um Stoffwechselprodukte von Wirtszellen aufnehmen zu können, müssen Mykoplasmen an diesen andocken. Dies geschieht über eine polare Zellausstülpung, die sogenannte Attachment Organelle. Elektronenmikroskopische Aufnahmen: Links: Mycoplasma genitalium G37 (J.M. Hatchel and the Miami University Center for Advanced Microscopy and Imaging; in: Blogpost by Mitchell F. Balish. https://www.usomycoplasmology.org/single-post/2015/09/04/How-to-See-Mycoplasma). Rechts: Mycoplasma pneumoniae, das mit der rechten Ausstülpung an ein Kohlenstoffgitter bindet. (Bild aus: Daisuke Nakane et al.,2015; Systematic Structural Analyses of Attachment Organelle in Mycoplasma pneumoniae; Lizenz: cc-by. http://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1005299)
Damit, wie man Infektionen mit Mykoplasmen - vorerst im Tiergebiet - in den Griff bekommen will, befasst sich der folgende Text.
Infektionen mit Mykoplasmen bei Nutztieren
Wesentliche Mykoplasmen-Arten, die bei Nutztieren Erkrankungen auslösen, sind in Tabelle 1 aufgelistet. Abgesehen vom Leiden und Sterben der Tiere verursachen Mykoplasmen-Infektionen auch Epidemien, deren ökonomischen Folgen dann Verzögerungen in der Produktion, schlechtere Futterverwertung und insgesamt sinkende Effizienz und Einnahmen für die Bauern nach sich ziehen. Die jährlichen Verluste durch Mykoplasmeninfektionen von Rindern, Schweinen und Geflügel belaufen sich in Europa und den USA auf Hunderte Millionen Euro.
Tabelle 1. Mykoplasmen-Arten, die Infektionen bei Nutztieren auslösen 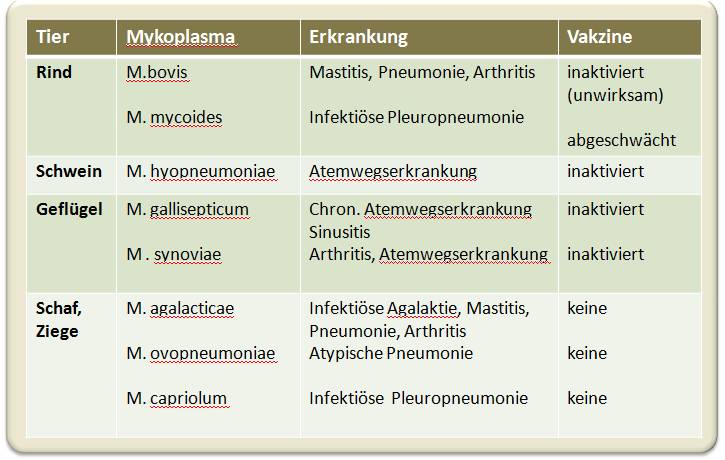
Um die Produktionsausfälle möglichst gering zu halten, werden in der konventionellen Nutztierzucht Antibiotika eingesetzt - beispielsweise in der Hühnermast ist dies in mindestens 90 % der Großbetriebe der Fall. Die Palette der gegen Mykoplasmen wirksamen Antibiotika ist kleiner als bei anderen Bakterien (u.a. fällt die große Zahl der Zellwand-aktiven Verbindungen aus) und deren massiver Einsatz führt in zunehmendem Maße zur Resistenzentstehung - ein enormes Problem für Tier und Mensch.
Eine Möglichkeit von den Antibiotika wegzukommen ist die Anwendung effizienter Impfstoffe (Vakzinen), für die eine derartige Resistenzentstehung nicht zu befürchten ist. Üblicherweise werden antibakterielle Impfstoffe aus einfach inaktivierten oder abgeschwächten Krankheitserregern hergestellt und dienen dazu, das Immunsystem zu "trainieren". Solche Vakzinen gibt es auch gegen eine Reihe von Mykoplasmen-Arten (Tabelle 1). Sie sind jedoch in der Herstellung teuer (das Wachstum der parasitären Keime ist ja nur in kostspieligen Kulturmedien möglich) und funktionieren vielfach nicht so wie sie sollten. Der Grund dafür ist, dass die inaktivierten Pathogene nicht mehr an die Wirtszellen andocken können und damit nicht in der Lage sind eine ausreichende Immunantwort auszulösen.
MycoSynVac - Entwicklung einer neuartigen Vakzine
MycoSynVac ist ein von der EU-gefördertes H2020 Projekt, das von 2015 bis 2020 läuft. Das Ziel ist mit den Methoden der Synthetischen Biologie eine neuen Impfstoff-Typ gegen Mykoplasmen zu designen, der (vorerst) in der Nutztierhaltung Anwendung finden soll. Daran beteiligt sind acht Partner von Universitäten und Firmen aus ganz Europa, die ihre Expertise in Mikrobiologie, Synthetischer Biologie, Veterinärmedizin, Tierethik, Entwicklung von Vakzinen, aber auch in allen Fragen der Biosicherheit einbringen und Ergebnisse und deren Bedeutung transparent für die EU-Bürger kommunizieren. Partner sind u.a . das bereits erwähnte Centre for Genomic Regulation (CRG, Barcelona), das Französische Nationalinstitut für Landwirtschaftliche Forschung (INRA, Bordeaux - hier arbeitet Carole Lartigue, eine Koautorin des eingangs erwähnten Artikels [1] aus dem Craig Venter Institut), ein global führendes Unternehmen MSD Animal Health - in Holland und auch Tierethiker von der Universität Kopenhagen.
MycoSynVac plant nun nicht bloß einen abgeschwächten Keim herzustellen, sondern einen umprogrammierten Organismus, der sozusagen semi-infektiös sein wird. Dies bedeutet: das umprogrammierte Bakterium soll fähig sein sich im Wirtsorganismus festzusetzen, d.h. an den Wirtszellen anzudocken. Da die Virulenzfaktoren aber beseitigt wurden, soll es dort keine Zellschädigungen und Entzündungsprozesse auslösen können.
Auf diesem Konzept basierend soll damit ein universelles Chassis - eine Art Unterbau - geschaffen werden, das als Einfach-oder Mehrfachvakzine einsetzbar ist. Um die gewünschten Eigenschaften umprogrammieren zu können, braucht es nicht nur ein vertieftes Verständnis, wie der Lebenszyklus des pathogenen Keims auf der Genebene abläuft, sondern auch verlässliche bioinformatische Modelle und präzise molekularbiologische Methoden zur zielgerichteten Veränderung der DNA (Genom-Editierung). Abbildung 3. 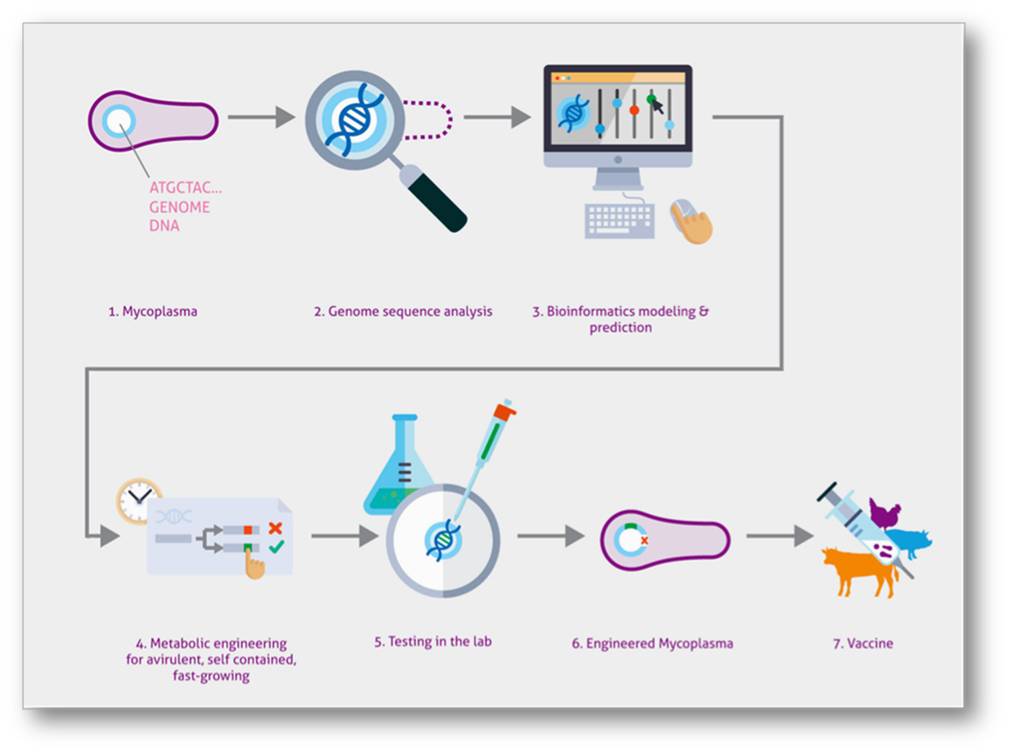 Abbildung 3. Der Weg zum marktreifen Impfstoff - ein universelles bakterielles Chassis auf der Basis des umprogrammierten Mykoplasma pneumoniae. Ausgehend von der Sequenz (2) der Mykoplasmen DNA (1) werden bioinformatische Modelle für die gewünschten Eigenschaften erstellt (3) und diese dann mit molekularbiologischen Methoden umgesetzt (4). Die so modifizierten Pathogene durchlaufen viele Labortests (5) und führen schlussendlich zu einem "semiinfektiösen" Pathogen (6), das als Vakzine eingesetzt werden kann (7). Bild: Birgit Schmidt, Lizenz cc-by.
Abbildung 3. Der Weg zum marktreifen Impfstoff - ein universelles bakterielles Chassis auf der Basis des umprogrammierten Mykoplasma pneumoniae. Ausgehend von der Sequenz (2) der Mykoplasmen DNA (1) werden bioinformatische Modelle für die gewünschten Eigenschaften erstellt (3) und diese dann mit molekularbiologischen Methoden umgesetzt (4). Die so modifizierten Pathogene durchlaufen viele Labortests (5) und führen schlussendlich zu einem "semiinfektiösen" Pathogen (6), das als Vakzine eingesetzt werden kann (7). Bild: Birgit Schmidt, Lizenz cc-by.
Zusätzlich zu Forschung und Entwicklung zukünftiger Anti-Mykoplasmen Vakzinen schafft MycoSynVac auch eine Reihe von Biosicherheitssystemen die in die umprogrammierten Bakterien eingebaut sind. Diese und andere Herausforderungen lassen die Vakzine nicht gerade als einfaches Unterfangen erscheinen. Bedenkt man aber, welche Auswirkungen und Tragweite ein erfolgreiches Produkt erzielen wird, erscheint das Vorhaben dennoch lohnend.
Warum MycoSynVac wichtig ist
Dafür gibt es viele Gründe:
- Der Markt für Produkte im Tiergebiet und für Impfstoffe ist sehr groß. Allein für Impfstoffe gegen M. hyopneumoniae liegt er derzeit bei ca. 150 Millionen US Dollar.
- Gegen viele pathogene Keime gibt es derzeit entweder keine Vakzinen, oder diese funktionieren nicht richtig - es besteht also dringender Bedarf für neue Anwendungen.
- Die neuen Vakzinen werden auf einem standardisiertem Chassis basieren, in das mehrere unterschiedliche Typen pathogener Epitope - das sind Moleküle an der Oberfläche, die für eine schützende Immunantwort benötigt werden - eingebaut werden können. Damit wird die Entwicklung weiterer Vakzinen einfacher und schneller.
- Diese neuen Vakzinen werden mithelfen Antibiotika in der Landwirtschaft systematisch zu reduzieren und zu ersetzen. Resistenzen gegen Antibiotika nehmen zu und sogenannte Super-Keime (multi-resistente Pathogene) können Tier und Mensch in gleicher Weise befallen. In den Diskussionen zur antimikrobiellen Resistenz haben Vakzinen bis jetzt kaum eine Rolle gespielt, obwohl ihre Wirksamkeit in der Eindämmung der Erkrankungen und der Resistenzentwicklung ausführlich dokumentiert ist.
- Schlussendlich, sobald eine derartige Vakzine für die Nutztierhaltung zugelassen ist, wird es das nächste Ziel sein, diese Art von synthetischen Impfstoffen auch für den Menschen zu entwickeln - ein Vorhaben mit einem noch größeren Markt und höherer gesellschaftlicher Tragweite.
Das Ganze in Form eines kurzen einprägsamen, lustigen Videos: MYCOSYNVAC feat. MC Grease (da disease). Video 2:44 min. (produced by Biofaction.); Standard YouTube License. https://www.youtube.com/watch?time_continue=62&v=uY60ijZZX1o
[1] Gibson, D. G.et al.,( 2010). "Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome". Science. 329 (5987): 52–56. doi:10.1126/science.1190719. PMID 20488990.
Weiterführende Links
Das Projekt MycoSynVac http://www.mycosynvac.eu/content/about
Zum Autor: • Markus Schmidt: Synthetic Vaccines (2018). http://blogs.nature.com/tradesecrets/2018/01/18/synthetic-vaccines
• Biofaction: Research and Science Communication Company. http://www.biofaction.com/
• Gesellschaftliche Konsequenzen neuer Biotechnologien. http://www.markusschmidt.eu/
• Markus Schmidt: Neue Impfstoffe in der Nutztierhaltung: Fluch oder Segen? Kepler Cafe Mycosynvac (2017); Video: 1:27:39: https://dorftv.at/video/27311
- Printer-friendly version
- Log in to post comments