Alzheimer-Therapie: Biogen gibt seinen umstrittenen Anti-Amyloid-Antikörper Aduhelm auf
Alzheimer-Therapie: Biogen gibt seinen umstrittenen Anti-Amyloid-Antikörper Aduhelm aufMo, 05.02.2024 — Inge Schuster
Nachdem fast 20 Jahre lang keine neuen Alzheimer-Medikamente den Markt erreicht hatten, erhielt 2021 der Anti-Amyloid Antikörper Aduhelm des US-Biotechkonzerns Biogen als erster Vertreter einer neuen Klasse von Therapeutika die Zulassung durch die US-Behörde FDA. Dass die Entscheidung trotz des Fehlens eindeutiger Nachweise der Wirksamkeit und des Auftretens bedenklicher Nebenwirkungen erfolgte, löste enorme Kritik aus und das von skeptischen Ärzten kaum verschriebene Präparat wurde zum Flop. Vor 5 Tagen hat Biogen nun mitgeteilt, dass Entwicklung und Vermarktung von Aduhelm einstellt gestellt wird und freiwerdende Ressourcen nun seunem zweiten (im Juli 2023 registrierten) Anti-Amyloid -Antikörper Leqembi (Lecanemab) gewidmet werden sollen.
Für den US-Biotechkonzern Biogen war Aduhelm die bahnbrechende Entdeckung, die den Weg für eine neue Klasse von Medikamenten in der Alzheimer -Therapie ebnete und Forschung und nötige Investitionen in diesem Bereich wieder möglich machte. Waren die bis jetzt wenigen verfügbaren Therapien bestenfalls geeignet Symptome der Alzheimer-Krankheit etwas abzumildern, so sollte nun erstmals der (?) zugrundeliegende Krankheitsprozess beeinflusst werden.
Beta-Amyloid als Target für Alzheimer-Therapeutika
Ein zentrales Element der Erkrankung ist die massive Ablagerung von unlöslichen Protein-Plaques zwischen den Nervenzellen; diese lösen eine Kaskade von pathophysiologischen Ereignissen aus: Schädigungen von Nervenzellen und deren Funktionen, Unterbindungen der Nervenverbindungen und schlussendlich Absterben der Nervenzellen. Wie heute mittels der nicht-invasiven Positronen-Emissionstomographie (PET) gezeigt werden kann, sind solche Plaques bereits Jahre, bevor noch die ersten Symptome auftreten, nachweisbar.
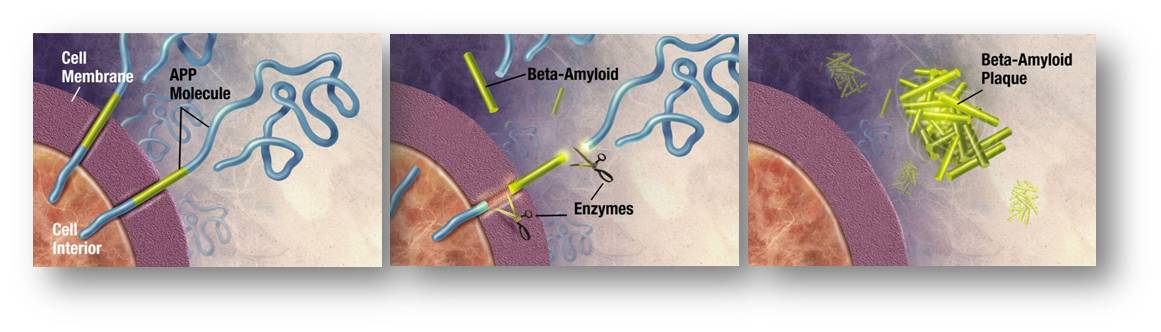
Die Zusammensetzung der Plaques wurde schon vor 40 Jahren aufgeklärt: Sie bestehen aus aggregierten, etwa 40 Aminosäuren langen Beta-Amyloid- Peptidketten, die aus dem Vorläufer-Protein Amyloid-Precursor -Protein (APP) abgespalten werden, das in vielen Körperzellen, insbesondere an den Synapsen der Nervenzellen exprimiert ist. Abbildung 1.
|
Abbildung 1: Bildung von Beta-Amyloid-Plaques. Enzyme wirken auf das in den Zellmembranen sitzende Amyloid-Vorläuferprotein ein und zerschneiden es in Fragmente. Zu den Bruchstücken gehören die etwa 40 Aminosäuren langen Beta-Amyloidpeptide (gelb), die im extrazellulären Raum zu unlöslichen Plaques aggregieren können. (Bild: http://www.nia.nih.gov/Alzheimers/Resources/HighRes.htm, gemeinfrei) |
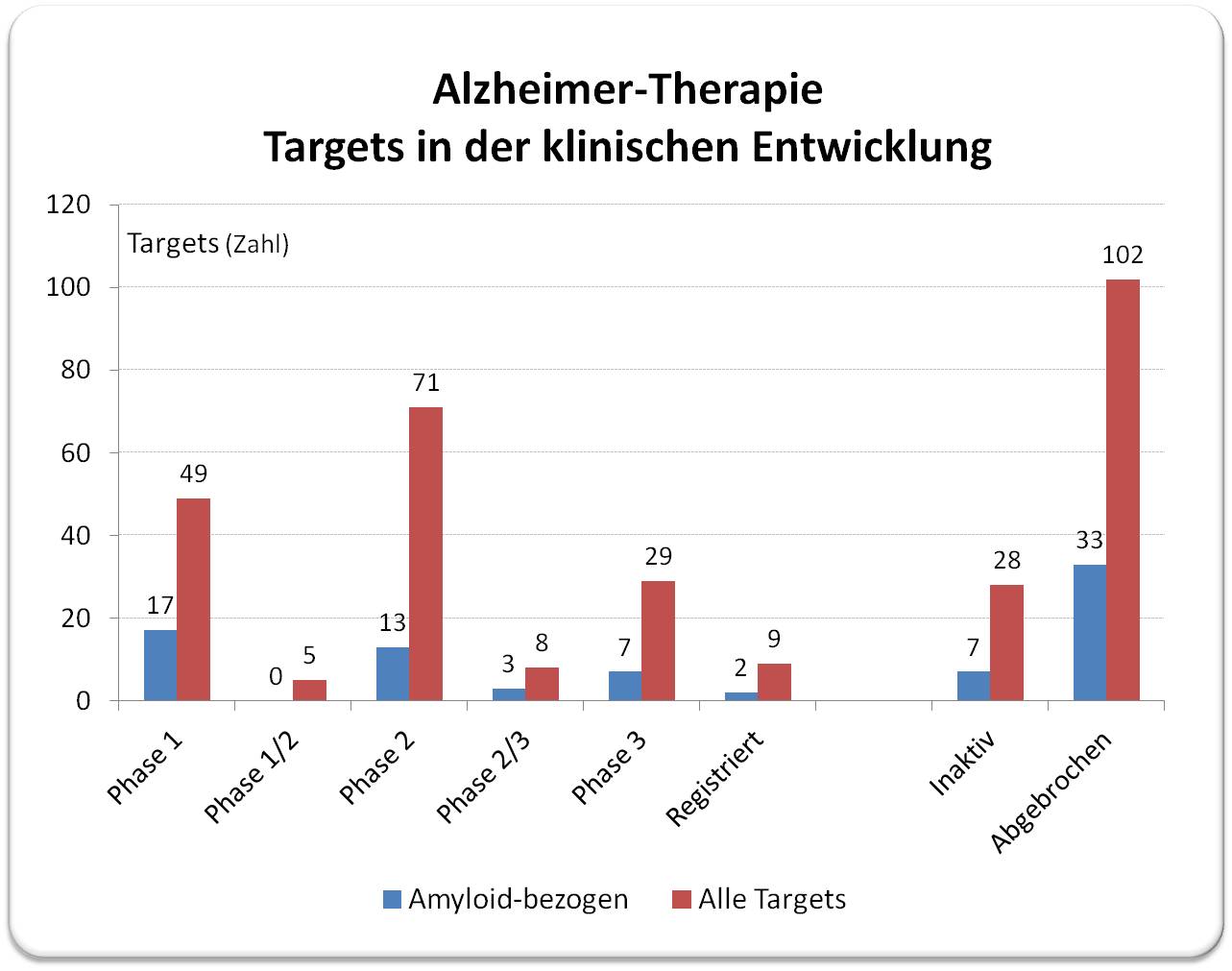
Seit mehr als 30 Jahren gehört Hemmung der Bildung von Amyloid-Aggregaten/Auflösung der Amyloid-Plaques zu den wichtigen Strategien in Forschung und Entwicklung von Alzheimer-Therapeutika. Laut der kuratierten Datenbank von Alzforum (https://www.alzforum.org/therapeutics) sind bis jetzt insgesamt 314 unterschiedliche Target-Typen in Tausenden klinischen Studien geprüft worden, 81 dieser Targets beziehen sich auf Beta-Amyloid, 9 davon sind Antikörper gegen Beta-Amyloid.
Die Ausbeute an registrierten Präparaten ist äußerst ernüchternd: seit den 1990-er Jahren wurden insgesamt nur 9 Medikamente zugelassen, davon 2 mit Bezug auf Amyloid-Beta (bei beiden handelt es sich um Antikörper gegen Beta-Amyloid). Abbildung 2.
Die Misserfolgsquote von über 97 % ist damit bedeutend höher als für Pharmaka in anderen Indikationen, wo 5 % (im Tumorgbiet) bis 10 % derer, die in die klinische Phase gelangen, auf dem Markt landen.
|
Abbildung 2: Alle bisherigen Alzheimer Targets, die in die klinische Entwicklung gelangten (314), etwa ein Viertel davon (81) betreffen die Blockierung/Auflösung der Amyloid-Plaques.(Grafik aus den Daten vom Alzforum erstellt; https://www.alzforum.org/therapeutics.) |
Neben der marginalen Erfolgsrate ist auch die Wirksamkeit der registrierten Präparate bescheiden: sie können den fortschreitenden kognitiven Abbau etwas verlangsamen, nicht aber stoppen oder gar rückgängig machen.
Die Aduhelm-Saga
Nachdem fast 20 Jahre lang die Entwicklung von Alzheimer-Therapeutika nur Misserfolge gezeitigt hatte, wurde im Juli 2021 von der US-amerikanischen Food and Drug Administration (FDA) ein neues Präparat - Aduhelm (Aducanumab) - zugelassen, genauer gesagt: Aduhelm erhielt eine beschleunigte Zulassung unter der Voraussetzung, dass eine Phase 4 -Studie die klinische Wirksamkeit des Medikaments bestätigen würde und die Anwendung sich auf Patienten in frühem Krankheitsstadium mit milden Symptomen beschränkte.
Forschung und Entwicklung von Aduhelm
Aduhelm ist eine Entdeckung des Schweizer Biotech-Unternehmens Neurimmune, eines Spin-offs der Universität Zürich, das um das Jahr 2000 schützende Anti-Amyloid-Antikörper bei gesunden älteren Menschen und Patienten mit langsam fortschreitender Demenz entdeckte und daraus den monoklonalen humanen Antikörper Aduhelm entwickelte [1].
Dieser Antikörper bindet spezifisch an eine Stelle (Epitop) des Amyloids in den Geweben der Patienten. Intravenös verabreicht passiert Aduhelm die Blut-Hirn-Schranke, bindet an das Beta-Amyloid im Gehirn und löst damit Immunreaktionen aus, die die Amyloid-Ablagerungen auflösen und beseitigen.
2007 hat Neurimmune den Antikörper an das US-Biotechunternehmen Biogen - einem Pionier in der Alzheimer-Forschung - auslizensiert, der diesen dann - zusammen mit dem japanischen Konzern Eisai - präklinisch und klinisch entwickelte.
In einer Studie im Jahr 2016 konnte mit Hilfe der Positron Emission Tomographie (PET) gezeigt werden, dass der Antikörper dosis- und zeitabhängig die Beta-Amyloid-Ablagerungen auflöste - nicht gezeigt wurde aber, wieweit die Reduktion der Plaques mit einer besseren kognitiven Leistung korrelierte.
Bezüglich der kognitiven Leistung lieferten 2019 zwei große klinische Studien an Patienten mit leichten Symptomen im frühen Stadium der Alzheimer-Krankheit widersprüchliche Ergebnisse: Obwohl die Behandlung mit Aduhelm die Amyloid-Ablagerungen stark reduzierte, konnte in einer der Studien (ENGAGE) keine Verbesserung der Gedächtnisleistungen im Vergleich zur Plazebogruppe gezeigt werden. In der zweiten Studie (EMERGE) war nach Auswertung weiterer Daten ein leichter Unterschied (18 - 22 % verlangsamte Verschlechterung gegenüber der Kontrollgruppe) in der hochdosierten Medikamentengruppe zu sehen. Die Reduktion der Plaques rief bei bis zu einem Drittel der Patienten Nebenwirkungen hervor, die im Gehirnscan als Schwellungen und Mikroblutungen des Gehirns erkennbar waren (sogenannte Amyloid-bedingte Bildgebungsanomalien (ARIA)) und in einigen Fällen schwerwiegende Folgen hatten.
Eine umstrittene Zulassung
2020 haben Biogen/Eisai den Zulassungsantrag bei der FDA eingereicht.
Die wissenschaftlich hochrangigen Mitglieder eines unabhängigen Beratergremiums der FDA haben wegen des Fehlens eindeutiger Wirksamkeitsnachweise und bedenklicher Sicherheitsaspekte gegen die Zulassung gestimmt. Die FDA hat dennoch am 7. Juni 2021 für eine beschleunigte Zulassung entschieden, wobei sie den Nachweis der Plaque-Reduktion durch Aduhelm als Surrogatmarker - Ersatzmesswert - für die wahrscheinliche Wirkung am Patienten akzeptierte. Der FDA schien es wichtig, dass nach fast 20 Jahren von Misserfolgen nun mit Aduhelm der erste Vertreter einer neuen Klasse von Alzheimer-Therapeutika registriert wurde.
Viele Experten haben die Zulassung als eine der schlechtesten Entscheidungen der FDA bezeichnet. Die Zulassung stieß auch auf heftige Kritik vieler Organisationen wie beispielsweis des amerikanischen Konsumentenschutzes ("Die Entscheidung zeigt eine rücksichtslose Missachtung der Wissenschaft und schadet der Glaubwürdigkeit der Behörde"), ebenso wie der Medien (New York Times: "How Aduhelm, an Unproven Alzheimer's Drug, Got Approved").
Angesichts einer fragwürdigen Wirksamkeit und mangelnder Sicherheit verweigerte die Europäische Arzneimittel-Agentur (EMA) jedenfalls die Zulassung.
Aduhelm wird ein Flop...
Biogen hatte anfänglich den Preis des Medikaments auf 56.000 US-Dollar pro Jahr und Patient festgesetzt und später auf die Hälfte reduziert. Der hohe Preis und die Skepsis gegen das Medikament führten zu viel, viel weniger Verschreibungen als Biogen erwartet hatte. Dazu kam, dass dies US-Krankenversicherung Medicare die Erstattung auf Patienten beschränkte, die an klinischen Studien teilnahmen. Biogen konnte damit nur einen Bruchteil der erwarteten Umsätze einfahren.
Die Firma hat nun die klinische Studie ENVISION, mit der sie den von der FDA geforderten Wirksamkeitsnachweis erbringen wollte, weitere Entwicklungsarbeiten und das Marketing gestoppt und die Rechte an Aduhelm dem ursprünglichen Entdecker Neurimmune zurückgegeben.
... Nachfolger Leqembi bereits vorhanden
Dieser Schritt war offensichtlich nicht nur dem schlechten Abschneiden von Aduhelm geschuldet: Zusammen mit Eisai hatte Biogen ja mit Leqembi (Lecanemab) bereits einen Nachfolger mit besseren Erfolgsaussichten entwickelt. Dessen Wirksamkeit - eine bescheidene Verlangsamung des kognitiven Abbaus um 27 % - bei Patienten im frühen Stadium der Erkrankung (Studie CLARITY AD) reichte der FDA, um Leqembi 2023 als zweiten Amyloid-Antikörper zuzulassen - allerdings mit einer Black-Box-Warnung (das bedeutet: das Medikament kann ernste bis lebensbedrohende Nebenwirkungen ausllösen), da auch Leqembi die von Aduhelm bekannten Nebenwirkungen, Amyloid-bedingte Bildgebungsanomalien, hervorruft.
Leqembi gilt als Hoffnungsträger, da derzeit keine Therapie am Markt ist, die den Krankheitsprozess umkehreren/stoppen kann oder zumindest einen günstigeren Verlauf verspricht. Allerdings steht nun offensichtlich ein neuer Amyloid-Antikörper - Donanemab - des Pharmakonzerns Eli Lilly vor der Zulassung. Von Donanemab liegen als ausreichend eingestufte Wirksamkeitsdaten vor; allerdings ruft das Präparat - ebenso wie Aduhelm und Leqembi (und andere bis jetzt untersuchte Amyloid-Antikörper) - die auf Amlyoid-zurückführbaren Nebenerscheinungen - Gehirnschwellung en und Mikroblutungen - hervor.
Um der Konkurrenz zu begegnen, muss sich Biogen anstrengen und nun voll auf die Vermarktung von Leqembi konzentrieren.
Nachsatz
Ob die neuen Präparate die Alzheimer-Therapie revolutionieren werden, ist ungewiss. Das behandelbare Patientenkollektiv beschränkt sich (derzeit) ja nur auf Erkrankte im Frühstadium, die dazu auch u.a. mittels Gehirnscans selektiert und dann überwacht werden müssen, um die Amyloid-bedingten Nebenwirkungen möglichst gering zu halten. Da es derzeit keine Medikamente am Markt gibt, die Alzheimer heilen oder den Verlauf günstig modifizieren können, werden wohl viele dieser Patienten zu dem "Strohhalm" der Anti- Amyloid-Antikörper greifen und hoffen damit das Fortschreiten der Erkrankung längerfristig aufhalten zu können.
[1] Ch. Hock et al., Antibodies against Slow Cognitive Decline in Alzheimer’s Disease. Neuron, Vol. 38, 547–554, May 22, 2003.
Die Alzheimer-Erkrankung im ScienceBlog
Inge Schuster, 14.08.2022: Alzheimer-Forschung - richtungsweisende Studien dürften gefälscht sein
Irina Dudanova, 23.09.2021: Wie Eiweißablagerungen das Gehirn verändern
Francis S. Collins, 14.02.2019: Schlaflosigkeit fördert die Ausbreitung von toxischem Alzheimer-Protein
Inge Schuster, 24.06.2016: Ein Dach mit 36 Löchern abdichten - vorsichtiger Optimismus in der Alzheimertherapie
Francis S. Collins, 27.05.2016: Die Alzheimerkrankheit: Tau-Protein zur frühen Prognose des Gedächtnisverlusts
Gottfried Schatz, 03-07.2015: Die bedrohliche Alzheimerkrankheit — Abschied vom Ich