Aus der Werkzeugkiste der Natur - Zum Potential von Cytochrom P450 Enzymen in der Biotechnologie
Aus der Werkzeugkiste der Natur - Zum Potential von Cytochrom P450 Enzymen in der BiotechnologieFr, 13.02.2015 - 08:49 — Rita Bernhardt

![]() Cytochrom P450 (abgekürzt CYP) ist der Sammelname einer Superfamilie von Tausenden Enzymen, die in praktisch allen Lebensformen unserer Biosphäre vorkommen. CYPs können auf unterschiedlichen Reaktionswegen verschiedenste Moleküle oxydieren. Die Biochemikerin Rita Bernhardt (Lehrstuhl für Biochemie, Universität Saarbrücken) ist Expertin auf dem Gebiet biotechnologischer Anwendungen von CYPs. Sie gibt Beispiele, wie diese überaus effizienten Biokatalysatoren industriell genutzt werden.
Cytochrom P450 (abgekürzt CYP) ist der Sammelname einer Superfamilie von Tausenden Enzymen, die in praktisch allen Lebensformen unserer Biosphäre vorkommen. CYPs können auf unterschiedlichen Reaktionswegen verschiedenste Moleküle oxydieren. Die Biochemikerin Rita Bernhardt (Lehrstuhl für Biochemie, Universität Saarbrücken) ist Expertin auf dem Gebiet biotechnologischer Anwendungen von CYPs. Sie gibt Beispiele, wie diese überaus effizienten Biokatalysatoren industriell genutzt werden.
Seit Jahrtausenden machen wir von Prozessen der Mikroorganismen Gebrauch, beispielsweise um Nahrungs- und Genussmittel – vor allem Brot, Käse, Bier und Wein - herzustellen. Wir wenden dabei Verfahren an, die heute unter die Definition Biotechnologie, besser gesagt „Weiße Biotechnologie“ fallen. „Weiße Biotechnologie“ bedeutet: die industrielle Nutzung von in der Natur vorkommenden und zumeist noch zweckentsprechend optimierten Enzyme (Enzyme sind Biokatalysatoren) und lebenden Zellen, vor allem von Mikroorganismen. Die Liste der Anwendungen ist lang. Optimierte Enzyme
- können bereits bei niedrigen Temperaturen Stärke, Eiweiß und Fette abbauen und sind aus modernen Waschmitteln nicht mehr wegzudenken,
- spielen hinsichtlich Geschmack und Konservierung eine essentielle Rolle in der Nahrungsmittelproduktion,
- werden vor allem aber zur Synthese komplizierter Substanzen – beispielsweise von Arzneistoffen - aus relativ einfachen und billigen Ausgangsstoffen eingesetzt.
Ein außergewöhnlich hohes Potential für biotechnologische Anwendungen aller Art haben dabei Enzyme aus der Superfamilie der Cytochrome P450.
Was sind Cytochrome P450?
Diese, kurz als CYP bezeichneten, Mitglieder einer Superfamilie von Enzymen sind in praktisch allen Lebensformen zu finden. Ihr Ursprung datiert in eine frühe Phase unseres Planeten zurück, vermutlich noch bevor Sauerstoff zu einem wesentlichen Bestandteil unserer Atmosphäre wurde. Darauf weisen zumindest die Stammbäume hin, die aus Sequenzvergleichen der CYP-Gene erstellt wurden und, dass CYPs auch heute noch in vielen Typen prokaryotischer Zellen - Bakterien und Archaea - vorkommen. Aus der Urform haben sich im Lauf der Evolution dann verschiedenste Formen entwickelt, wie wir sie heute im Pilz-, Pflanzen-und Tierreich vorfinden - mehr als 21 000 derartige Formen waren bereits 2014 beschrieben; Tendenz steigend.
Allen diesen Formen gemeinsam ist, dass sie eine sehr ähnliche dreidimensionale Architektur besitzen und nach demselben Funktionsprinzip operieren:
CYPs sind Hämoproteine, das bedeutet: sie enthalten den roten Blutfarbstoff Häm. Mit Hilfe dieser Hämgruppe binden CYPs Sauerstoff und führen diesen in eine hochreaktive Form über. Mit solcherart aktiviertem Sauerstoff können CYPs dann unterschiedliche Reaktionstypen eingehen und damit eine ungeheure Vielzahl und Vielfalt an Verbindungen - Substraten - oxidieren. Es sind dies niedermolekulare, zumeist fettlösliche Verbindungen, für welche die Enzyme mehr oder weniger passgenaue (spezifische) Bindungstaschen bereithalten. Als Substrate fungieren dabei sowohl zell-/körpereigene (endogene) Stoffe als auch eine immense Zahl zell-/körperfremder (exogener) Substanzen:
Endogene Substrate sind im Menschen beispielsweise Fettsäuren, Steroide und Prostaglandine: sowohl in deren Synthese als auch in deren Abbau sind unterschiedliche CYPs entscheidend involviert. In anderen Worten: CYPs produzieren damit nicht nur lebenswichtige, pharmakologisch aktive Substanzen, sie regulieren auch – via Abbau - deren Konzentrationen.
Exogene Substrate sind nahezu alle niedermolekularen Stoffe in unserer Umwelt, u.a. Inhaltsstoffe unserer Nahrung, Arzneimittel, organische Lösemittel, Kohlenwasserstoffe, Pestizide, Karzinogene, etc. Hier steht in erster Linie der Schutz unserer Körperzellen vor Fremdstoffen im Vordergrund: durch (zum Teil mehrfache) Oxidation werden möglicherweise toxische Eigenschaften von Verbindungen - zumindest meistens - beseitigt („Entgiftung“ ), gleichzeitig nimmt deren Löslichkeit zu und dementsprechend ihre Anreicherung im zellulären Milieu ab. Die oxidierten Fremdstoffe können dann aus den Zellen und den ganzen Organismen ausgeschieden werden.
Natürlich kann die Vielzahl an Substraten in einem Organismus nicht durch wenige Formen von Cytochrom P450-Enzymen bewältigt werden. So weist der Mensch 57 verschiedene Formen auf (deren Funktionen wir zum Teil noch nicht im Detail kennen), die meisten davon katalysieren in hochspezifischer Weise die Synthese und den Abbau körpereigener Verbindungen, beispielsweise von Steroidhormonen, Vitamin D oder Gallensäuren. Rund 15 CYP-Formen mit wesentlich geringeren Spezifitäten sind vorwiegend in den Abbau von Fremdstoffen involviert.
Pflanzen können mehrere hundert CYP-Formen enthalten (beispielsweise sind es 273 CYPs in der Ackerschmalwand - Arabidopsis thaliana). Auch hier haben die CYPs essentielle Funktionen in der Synthese von i) Signalmolekülen und Hormonen, die für das Wachstum benötigt werden, ii) von schützenden Substanzen gegen UV-Strahlung und parasitäre Angriffe (Flavonoide, Phytoalexine, Terpene), iii) von Pigmenten (Anthocyanine, Karotinoide) und auch iv) von Strukturpolymeren (Ligninen).
CYPs in Forschung und Anwendung…
Keine andere Gruppe von Enzymen zeigt eine ähnliche Breite akzeptierter Substrate, keine eine solche Fülle von Reaktionstypen wie die CYPs. Dies zieht das Interesse von Forschern unterschiedlichster Fachrichtungen an sich – seit der Entdeckung des ersten CYP vor rund 50 Jahren sind in der Literaturdatenbank PubMed unter dem Stichwort „Cytochrome P450“ mehr als 80 300 Veröffentlichungen zu finden. Zentrale Aspekte der CYP-Forschung –Grundlagenforschung und mögliche Anwendungen -sind in Abbildung 1 gegeben.
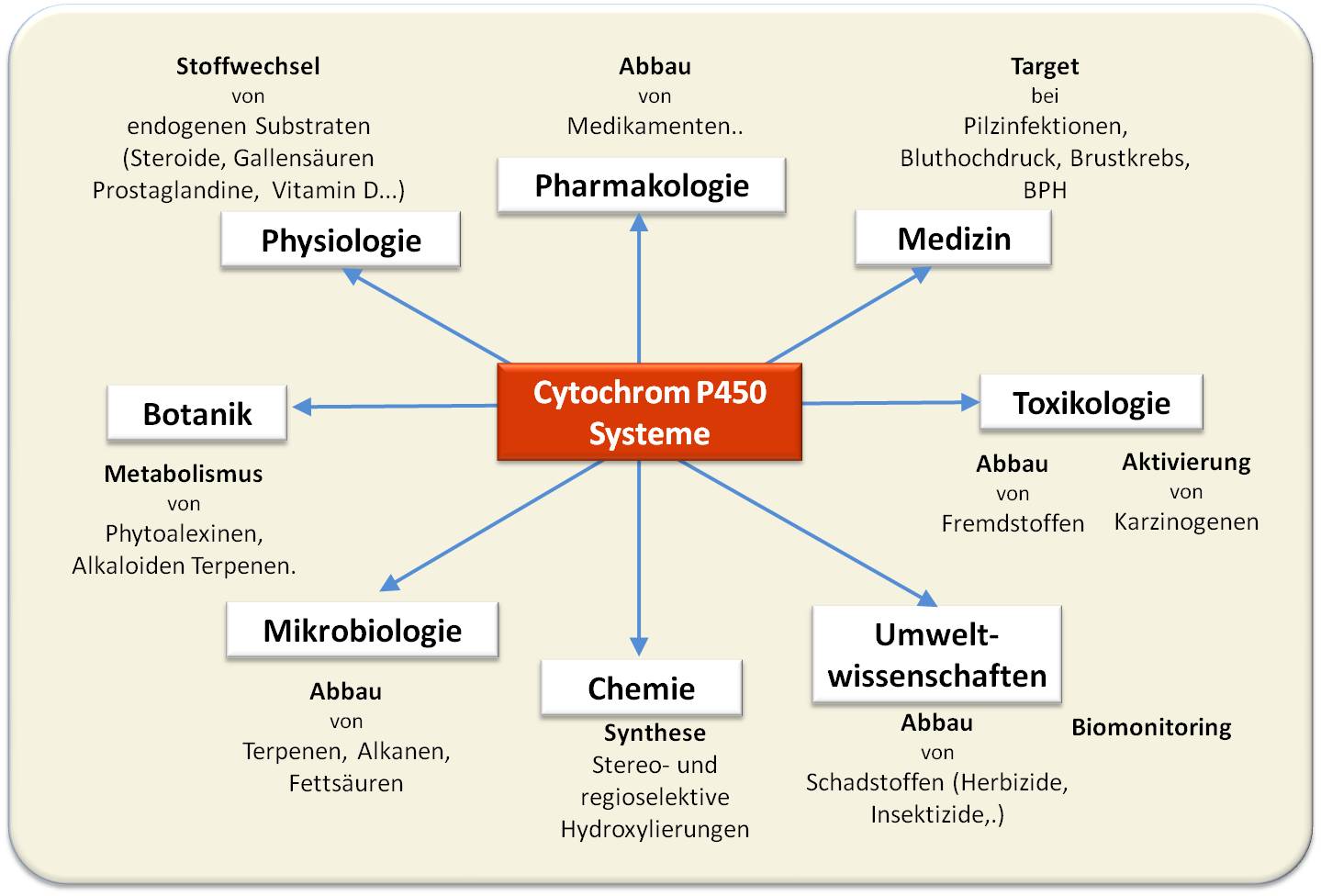 Abbildung 1. Funktion und Anwendungen von Cytochrom P450 Enzymen
Abbildung 1. Funktion und Anwendungen von Cytochrom P450 Enzymen
…speziell in Hinblick auf biotechnologische Prozesse
Von besonderem Interesse erscheint der Einsatz von CYPs, wenn es um die effiziente Synthese komplizierter organischer Moleküle geht: dabei kann es sich um Feinchemikalien handeln, um pharmakologisch wirksame Substanzen und in besonderem Maße um neue Arzneimittel.
Gegenüber chemischen Syntheseverfahren versprechen derartige biotechnologische Ansätze enorme Vorteile. Vor allem,
- weil hier hochspezifische Reaktionen ablaufen, die vorzugsweise das gewünschte Produkt erzeugen und zwar in der richtigen räumlichen Struktur und weitgehend ohne möglicherweise schädliche Nebenprodukte und
- weil dies unter wesentlich umweltverträglicheren Bedingungen geschieht, d.i. unter Vermeidung von Abgasen und bei stark reduziertem Einsatz von organischen Reagenzien und Lösungsmitteln.
Kann man hier isolierte CYPs einsetzen?
Die einfachste Möglichkeit wäre es, CYPs mit den gewünschten katalytischen Eigenschaften aus dem riesigen Reservoir der Natur auszuwählen und in isolierter, möglicherweise zusätzlich optimierter Form direkt zur industriellen Produktion von Substanzen einzusetzen. Dies stößt (noch) auf eine Reihe von Schwierigkeiten:
i) CYPs sind im isolierten Zustand meistens nur wenig stabil,
ii) sie benötigen für ihre Umsetzungen spezifische Reaktionspartner – ein oder mehrere andere Proteine - mit ebenfalls limitierter Stabilität – und
iii) Kofaktoren, die teuer sind und während der Reaktion verbraucht werden.
iv) Darüber hinaus arbeiten die meisten natürlichen CYPs ziemlich langsam.
Zellen als lebende Biofabriken
Mit der Verwendung von CYPs in ganzen intakten Zellen werden die genannten Schwierigkeiten umgangen. Vorzugsweise kommen Mikroorganismen wie beispielsweise Hefen (z.B. Saccharomyces cervisiae oder Schizosaccharomyces pombe) oder Bakterien (z.B. Escherichia coli) zum Einsatz. Diese sind häufig genmanipuliert, d.h. sie enthalten ein oder mehrere stabil exprimierte CYPs, welche die gewünschten Umsetzungen ausführen können. Ebenso liegen deren Reaktionspartner vor und Systeme, welche auch die notwendigen Cofaktoren erzeugen und recyceln. Wenn eine Umsetzung noch zu langsam erfolgt und zu wenig Produkt entsteht, wird das betreffende CYP – aber auch sein(e) Reaktionspartner - einem Optimierungsprozess unterzogen:
- mit gezielten Mutationen, wenn die räumliche Struktur des Enzyms (z.B. aus der Röntgen-Kristallanalyse) bekannt ist. Damit lässt sich erreichen, dass beispielsweise das Substrat besser in die Bindungstasche des Enzyms passt und/oder dass dessen Wechselwirkung mit dem Reaktionspartner verbessert wird,
- mit zufallsbasierter Mutagenese („gerichteter Evolution“, auch: "Evolution im Reagenzglas" genannt) Damit erhält man vorerst einen großen Pool an Mutanten, aus denen man im nachfolgenden Screening (= Testen auf die gewünschten Eigenschaften) die geeignetsten auswählt. Diese werden dann in eine weitere Runde von „gerichteter Evolution“ und Screening eingesetzt, die potentesten davon wieder in eine neue Runde und dieser Prozess wird solange wiederholt, bis man schließlich zufriedenstellende Eigenschaften, d.h. hohe Produktivität erreicht hat.
Mit diesen Verfahren konnten Umsatzraten auf mehr als das 100-fache, in einem speziellen Fall sogar auf das 9000-fache erhöht werden. Dies ist zweifellos ausreichend, wenn man die Produktion pharmazeutischer Wirkstoffe ins Auge fasst, die ansonsten nur durch langwierige, vielstufige chemische Synthese hergestellt werden können. Die minimalen Anforderungen im biotechnologischen Prozess liegen (nach Mattijs K Julsing, 2008) bei Umsatzraten von 1 mg/Liter Fermentationsbrühe und Stunde und einer Endausbeute von 100 mg im Liter.
Der industrielle Einsatz von CYPs
Das Beispiel Hydrocortison
Bereits in der Mitte des vorigen Jahrhunderts erkannte man, dass dieses in unserem Körper natürlich vorkommende Steroidhormon auch starke entzündungshemmende Eigenschaften besitzt – seitdem ist Hydrocortison aus der Therapie nicht mehr wegzudenken. Das Einsatzgebiet reicht von der Behandlung rheumatoider Erkrankungen über die von Ekzemen bis hin zur Unterdrückung der Immunantwort. Dementsprechend besteht weltweit enormer Bedarf für dieses Steroid oder seine (noch wirkungsvolleren) Analoga und es wird nach effizienten billigen Syntheseverfahren gesucht.
Die ersten rein chemischen Synthesen gingen von Gallensäuren des Rindes aus und benötigten 31 Schritte bis zum Endprodukt – die Herstellungskosten für 1 Gramm Hydrocortison lagen damals (1949) bei 200 $. 1951 entwickelte Djerassi ein Verfahren, das mit dem pflanzlichen Steroid Diosgenin startete; der Syntheseweg wurde kürzer, bieb aber noch immer extrem aufwändig. Die Entdeckung, dass ein Pilz – Rhizopus arrhizus – einen wesentlichen Hydroxylierungschritt im Syntheseweg ausführen kann, brachte den Durchbruch: zur nunmehr semi-synthetischen Herstellung benötigte man insgesamt nur 15 Stufen, die Kosten sanken auf rund 1 $ pro Gramm Hydrocortison (1979).
Wie man später erkannte, war ein mikrobielles CYP für diese Hydroxlierung verantwortlich. In der Folge wurden derartige CYPs zu unentbehrlichen Werkzeugen der Biotechnologie und ermöglichten die großtechnische Produktion unterschiedlichster, höchst wirksamer Steroide.
Paradebeispiel für das Potential der synthetischen Biologie ist der jüngste Erfolg: die „de novo“ Biosynthese von Hydrocortison. Diese findet in gentechnisch veränderter Bäckerhefe (Saccharomyces cerevisiae) statt, die Ausgangsstoffe sind einfachste organische Verbindungen – Glukose oder Ethanol –aus denen das Endprodukt Hydrocortison ohne wesentliche Nebenprodukte entsteht (Abbildung 2).
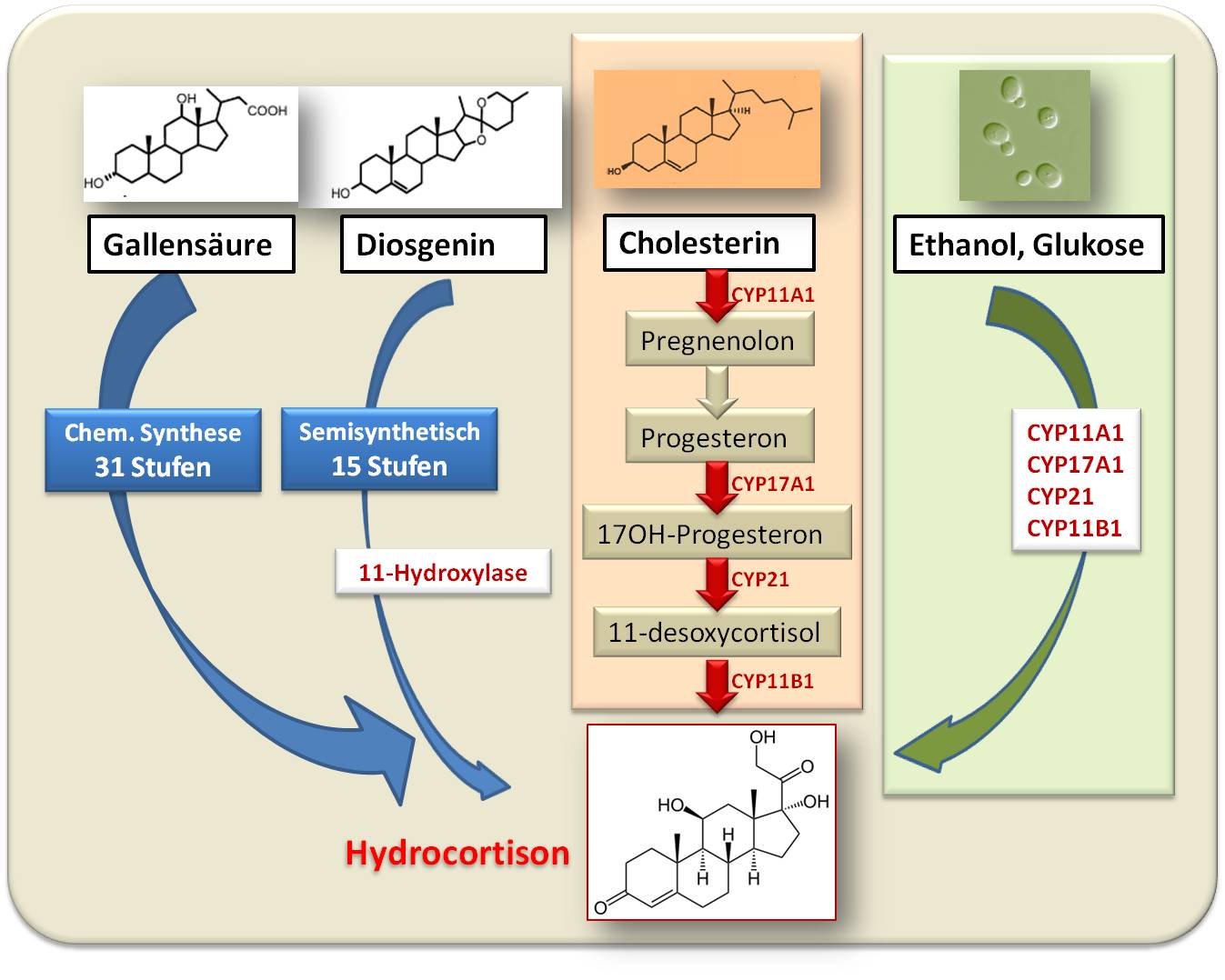 Abbildung 2. Synthese von Hydrocortison (vereinfachte Darstellung). Links: rein chemische Synthese aus Rindergallensäure. Halblinks: semisynthetische Herstellung unter Verwendung eines CYPs in Rhizopus. Mitte: in vivo Synthese aus Cholesterin in Säugerzellen. Rechts: de novo Synthese in gentechnisch manipulierter Hefe (S. Cerevisiae); außer den 4 wesentlichen CYPs (rot) wurden weitere Gene eingeschleust und einige Hefe Gene umfunktionaliert/stillgelegt.
Abbildung 2. Synthese von Hydrocortison (vereinfachte Darstellung). Links: rein chemische Synthese aus Rindergallensäure. Halblinks: semisynthetische Herstellung unter Verwendung eines CYPs in Rhizopus. Mitte: in vivo Synthese aus Cholesterin in Säugerzellen. Rechts: de novo Synthese in gentechnisch manipulierter Hefe (S. Cerevisiae); außer den 4 wesentlichen CYPs (rot) wurden weitere Gene eingeschleust und einige Hefe Gene umfunktionaliert/stillgelegt.
Diese Hefe enthält u.a. die vier wesentlichen CYPs (CYP11A1, CYP17A1, CYP21, CYP11B1), die in Säugerzellen die Umwandlung von Cholesterin zu Hydrocortison katalysieren. Da Hefezellen selbst über kein Cholesterin verfügen und dieses auch nicht aus dem Nährmedium aufnehmen können, mussten mehrere Stoffwechselprozesse der Hefe umfunktionalisiert oder stillgelegt werden, um deren strukturell ähnliches Ergosterol für die Umsetzungen nutzen zu können.
Das Beispiel Artemisinin
An Malaria erkranken jährlich über 200 Millionen Menschen, über 660 000 sterben daran. Schon seit nahezu 2000 Jahren war in der chinesischen Medizin die Wirkung eines Extrakts aus dem Beifußgewächs Artemisia annua gegen diese Infektionskrankheit bekannt. Der darin enthaltene Wirkstoff Artemisinin ist heute essentieller Bestandteil der weltweit angewandten, erfolgreichen Malaria-Kombinationstherapie. Um unabhängig von den schwankenden Wirkstoffgehalten der Pflanze, Ernteerträgen und Lieferengpässen zu werden, wurden nun - ermöglicht durch ein Projekt der Gates-Foundation und one-World Health - semi-synthetische Verfahren zur Produktion von Artemisinin entwickelt. Diese verwenden nun wieder genmanipulierte Bäckerhefe mit dem pflanzlichen CYP71 in optimierter Form, welches in einem 3-Stufenprozess die Artemisinin-Vorstufe erzeugt. Der Sanofi Konzern kann von diesem Rohstoff jährlich bis zu 100 Tonnen erzeugen, der eigentliche Wirkstoff entsteht daraus durch eine photochemische Reaktion.
Das Beispiel Pflanzen mit geänderten Blütenfarben
Als vor ca. 20 Jahren bei einer Tagung ein australischer Wissenschaftler auftrat und verkündete, blaue Rosen herstellen zu wollen, indem er CYPs aus blauen Pflanzen, die dort die blaue Blütenfärbung verursachen, in den Blüten von Rosen zur Expression bringen wollte, war ich skeptisch und fragte mich, wer denn derartige Pflanzen benötigen und kaufen würde. Heute gibt es zwar immer noch keine Kornblumen-blauen Rosen, aber lila- bläuliche, da sich die Farbgebung als komplex und nicht nur CYP- abhängig erwies (Abbildung 3). Dafür gibt es beispielsweise lila (in allen Abstufungen) Nelken und andere Pflanzen mit geänderten Blüten-Farben (hergestellt in einer Kooperation der japanischen Firma Suntory und der australischen Firma Florigen). Als ich die lila Nelken im Original sah, besonders in einem Ikebani- Gesteck, war ich fasziniert. Das geht offenbar nicht nur mir so, denn der Umsatz weltweit beträgt inzwischen > 1 Milliarde Euro jährlich.
 Abbildung 3 Violette Nelken und lila-bläuliche Rosen
Abbildung 3 Violette Nelken und lila-bläuliche Rosen
Wie geht es weiter?
Die Matrize aus Tausenden von CYP Formen mit unterschiedlichen Substratselektivitäten und von verschiedenen CYP Reaktionen an unterschiedlichen Substraten ergibt eine immense Vielfalt von Möglichkeiten für die Anwendung von CYPs in der Biotechnologie, u.a. bei der umweltfreundlicheren Herstellung neuer Wirkstoffe. Die „de novo Synthese von Hydrocortison“ und die „semi-synthetische Produktion von Artemisinin“ sind dafür Paradebeispiele. Weitere Forschungen müssen und werden sicherlich die bisherigen Engpässe bei der Anwendung in den kommenden Jahren überwinden.
R. Bernhardt, V.B. Urlacher: Cytochromes P450 as promising catalysts for biotechnological application: chances and limitations. Appl Microbiol Biotechnol (2014) 98:6185–6203.
R. Bernhardt: Cytochromes P450 as versatile biocatalysts. J Biotech 124 (2006) 128–145
R. Bernhardt: Cytochrome P450: versatile Enzymsysteme mit Anwendungen in der Biotechnologie und Medizin. http://www.uni-saarland.de/fileadmin/user_upload/Campus/Forschung/forsch...
Weiterführende Links
- Cytochrome P450. Enzymfamilie mit zentraler Bedeutung. http://www.pharmazeutische-zeitung.de/?id=40909
- Synthetische Biologie: http://www.dfg.de/download/pdf/dfg_im_profil/reden_stellungnahmen/2009/s...
- Wenn der Mensch Gott Konkurrenz macht: http://www.cas.uni-muenchen.de/pressespiegel/syn_bio_2_muenchner_merkur.pdf
- Malaria-Wirkstoff aus Bäckerhefe: http://www.deutschlandfunk.de/malaria-wirkstoff-aus-baeckerhefe.676.de.h...
- Sanofi launches malaria drug production: http://www.rsc.org/chemistryworld/2013/04/sanofi-launches-malaria-drug-p...