Veranlagung zu Übergewicht: ein Wechselspiel von Genom und Umwelt?
Veranlagung zu Übergewicht: ein Wechselspiel von Genom und Umwelt?Fr, 17.04.2015 - 08:49 — Jens C. Brüning & Martin E. Heß 

![]()
Die steigende Zahl übergewichtiger Menschen und die damit einhergehenden Erkrankungen stellen ein immer größeres Problem für die moderne Gesellschaft dar. Lebenswandel und genetische Veranlagung bestimmen die individuelle Anfälligkeit zur Gewichtszunahme. Durch Identifizierung der für Übergewicht prädisponierenden genetischen Veränderungen und die anschließende Beschreibung der betroffenen Gene/Proteine – auch im Mausmodell – erhoffen sich der Endokrinologe und Genetiker Jens Brüning, Direktor am Max Planck Institut für Stoffwechselforschung in Köln und der Genetiker Martin Heß (ebendort) - Einblicke in die komplexe Interaktion zwischen Genom und Umwelt und damit in die Mechanismen, die zu Übergewicht führen können*.
Übergewicht und Fettleibigkeit stellen für unsere moderne Gesellschaft eine gewaltige Herausforderung dar. Vor einigen Jahren ein Phänomen das vornehmlich in entwickelten Industrienationen zu beobachten war, greift dieser Trend nun auch auf Schwellenländer über. Neueste Schätzungen gehen davon aus, dass rund 1,4 Milliarden Menschen übergewichtig sind und rund ein Drittel dieser bereits als fettleibig gelten (World Health Organization). Viele Begleiterscheinungen der Fettleibigkeit überraschen nicht, z. B. Diabetes mellitus Typ 2, kardiovaskuläre Erkrankungen und Schlaganfälle. Krankhaftes Übergewicht stellt jedoch auch einen Risikofaktor für bestimmte Krebserkrankungen dar und steht sogar im Verdacht, neurodegenerative Erkrankungen wie Alzheimer zu begünstigen. Als Konsequenz sinkt nicht nur die individuelle Lebensqualität, es entstehen darüber hinaus immense Kosten in der Patientenversorgung, die auch in einer großen Volkswirtschaft eine spürbare finanzielle Belastung hinterlassen werden.
Genetische Veranlagung oder Lebenswandel?
Worin liegt nun die Ursache für die stetige Zunahme des Übergewichts in der Bevölkerung? Einzelne Veränderungen (Mutationen) in der kodierenden Sequenz bestimmter Gene können zu einem Verlust der Funktion des Proteins, welches in eben diesem Gen kodiert ist, führen (loss of function mutation). So führt der Funktionsverlust von Leptin, einem Hormon, das von Fettzellen sezerniert wird und Sättigungsgefühl auslöst, unweigerlich zu schwerer Fettleibigkeit, die unbehandelt bereits im Kindesalter zum Tode führen kann.
Könnten solche Formen von monogen (von einzelnen Genen) verursachter Fettleibigkeit verantwortlich für die prozentuale Zunahme übergewichtiger Menschen in der Bevölkerung sein?
Erhebungen, die seit dem Beginn der 70er Jahre des vergangenen Jahrhunderts in den USA gesammelt wurden, zeigen deutlich, dass der Anteil der Übergewichtigen und fettleibigen Menschen an der Bevölkerung seit Anfang der 80er Jahre stetig steigt (Abbildung 1). Mutationen, die zu monogener Fettleibigkeit führen, liegen jedoch nur äußerst selten der bei Menschen beobachteten Fettleibigkeit zu Grunde. Darüber hinaus werden diese Veränderungen des Genoms bereits seit Generationen vererbt und somit waren die seltenen Fälle von schwerer Fettleibigkeit bereits vor den 70er Jahren des 20. Jahrhunderts bekannt.
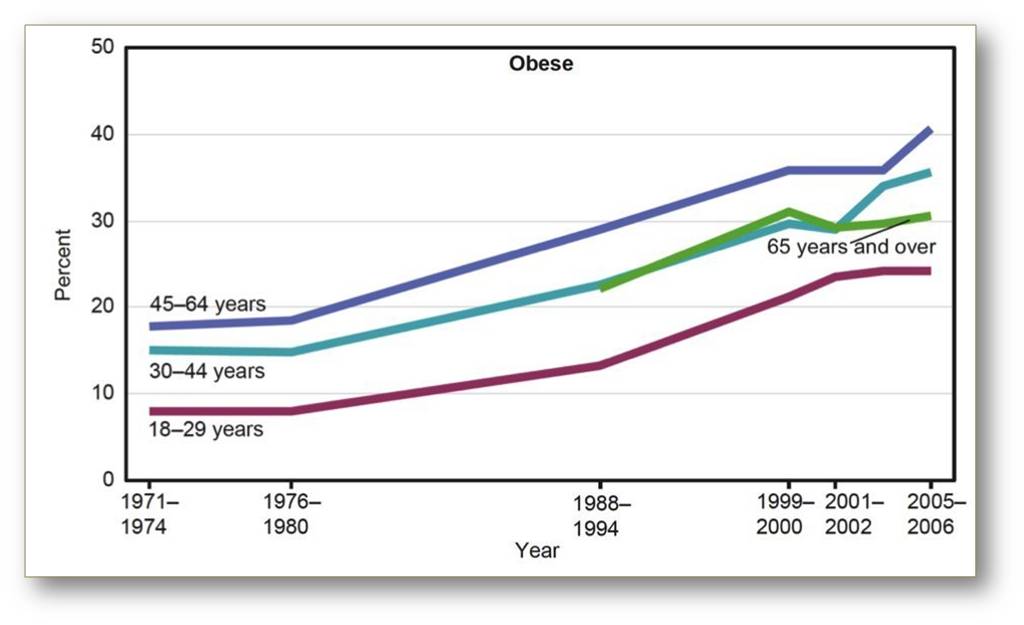 Abbildung. 1: Prozentualer Anteil fettleibiger Menschen (Body-Mass-Index > 30 kg/m²) an der Bevölkerung der USA. obese: fettleibig © Quelle: CDC/NCHS, National Health and Nutrition Examination Survey
Abbildung. 1: Prozentualer Anteil fettleibiger Menschen (Body-Mass-Index > 30 kg/m²) an der Bevölkerung der USA. obese: fettleibig © Quelle: CDC/NCHS, National Health and Nutrition Examination Survey
Das immer häufiger auftretende Übergewicht muss demnach eine andere Ursache haben. Nach heutigen Erkenntnissen sind unsere veränderten Lebensumstände der Kern des Problems. Sesshaftes Leben, Büroarbeitsplatz, automobile Mobilität, fehlende Bewegung und ein ständiges Überangebot an energiereicher und wohlschmeckender Nahrung charakterisieren unsere heutige Gesellschaft. Somit ist es auch nicht überraschend, dass die 1970er Jahre sowohl den Beginn des Siegeszugs der Fastfood-Industrie als auch den Beginn des Gewichtzuwachses in der Bevölkerung markieren.
Können wir also unserem Genom keine Schuld an unserem Übergewicht geben?
Und warum beobachten wir dennoch eine breite Variabilität im Erscheinungsbild unserer Gesellschaft, obwohl jedes Mitglied einer definierten Bevölkerungsgruppe den gleichen Umweltbedingungen und Versuchungen ausgesetzt ist?
Mögliche Antworten werden seit der Entwicklung genomweiter Sequenzierung in Vielzahl geboten. Einzelnukleotid-Veränderungen im menschlichen Genom, sogenannte „single nucleotide polymorphisms“ (SNPs), werden in Verbindung mit bestimmten Krankheitsbildern oder Körpermerkmalen gebracht. Diese Polymorphismen führen jedoch nicht zu einem Funktionsverlust der entsprechenden Gene, vielmehr befinden sich viele dieser Veränderungen in nicht-kodierenden Sequenzen. Wie genau diese Polymorphismen verschiedene Krankheiten oder Funktionen des Körpers beeinflussen, ist meist ungeklärt und stellt eine Herausforderung für die Wissenschaftler dar. Vermutlich wird indirekt die Funktion oder die Expression von Proteinen beeinflusst.
Innerhalb eines menschlichen Genoms befinden sich nun nicht nur eine, sondern viele solcher Einzelnukleotid-Veränderungen. Manche werden mit nachteiligen, andere mit günstigen Effekten für ein bestimmtes Merkmal oder eine Krankheit, wie z. B. Fettleibigkeit, assoziiert. In ihrer Gesamtheit beeinflussen alle im Genom vorhandenen Polymorphismen die individuelle Anfälligkeit für z. B. Übergewicht und somit spricht man in diesem Fall von polygener (durch das Zusammenspiel mehrerer Gen-Loci bedingter) Fettleibigkeit.
Gegenwärtig sind mit Hilfe genomweiter Sequenzierungen 52 Gene identifiziert worden, die innerhalb ihrer Sequenz Polymorphismen aufweisen, die wiederum mit Übergewicht in Verbindung gebracht wurden (Abbildung 2).
Eines dieser Gene kodiert für das fat mass and obesity asssociated protein (FTO).
Tatsächlich war FTO eines der ersten Gene, welches im Jahr 2007 mit Hilfe neuerer und wirtschaftlicherer Methoden der genomweiten Sequenzierung mit Übergewicht in Verbindung gebracht wurde. 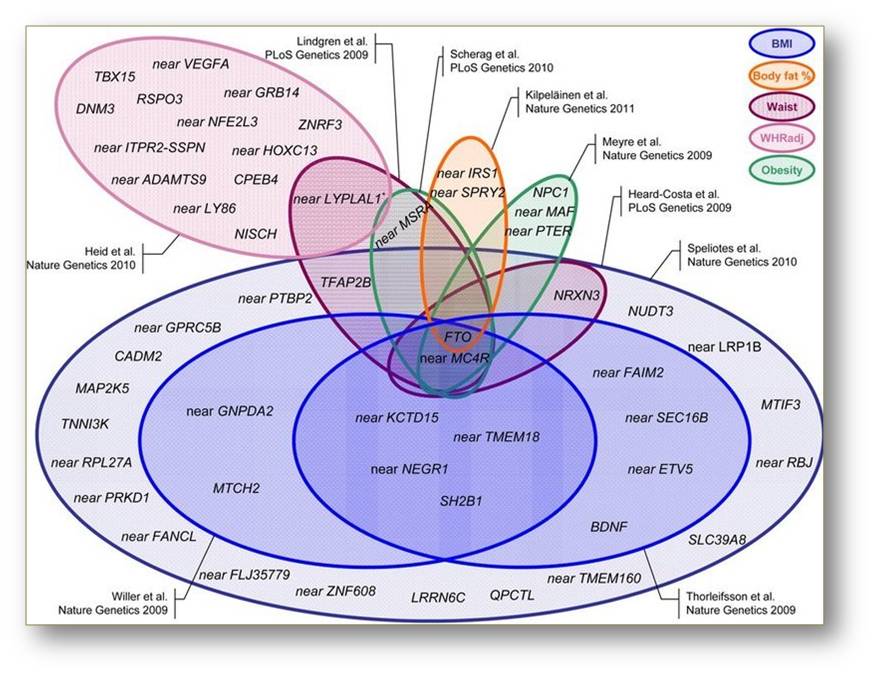 Abbildung 2: Zusammenfassung der bekannten, mit Übergewicht assoziierten Gene, anhand signifikant veränderter Körpermerkmale. Während einige Polymorphismen nur mit einem oder wenigen Körpergewichtsmerkmalen assoziiert sind, stehen FTO-Varianten mit erhöhtem BMI, Körperfettanteil, Hüftumfang und generell Fettleibigkeit in Verbindung. (© Max-Planck-Institut für neurologische Forschung/Loos RJF(2012))
Abbildung 2: Zusammenfassung der bekannten, mit Übergewicht assoziierten Gene, anhand signifikant veränderter Körpermerkmale. Während einige Polymorphismen nur mit einem oder wenigen Körpergewichtsmerkmalen assoziiert sind, stehen FTO-Varianten mit erhöhtem BMI, Körperfettanteil, Hüftumfang und generell Fettleibigkeit in Verbindung. (© Max-Planck-Institut für neurologische Forschung/Loos RJF(2012))
Wie wir nun wissen, befindet sich innerhalb einer (nicht kodierenden) Region des FTO Gens ein Cluster von SNPs, der äußerst signifikant mit einem erhöhten Body-Mass-Index (BMI - bewertet das Körpergewicht in Relation zur Körpergröße) assoziiert ist. Man spricht von Risiko-Allelen (Allel = Genvariante), die für ein erhöhtes Körpergewicht empfänglich machen. Die individuellen Effekte des für ein erhöhtes Körpergewicht prädispositionierenden Risiko-Allels sind hierbei relativ gering. Träger eines FTO-Risiko-Allels haben im Durchschnitt einen um 0.4 kg/m2, Träger von zwei Risiko-Allelen um 0.8 kg/m2 erhöhten Body-Mass-Index im Vergleich zu nicht betroffenen Probanden. Inwiefern eine für Übergewicht prädispositionierende Variation im FTO-Gen mit anderen Risikofaktoren, mit anderen Polymorphismen, die mit Übergewicht assoziiert sind, oder mit Umwelteinflüssen interagiert, ist bis dato nicht bekannt, stellt jedoch einen wichtigen Baustein in der Untersuchung des polygen verursachten Übergewichtes dar.
Das “fat mass and obesity-associated protein” (FTO)
Ausgelöst durch die statistisch höchst signifikante und in verschiedensten ethnischen Gruppen reproduzierte Assoziation der Polymorphismen des menschlichen FTO-Gens mit Übergewicht, widmeten sich Wissenschaftler der Untersuchung des FTO-Proteins. Welche molekulare Funktion erfüllt es? In welchen Organen des Körpers wird es exprimiert bzw. in welchem dieser Organe oder Zellpopulationen erfüllt es eine wichtige Aufgabe? Wie wird seine Expression reguliert? Fragen, welche nur durch die gezielte genetische Manipulation des FTO-Gens beantwortet werden können.
Während der bis jetzt nur wenig beschriebene Verlust des FTO-Proteins in jeder Zelle des menschlichen Körpers verheerende Folgen für die Entwicklung und das Überleben betroffener Patienten hat, führt der Verlust in Mäusen zu einem komplexen Erscheinungsbild (Phänotyp), der unter anderem durch eine erhöhte postnatale Sterberate, geringere Körpergröße, verringerte Fett- und Magermasse, einen erhöhten Energieverbrauch bei reduzierter Bewegung und einen erhöhten sympathischen Tonus charakterisiert ist. Dies bestätigte die Vermutung, dass FTO eine Rolle in dem Gleichgewicht im Energiehaushalt erfüllt. Auf Grund der Komplexität dieses Phänotyps war jedoch eine genauere Einschränkung der molekularen Wirkmechanismen oder involvierten Kontrollmechanismen nicht möglich.
Die Beobachtung, dass FTO insbesondere im Zentralnervensystem exprimiert ist und sowohl der Verlust der Expression des FTO-Gens als auch der des Dopamin-Rezeptors vom Typ 2 in Mäusen ähnliche Charakteristika hervorrufen, legte die Untersuchung des sogenannten dopaminergen „Belohnungs“-Systems nahe. Dieses System beeinflusst durch Ausschüttung des Botenstoffes Dopamin unsere Motivation, eine vorangegangene Handlung zu wiederholen, z. B. eine schmackhafte Speise erneut zu sich zu nehmen oder sogar zielgerichtet danach zu suchen. Zur Untersuchung des dopaminergen Systems wurden neben FTO-defizienten Mäusen auch Mäuse mit einer konditional gerichteten und spezifischen Deletion von FTO in dopaminergen Neuronen verwendet. Hierbei stellte sich heraus, dass der Verlust von FTO die zellulären Antworten abschwächt, die von Dopamin-Rezeptoren abhängen. In FTO-defizienten Mäusen, in denen jede Körperzelle vom Verlust von FTO betroffen ist, führt dies zu einem nahezu kompletten Verlust der bewegungsstimulierenden Wirkung von Kokain (welches normalerweise zu einer Überaktivierung dopaminerger Signalübertragung führt). Die konditionale Deletion von FTO spezifisch in dopaminergen Neuronen hingegen führt zu einem gegenteiligen Effekt und einer Hypersensitivität gegenüber den stimulierenden Effekten von Kokain. Bedingt durch den räumlich limitierten Effekt des FTO Verlustes betrifft die Abschwächung der Dopamin-Rezeptorabhängigen Antworten nur dopaminerge Neurone. Diese Rezeptoren (auch D2/D3-Autorezeptoren genannt) sind Teil einer Feedbackschleife und stellen durch ihre inhibitorische Wirkung sicher, dass die dopaminerge Transmission ein Ende findet. Somit führt der Verlust von FTO in diesen Neuronen zu einer abgeschwächten Feedbackschleife und damit zu hypersensitiver dopaminerger Transmission.
Molekulare Funktion von FTO
Das FTO-Protein ist eine Demethylase und vermag als solche in vitro unterschiedliche Methylierungsmodifikationen verschiedener Nukleotide entfernen. In vivo konnte bis dato N6-Methyladenosin in mRNA (messenger RNA) als Substrat bestätigt werden. Obwohl N6-Methyladenosin bereits seit mehr als 30 Jahren bekannt ist, sind die Konsequenzen, die diese Modifikation hat, weitgehend unbekannt. Kürzlich jedoch konnten Wissenschaftler zeigen, dass N6-Methyladenosin-modifizierte mRNAs von bestimmten Proteinen erkannt, zu sogenannten processing bodies innerhalb einer Zelle transportiert und dort abgebaut werden. Somit beeinflusst die Methylierung die Lebenszeit der Trägermoleküle der genetischen Information, welche als Bauplan zur Herstellung jeglicher Proteine in einer Zelle benötigt werden.
Im Fto-defizienten Mausmodell scheint dies in der Tat der Fall zu sein. Eine Analyse des Methylierungsstatus in Gehirngewebe zeigte, dass ca. 1500 Transkripte auf Grund der fehlenden Demethylase FTO im Vergleich zu einer Wildtyp-Kontrolle übermäßig methyliert sind. Der größte Teil der betroffenen Transkripte kodierte in diesem Fall für Proteine, welche Aufgaben in neuronaler Signalübertragung übernehmen und teilweise auch wichtige Komponenten der dopaminergen Synapse sind.
Es bleibt abzuwarten, ob es sich bei dieser molekularen Funktion um die einzige Aufgabe von FTO handelt, ob in unterschiedlichen Zellpopulationen unterschiedliche Transkripte Ziel der Demethylase FTO sind und ob N6-Methyladenosin einzig eine Markierung zum Abbau von mRNA-Transkripten ist.
Vom Mensch zur Maus und zurück zum Menschen?
Inwieweit können nun die gewonnenen Erkenntnisse im Mausmodell auf den Menschen übertragen werden? Da die Polymorphismen im humanen FTO-Gen keinen unmittelbaren Einfluss auf die Funktion des FTO-Proteins haben, ist diese Frage schwer zu beantworten. Während genetische Nagermodelle einen meist eindeutigen Zustand beschreiben (Verlust oder übermäßiges Vorkommen eines Proteins), ist bis dato nicht bekannt, ob und wenn ja, welchen Einfluss die Einzelnukleotid-Veränderungen auf mRNA oder Proteinmengen von FTO haben.
Der große Wert dieser Grundlagenforschung liegt auch noch in anderen Erkenntnissen. Aus dem Wissen, dass FTO in dopaminergen Zellen von Bedeutung ist, ergeben sich neue Forschungsfragen. Fehlfunktionen des dopaminergen Systems sind nicht nur mit Störungen der Essfunktion, sondern unter anderem auch mit Schizophrenie, Depression, Impulsivität und Suchtverhalten assoziiert. Somit sollte die Untersuchung von FTO-Gen-Variationen auch auf diese und ähnliche Krankheitsbilder unter Zuhilfenahme bereits etablierter Verhaltensparadigmen ausgeweitet werden. Ferner ermöglicht es die gleichzeitige Untersuchung der mit Übergewicht assoziierten FTO-Variationen und bekannter, mit Fehlfunktionen des dopaminergen Systems assoziierter Risiko-Allele: Ziel ist die Identifikation möglicher synergistischer oder einander kompensierender Gen-Gen-Interaktionen. Diese Experimente könnten ein erster Schritt hin zu einem Verständnis individueller Anfälligkeit für Gewichtszunahme sein und Hinweise auf den Zusammenhang zwischen unserem Genom und unserer Umwelt geben.
* Der im Forschungsmagazin der Max-Planck Gesellschaft 2014 erschienene Artikel http://www.mpg.de/7929909/MPInF_JB_2014?c=8236817 wurde mit freundlicher Zustimmung der Autoren und der MPG-Pressestelle ScienceBlog.at zur Verfügung gestellt. Der Artikel erscheint hier geringfügig für den Blog adaptiert und ohne (die im link angeführten Literaturzitate.
Weiterführende Links
Max-Planck-Institut für Stoffwechselforschung: Schwerpunktthemen: zerebrale Kontrolle des Energie- und Glukosestoffwechsels; Zusammenhang von Übergewicht, Insulinresistenz und Typ-2 Diabetes und neurodegenerative Erkrankungen http://www.nf.mpg.de/
Neurotransmitter – Botenmoleküle im Gehirn (U. Pontes): https://www.dasgehirn.info/entdecken/kommunikation-der-zellen/neurotrans...
Prof. Jens C. Brüning http://www.young-cecad.de/Prof-Jens-C-Bru-ning.179.0.html Video 0:47 min. Prof. Brüning interessiert an der Alternsforschung zu verstehen, warum der menschliche Organismus altert. Besonders interessiert ihn der sog. Altersdiabetes, eine Erkrankung, die gehäuft im zunehmenden Alter auftritt. Bei diesem Typ 2-Diabetes funktioniert das körpereigene Hormon Insulin nicht mehr richtig. In Folge dessen kommt es zum Anstieg der Blutzuckerkonzentration.
CECAD (Cellular Stress Responses in Aging Associated Diseases) Exzellenzcluster http://cecad.uni-koeln.de/Home.3.0.html?&L=1
CECAD - Das Exzellenzcluster für Alternsforschung Video 2:59 min
CECAD Forschungsbereich F / "Warum entsteht Hunger im Gehirn?" Video 210 min
Ich esse, also bin ich! Video 3:19 min