Biologische Kollagenimplantate in der Hernienchirurgie – quo vaditis?
Biologische Kollagenimplantate in der Hernienchirurgie – quo vaditis?Fr, 12.02.2016 - 10:50 — Alexander Petter-Puchner

![]() Bei der Leistenbruchoperation ist das Kunststoffnetz seit zwei Jahrzehnten der Standard, der zur Verstärkung des Verschlusses eingesetzt wird. Auf der Suche nach verbesserten Materialien erschienen Bionetze aus Kollagen besonders erfolgsversprechend und fanden breiten Eingang in die Hernienchirurgie – ohne, dass aussagekräftige klinische Studien vorangegangen wären. Der Wiener Chirurg Alexander Petter-Puchner, Experte für Herniechirurgie, zeigt hier die Problematik der übereilten Einführung eines biomedizinischen Produktes auf.
Bei der Leistenbruchoperation ist das Kunststoffnetz seit zwei Jahrzehnten der Standard, der zur Verstärkung des Verschlusses eingesetzt wird. Auf der Suche nach verbesserten Materialien erschienen Bionetze aus Kollagen besonders erfolgsversprechend und fanden breiten Eingang in die Hernienchirurgie – ohne, dass aussagekräftige klinische Studien vorangegangen wären. Der Wiener Chirurg Alexander Petter-Puchner, Experte für Herniechirurgie, zeigt hier die Problematik der übereilten Einführung eines biomedizinischen Produktes auf.
Jedes Jahr werden weltweit mehr als drei Millionen Operationen an Bauchwand-, oder Leistenbrüchen („Hernien“) durchgeführt, bei denen Kunststoffnetze oder biologische Matrices („Bionetze“) zum Einsatz kommen. Diese Implantate verfolgen den Zweck, das Gewebe zu verstärken und die Spannung, die erforderlich ist, um den Defekt der Bauchwand (Abdominalwand)zuverlässig zu verschließen, zu reduzieren. Der Standard ist seit mehr als zwanzig Jahren der Einsatz von Netzen aus Polypropylen oder Polyester: diese werden zwar vom Körper generell sehr gut toleriert, können aber je nach Porengröße und Beschichtung anfällig für eine Besiedelung mit Bakterien sein und auch nicht abgebaut werden. Ausgehend von Diskussionen über Sinn und Risiken von nicht resorbierbaren Fremdmaterialen und dem starken Aufkommen von biologischen, abbaubaren Fixationsmaterialien (zB Fibrinkleber, siehe [1]) erschien es naheliegend, sogenannte biologische Netze aus bovinem (vom Rind), porcinem (vom Schwein) oder auch humanem Kollagen zum Einsatz in der Hernienchirurgie zu bringen (Abbildung 1). Diese Materialien stellten ursprünglich allesamt keine Neuentwicklungen für diese Anwendungen dar, sondern waren Adaptionen bestehender Produkte aus der Gefäß- und der Wiederherstellungschirurgie.
 Abbildung 1. Kollagenfasern im Bindegewebe der Haut als Ausgangsmaterial der biologischen Netze (mit den Augen des Graphikers gesehen). Die Kollagenfasern (Längs-und Querschnitt) der Dermis (Lederhaut) bilden ein dichtes Netzwerk. In den Bildern jeweils links: ein Fibroblast (blau), die Hauptzelle der Dermis, rechts: eine angeschnittene Blutkapillare, aus der ein rotes Blutkörperchen (Erythrozyt) austritt, oben:basale Zellschicht (Keratinozyten) der Epidermis (Oberhaut). Quelle: N0019489 Credit Medical Art Service, I. Christensen, Wellcome Images. Licensed CC by-nc-nd 4.0.
Abbildung 1. Kollagenfasern im Bindegewebe der Haut als Ausgangsmaterial der biologischen Netze (mit den Augen des Graphikers gesehen). Die Kollagenfasern (Längs-und Querschnitt) der Dermis (Lederhaut) bilden ein dichtes Netzwerk. In den Bildern jeweils links: ein Fibroblast (blau), die Hauptzelle der Dermis, rechts: eine angeschnittene Blutkapillare, aus der ein rotes Blutkörperchen (Erythrozyt) austritt, oben:basale Zellschicht (Keratinozyten) der Epidermis (Oberhaut). Quelle: N0019489 Credit Medical Art Service, I. Christensen, Wellcome Images. Licensed CC by-nc-nd 4.0.
Man ging davon aus, dass diese Materialien sich vollständig in das Narbengewebe integrieren und dieses damit verstärken würden ohne mit dem Verbleib von Fremdmaterial das Risiko von Fremdkörper- oder immunologischen Abstoßungsreaktionen in Kauf nehmen zu müssen.
Die Einführung auf den Markt war von vielen Versprechungen und Argumenten geprägt, die zu diesem Zeitpunkt weder bewiesen noch widerlegt worden waren. Damit stellt die Geschichte der „Bionetze“ ein gutes Beispiel dafür dar, wie biomedizinische Produkte besser nicht die klinische Bühne betreten sollten.
Der folgende Text versucht die Entwicklung der letzten zehn Jahre nachzuvollziehen – wie ursprüngliche „Hype und Euphorie“ in „Ernüchterung“ umschlugen.
Hype und Euphorie
Wie bereits erwähnt, fanden anfänglich (2005-2009) viele Kollagenprodukte aus anderen chirurgischen Gebieten Eingang in die Hernienchirurgie. Dabei gab es anfangs drei, später zwei voneinander deutlich abgesetzte Produktgruppen:
- humane Kollagenimplantate, die aus Leichenhaut gewonnen wurden. Während diese Implantate (zb. Alloderm® oder Allomax®) in den USA Verbreitung fanden, konnten sie aufgrund der extrem aufwändigen Herstellungs- und Prüfverfahren und eines sehr hohen Verkaufspreises (>40 € pro cm2!), in Europa nie Fuß fassen.
- Die zwei anderen Gruppen sind bis zum heutigen Tag quervernetzte und nicht quervernetzte, tierische Kollagenimplantate.
Die Quervernetzung bedingt, dass die Kollagen- (landläufig: Bindegewebs-) –fasern chemisch oder physikalisch stabilisiert werden und damit vor dem Abbau durch Enzyme (Kollagenasen) geschützt werden. Kollagenasen sind Teil des enzymatischen Cocktails, der bei jeder Entzündungsreaktion freigesetzt wird, da sie das Gewebe eben „andauen“, um so das Feld für die Einwanderung immunkompetenter Zellen aufzubereiten. Quervernetzte Implantate sollten mechanisch dauerhaft stabiler sein, wenn auch um den Preis eines langsameren Einwachsens körpereigener Zellen. Korrekterweise soll angemerkt werden, dass auch sogenannte nicht quervernetzte Implantate durch die Sterilisierungsverfahren soweit stabilisiert werden, dass das Kollagen als feste Matrix und nicht als Paste vorliegt.
Nicht quervernetzte Implantate, so die Theorie, würden zwar rascher resorbiert, also abgeräumt, würden jedoch, so das Versprechen der Hersteller, das Narbengewebe dennoch dauerhaft verstärken.
Diese neue Auswahl an „Netzen“ (wobei der Begriff irreführend ist, da es sich wie bemerkt um dreidimensionale Matrices handelt) erschien für die Chirurgie weltweit verlockend. Vollständige Resorption bei gleichzeitiger Verstärkung des vorhandenen Bindegewebes, sowie eine besonders gute Eignung in infizierten Wundgebieten - das war das Versprechen in dieser Zeit der Euphorie.
Gerade die letztgenannte Eigenschaft, die Kollagenimplantaten zugeschrieben wurde und lange das Hauptargument der Fürsprecher der Bionetze war, nämlich die Resistenz gegen Keimbesiedelung, ja sogar die Keimreduktion, ist seit über einer Dekade ein heftig umstrittenes Thema, das sich eines schlüssigen Nachweises hartnäckig entzogen hat. Experimentelle Studien haben von Anfang an kritische Fragen zur Verträglichkeit und den scheinbar kaum vorhersehbaren Abbauprozessen gestellt. (Es wurde extrem rascher Abbau nicht quervernetzter, sowie eine gegenteilige Reaktion, im Sinne einer ausgeprägten Granulombildung bei quervernetzten Kollagenimplantaten beobachtet.)
Im Nachhinein erscheint es unverständlich, warum diese experimentellen Arbeiten über Jahre hinweg so vehement negiert wurden, obwohl sie Komplikationen, die in den klinischen Publikationen noch als Einzelfälle beschrieben und als individuelle Phänomene abgetan wurden, im Detail systematisch auflisteten.
Ernüchterung
Während, wie eingangs erwähnt, Kollagenimplantate in großem Stil v.a. in Nordamerika und im Süden Europas zum Einsatz kamen und einen Milliarden schweren Markt begründeten, blieb der zentraleuropäische Raum skeptisch. Bald schon häuften sich klinische Berichte über hohe Rezidivraten (Wiederauftreten des Bruches) und Komplikationsraten. (Abbildung 2)
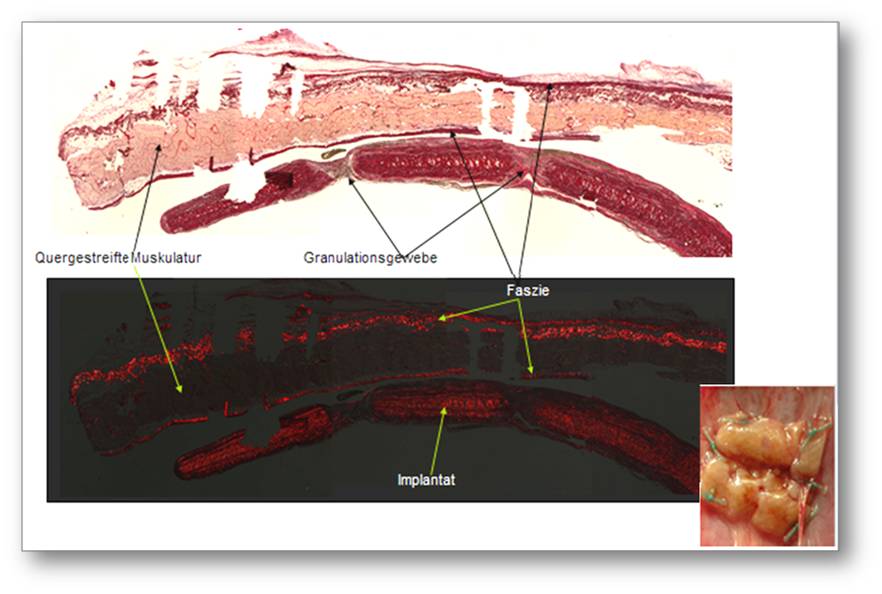 Abbildung 2. Histologische Aufarbeitung eines nach zwei Monaten explantierten, nicht quervernetzten Kollagenimplantates zur Verstärkung einer Bauchwandhernie. Das Implantat imponiert als dunkelrote Struktur unterhalb des hellrot/ rosa erscheinenden geraden Bauchmuskels. Auffällig ist, dass diese beiden Schichten gar nicht verbunden sind, d.h. dass es hier nach längerer Zeit zu keiner, für eine Verstärkung wesentlichen, Einheilung oder einem Einwachsen von Gefäßen gekommen ist. Die langsame Integration und die individuell sehr unterschiedlich ausgeprägte Fremdkörperreaktion ist leider protototypisch für viele Kollagenimplantate in der Hernienchirurgie. Insert rechts unten: dasselbe Implantat am Ort der Verwendung zeigt sich stark geschrumpft und gefältelt.
Abbildung 2. Histologische Aufarbeitung eines nach zwei Monaten explantierten, nicht quervernetzten Kollagenimplantates zur Verstärkung einer Bauchwandhernie. Das Implantat imponiert als dunkelrote Struktur unterhalb des hellrot/ rosa erscheinenden geraden Bauchmuskels. Auffällig ist, dass diese beiden Schichten gar nicht verbunden sind, d.h. dass es hier nach längerer Zeit zu keiner, für eine Verstärkung wesentlichen, Einheilung oder einem Einwachsen von Gefäßen gekommen ist. Die langsame Integration und die individuell sehr unterschiedlich ausgeprägte Fremdkörperreaktion ist leider protototypisch für viele Kollagenimplantate in der Hernienchirurgie. Insert rechts unten: dasselbe Implantat am Ort der Verwendung zeigt sich stark geschrumpft und gefältelt.
Man versuchte dies mit mangelnder Quervernetzung zu erklären, bzw. einer zellschädigenden Wirkung der chemischen Verfahren zur Quervernetzung. Abbildung 3. Die Kontroverse über die beste Art der Quervernetzung und die prinzipielle Notwendigkeit derselben sollte die Phase der aufkommenden Ernüchterung lange kaschieren.
 Abbildung 3. Histologie von einem quervernetzten Kollagenimplantat, ebenfalls aus der Bauchwand. Selbst für einen Laien ist das unruhige Zellbild sofort erkennbar, welches eine massive Fremdkörperreaktion darstellt. Nicht nur ist die Immunabwehr noch zwei Monate nach der OP in vollem Gange, es ist bereits zur Bildung kleinerer Abszesse und der Formation von Granulomen gekommen. Granulome stellen den Versuch des Körpers dar, Fremdmaterialien weitgehend abzukapseln und in letztendlich in einem Sarkophag aus Kalk zu lagern. Alle eigenen Beobachtungen wurden in der Literatur von zahlreichen anderen Gruppen bestätigt.
Abbildung 3. Histologie von einem quervernetzten Kollagenimplantat, ebenfalls aus der Bauchwand. Selbst für einen Laien ist das unruhige Zellbild sofort erkennbar, welches eine massive Fremdkörperreaktion darstellt. Nicht nur ist die Immunabwehr noch zwei Monate nach der OP in vollem Gange, es ist bereits zur Bildung kleinerer Abszesse und der Formation von Granulomen gekommen. Granulome stellen den Versuch des Körpers dar, Fremdmaterialien weitgehend abzukapseln und in letztendlich in einem Sarkophag aus Kalk zu lagern. Alle eigenen Beobachtungen wurden in der Literatur von zahlreichen anderen Gruppen bestätigt.
Immerhin hatte sich die Debatte gerade unter dem Zwang der Tatsache entwickelt, dass zahlreiche klinische Studien wegen inferiorer Ergebnisse oder methodologischer Schwierigkeiten abgebrochen werden mussten: beispielsweise wegen der Schwierigkeit der Stratifizierung (Einteilung der Patienten in risikoangepasste Behandlungsgruppen, Anm. Red.) ausreichend großer und vergleichbarer Gruppen von Patienten, oder auf wegen der zunehmende Ablehnung von Chirurgen Kollagenimplantate überhaupt zu verwenden, Die Dramatik der Situation zeigte sich in der Konklusion einer prospektiven Studie, durchgeführt von einer der renommiertesten Forschungsgruppen der USA (Prof. Dr. Michael Rosen aus Cleveland, OH). Angesichts einer Rezidivrate von mehr als zwei Drittel aller mit einem „Bionetz“ versorgten Patienten mit Bauchwandhernie in einer klinischen Studie postulierte man, dass „Bionetze“ lediglich einen „sehr teuren Bruchsack“ bilden würden. Ende 2015 wurde eine ausgezeichnete Arbeit publiziert, die anhand von aus Patienten wieder explantierten, biologischen Matrices klar postulierte, dass deren Verhalten hinsichtlich Einheilung, Abbau, Verstärkung des Defektes individuell unterschiedlich und vollkómmen unvorhersehbar sei.
Ausblick
Heute gibt es nach wie vor keine zwingenden Indikationen für den Einsatz von biologischen Netzen in der Hernienchirurgie. Übrig bleibt der Auftrag, die Markteinführung neuer Produkte in der Hernienchirurgie mit dem zu Gebote stehenden, wohlwollend-distanzierten und kritischen Blick zu begutachten und mit der skeptischen Erfahrung der oben geschilderten Entwicklung der Kollagenimplantate
[1] Petter-Puchner, H. Redl: Fibrinkleber in der operativen Behandlung von Leistenbrüchen — Fortschritte durch „Forschung made in Austria“ http://www.scienceblog.at/fibrinkleber-leistenbruch#. *Stratifizierung: bereits bei der Planung der klinischen Studie werden Patienten nach definierten, klinisch relevanten Untergruppen randomisiert.
Weiterführende Links
A. Petter-Puchner beschreibt die Technik der Netzfixation mittels Fibrinkleber in Chirurgie, 1 (2014) p. 14: How I do it: Netzfixierungen bei der laparoskopischen Hernienchirurgie. http://trauma.lbg.ac.at/sites/files/trauma/puchner_hernia.pdf
Minimal –invasive Operation eines Leistenbruchs in TAPP Technik (Netzfixierung mit Fibrinkleber), Video: 9:18 min, https://www.youtube.com/watch?v=58FHsHHVL0A
Die folgenden vom Autor genannten, allerdings nicht frei-zugänglichen, Arbeiten zu dem Thema können auf Anfrage zugesandt werden:
- Guillaume O, Teuschl AH, Gruber-Blum S, Fortelny RH, Redl H, Petter-Puchner A. Emerging Trends in Abdominal Wall Reinforcement: Bringing Bio-Functionality to Meshes. Adv. Healthc. Mater. 2015 Aug 26;4(12):1763-89.
- Petter-Puchner AH, Dietz UA. Biological implants in abdominal wall repair. Br. J. Surg. 2013 Jul;100:987-8. doi: 10.1002/bjs.9156. Epub 2013 May 15.
- De Silva GS, Krpata DM, Gao Y, Criss CN, Anderson JM, Soltanian HT, Rosen MJ, Novitsky YW. Lack of identifiable biologic behavior in a series of porcine mesh explants. Surgery. 2014 Jul;156(1):183-9. doi: 10.1016/j.surg.2014.03.011. Epub 2014 Mar 15.
- Harth KC, Krpata DM, Chawla A, Blatnik JA, Halaweish I, Rosen MJ. Biologic mesh use practice patterns in abdominal wall reconstruction: a lack of consensus among surgeons. Hernia. 2013 Feb;17(1):13-20.
- Pérez-Köhler B, Sotomayor S, Rodríguez M, Gegúndez MI, Pascual G, Bellón JM. Bacterial adhesion to biological versus polymer prosthetic materials used in abdominal wall defect repair: do these meshes show any differences in vitro? Hernia. 2015 Dec;19(6):965-73. doi: 10.1007/s10029-015-1378-1. Epub 2015 Apr 11.
- Mulder IM, Deerenberg EB, Bemelman WA, Jeekel J, Lange JF. Infection susceptibility of crosslinked and non-crosslinked biological meshes in an experimental contaminated environment. Am. J. Surg. 2015 Jul;210(1):159-66.