Do, 13.09.2018 - 11:18 — Ricki Lewis

![]() Eine Choreografie von Mutationsereignissen, treibt Krebszellen dazu invasiv zu werden und Metastasen zu bilden Das verändert die Biologie in einer Weise, dass die "abtrünnigen" Zellen nun resistent gegen Behandlungen werden. Während die traditionellen Ansätze von Chemotherapie und Strahlung - "Ausschneiden und Ausbrennen" - Zellen angreifen, die sich schnell teilen, greifen zielgerichtete Behandlungen veränderte Proteine an, die präzise genetische Veränderungen in Tumorzellen widerspiegeln. Es sind dies somatische Mutationen, d.i. Mutationen nur in den betroffenen Zellen, nicht aber ererbte Mutationen, die in allen Zellen eines Patienten vorhanden sind.
Eine Choreografie von Mutationsereignissen, treibt Krebszellen dazu invasiv zu werden und Metastasen zu bilden Das verändert die Biologie in einer Weise, dass die "abtrünnigen" Zellen nun resistent gegen Behandlungen werden. Während die traditionellen Ansätze von Chemotherapie und Strahlung - "Ausschneiden und Ausbrennen" - Zellen angreifen, die sich schnell teilen, greifen zielgerichtete Behandlungen veränderte Proteine an, die präzise genetische Veränderungen in Tumorzellen widerspiegeln. Es sind dies somatische Mutationen, d.i. Mutationen nur in den betroffenen Zellen, nicht aber ererbte Mutationen, die in allen Zellen eines Patienten vorhanden sind.
Zwei neue Veröffentlichungen stellen nun Tools vor, mit denen man Patienten besser an zielgerichtete Behandlungen oder Immuntherapien anpassen kann und diese basieren auf der Interpretation von Mutationen, die der Initiierung und Ausbreitung eines Tumors zugrunde liegen. Bei einem der Tools - Cerebro genannt -geht es um maschinelles Lernen, beim anderen Tool gibt es eine Skala auf der Ärzte die Evidenz, dass eine bestimmte zielgerichtete Behandlung gegen einen Tumor mit spezifischen Mutationen wirkt, ranken. Die Genetikerin Ricki Lewis berichtet darüber.*
Eine kurze Geschichte der zielgerichteten Krebsmedikamente...
Als meine Mutter vor 30 Jahren an Brustkrebs erkrankte, erhielt sie eine brutale und sinnlose Tortur. Entsprechend einem Vorgehen "one size fits all - eine Größe passt für alle" und "töte alle teilungsfähigen Zellen" litt sie unter einer Therapie mit Standard-Chemotherapeutika, gefolgt von fünf Jahre langer Einnahme von Tamoxifen. Abbildung 1 zeigt eine Brustkrebszelle.
 Abbildung 1. Fast ein Gemälde - eine Brustkrebszelle (NHGRI)
Abbildung 1. Fast ein Gemälde - eine Brustkrebszelle (NHGRI)
Tamoxifen
war damals bereits so etwas wie ein Präzisionsansatz: es blockierte die im Übermaß auf ihren Krebszellen vorhandenen Östrogenrezeptoren, welche das Hormon ansonsten befähigten, den Zellzyklus zu starten. Der Nachweis zusätzlicher Östrogen- und Progesteronrezeptoren, die bei allen Brusttumoren durchgeführt werden, verwendet allerdings Immunhistochemie, nicht Gentests. Meine Mutter tat, was ihre Ärzte diktierten. Die Fernsehwerbung bombardierte damals Krebspatienten nicht mit den Details zu Taxol, Cisplatin oder Adriamycin.
Herceptin
In den 1990er Jahren kam dann Herceptin auf. Dies ist ein Antikörper gegen einen anderen Rezeptor - HER2 -, der auf den Zellen von 25 bis 30 Prozent der Brusttumoren besonders häufig vorkommt. Herceptin verhindert die Bindung von Molekülen an den Rezeptor für den humanen epidermalen Wachstumsfaktor ("HER"), welche das Signal für die Zellteilung auslösen. Auch normale Zellen besitzen bis zu 100 000 solcher Rezeptoren, Krebszellen dagegen 1 bis 2 Millionen.
Gleevec
Mit Gleevec, das auch ein Signal zur Zellteilung blockiert, trat erstmals ein erstaunlich zielgerichtetes Krebsmedikament auf den Plan. Das New England Journal of Medicine vom 5. April 2001 berichtete, dass 53 von 54 Patienten mit chronischer myeloischer Leukämie darauf ansprachen. Heute wird Gleevec auch zur Behandlung verschiedener anderer Krebsarten eingesetzt, ein früher Hinweis für den Paradigmenwechsel Krebs auf Basis der Mutation und nicht der Lokalisierung zu bekämpfen.
Heute testen Tumortyp-unabhängige Untersuchungen ("Basket Studies") neue Medikamente gegen Krebsarten, die verschiedene Körperteile betreffen, aber die gleichen Mutationen aufweisen. Die Liste der gezielten Therapien wächst. Abbildung 2.
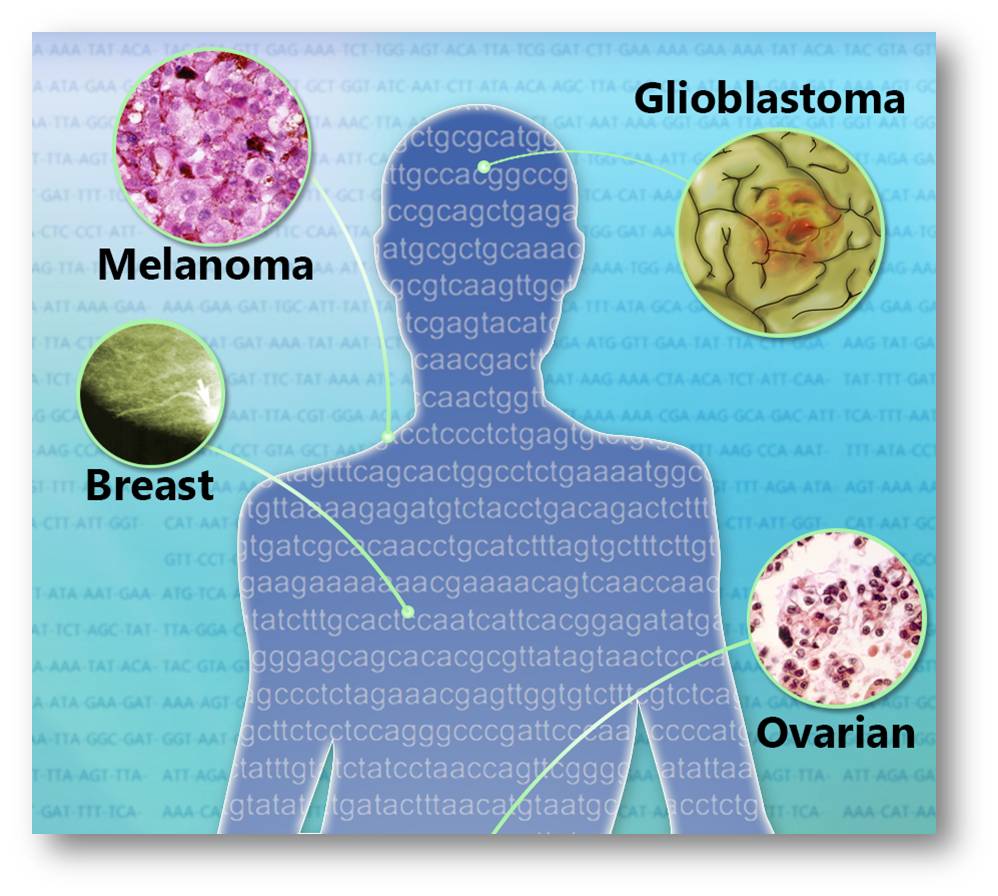 Abbildung 2. Tumoren in verschiedenen Organen können dieselben Mutationen aufweisen. (Jonathan Bailey, NHGRI)
Abbildung 2. Tumoren in verschiedenen Organen können dieselben Mutationen aufweisen. (Jonathan Bailey, NHGRI)
Im Jahr 2017 kam die FDA-Zulassung für Zelboraf und Tafinlar. Es sind Medikamente gegen metastasierendes Melanom, die auf eine Mutation (V600E) im B-RAF-Gen abzielen, dessen Proteinprodukt wiederum Teil eines Signalwegs ist, der die Zellteilung beschleunigt.
Keytruda und Opdivo, ebenfalls vor kurzem zugelassen, arbeiten auf andere Weise. Es sind Antikörper, die über eine "Immun Checkpoint Blockade" Moleküle hemmen, welche bei manchen Krebsarten die Immunantwort ausschalten. Die Zielstruktur von Keytruda und Opdivo ist ein Protein - PD-L1 -, das normalerweise T-Zellen abschaltet, die eine Immunantwort auslösen. Opdivo behandelt 12 Krebsarten in Kombination mit anderen Behandlungen oder als letztes Mittel; Keytruda ist derzeit nur für nicht-kleinzelligen Lungenkrebs zugelassen.
...und ärgerliche Verbraucherwerbung
Keytruda und Opdivo sind in den US durch ihre ärgerliche TV-Werbung bekannt. So zeigt ein älterer Herr mit einer schönen Frau an seiner Seite auf einen Wolkenkratzer. Opdivo gab ihm "eine Chance, länger zu leben!" Dass "länger leben" rund 3 Monate bedeutete, hatte der Hersteller Bristol-Myers Squibb zunächst weggelassen und erntete dafür heftige Kritik ; jetzt steht die Information im Kleingedruckten. Keytruda erging es besser als Opdivo: man hatte die klinische Studie auf Patienten beschränkt, bei denen mehr als 50% ihrer Krebszellen übermäßig hohes PD-L1 aufwiesen. Das ist ein sehr wichtiger Punkt: Werden für klinische Studien die passenden Patienten ausgewählt, so beeinflusst dies die beobachtete Wirksamkeit.
In jüngerer Zeit wendet sich die Verbraucherwerbung mit ihrer "strahlenden-, glücklichen-Menschen-Taktik" an die Behandlung von metastasierendem Brustkrebs - konkret mit Verzenio von Eli Lilly, das 2017 von der FDA zugelassen wurde: Eine Mutter sieht ihrer jungen Tochter beim Tanzen zu, zwei Freunde backen Kuchen, eine Familie bläst Seifenblasen in der Nähe des Gartens - weit und breit sind aber weder ein Strahlungsmarker noch ein Chemo-Port zu sehen. Das Kleingedruckte gibt an, dass mit Verzenio die Progression verzögert ist, aber noch kein Überlebensvorteil nachgewiesen wurde. Mit ähnlich reizvollen Szenarien wird auch für Pfizers Ibrance (gegen fortgeschrittenen Brustkrebs) geworben. Nur bei Kisqali von Novartis werden tatsächlich echte Patientinnen gefragt, wie sie sich fühlen. "Ich habe Angst", sagt eine Frau, während eine andere traurig ist. "Wenn Sie herausfinden, dass Sie an metastasierendem Brustkrebs leiden, ist dies eine Qual." Die drei Brustkrebs-Medikamente sind sogenannte CDK-Hemmer, die einen Teil des Zellteilungszyklus blockieren.
Über ein einzelnen Krebsgens hinaus
Opdivo hat eine Ansprechrate von 30%. Das ist für ein Krebsmedikament akzeptabel. Bedenkt man, dass Opdivo ein defininiertes Zielmolekül angreift, jedoch mehrere genetische Wege den Krebs treiben, so ist es besser biologische Übergänge ins Auge zu fassen, die zur Behandlungsresistenz führen. Und eine umfassendere genetische Analyse ist jetzt machbar - die Kosten für Multi-Gen-Tests und Exom- und Genomsequenzierung sind ja stark zurückgegangen.
"Hunderte Laboratorien in den Vereinigten Staaten bieten NGS- (Next Generation Sequencing) Krebs-Profiling an, geben jährlich Zehntausende von Berichten heraus", schreiben Derrick Wood (Johns Hopkins University School of Medicine) und Kollegen in einem neuen Artikel im Journal Science Translational Medicine. Sie weisen darauf hin, dass diese Analysen zwar den "CLIA" -Regeln (Clinical Laboratory Improvement Amendments) entsprechen, das heißt, sie erkennen, worauf sie testen, aber sie sind noch nicht von der FDA als diagnostische Tests für die Zuordnung von Krebsmutationsprofilen zu bestimmten Medikamenten zugelassen.
Dennoch werden die Daten aus all diesen Tests letztlich zu einem wesentlich zielgerichteteren Ansatz in der Krebstherapie führen. Ein Großteil der Daten wird von der American Association for Cancer Research und vom Cancer Genome Atlas zusammen getragen.
Eine Herausforderung für die Bioinformatik
"Bei Krebs wurde das Genom in die Hölle geschossen", sagte mir einst ein prominenter Forscher. Mit Hunderten von Onkogenen und Tumorsuppressor-Genen, von denen jedes auf unzählige Arten mutieren kann, mit Stücken von Chromosomen, die abgetrennt werden, während andere sich wiederholen, wiederholen, wiederholen... So wird ein Anpassen des "genomischen Profils" einer vorherrschenden Krebszelle - ein Tumor kann aus genetisch unterschiedlichen Zellen bestehen - an ein spezifisch zielgerichtetes Medikament zu einem Problem der Bioinformatik.
Genug Daten analysieren, um den Mutations-Weizen von der Spreu genau zu trennen - um dies zu erreichen, wandte sich das Team von der John Hopkins Universität dem maschinellen Lernen zu und erfand Cerebro.
Besser als ein Gehirn
Beim maschinellen Lernen werden Rechner auf Basis realer Daten trainiert, um Muster in Datensätzen zu identifizieren, die für ein menschliches Gehirn zu komplex oder zu subtil sind.
Cerebro wendet den Random-Forest-Algorithmus an, der zunächst viele Zufalls-Entscheidungsbäume generiert, basierend auf dem, was bereits vorhanden ist (echte Daten zu Mutationen und zu klinischem Ansprechen), sowie "in silico" -Mutationen, die - basierend auf der DNA-Sequenz eines Gens - theoretisch möglich sind. Vorbereitet durch den Trainingsdatensatz leitet Cerebro dann ab, welche Mutationen in neuen Datensätzen durch bestimmte Medikamente verwundbar sein werden.
Je mehr Daten für das Training verwendet werden, desto größer wird die Vorhersagekraft. Angesichts der riesigen Datensätze von all den Menschen, deren Krebsgenome untersucht wurden, ist die Zeitnun reif für diesen Ansatz.
Cerebro hat an 30.000 Mutationen und 2 Millionen fehlerhaften Genvarianten trainiert, welche das medikamentöse Ansprechen tatsächlich nicht vorhersagten. Es kam heraus, dass Zellen eines einzelnen Tumors im Durchschnitt 267 somatische Mutationen und Veränderungen auf Chromosomenebene aufweisen (Range 1 - 5.871). Krebs ist ein Wechselbalg, die Zellen unterscheiden sich genetisch auch innerhalb desselben Tumors.
Nach der Validierung an großen Datensätzen, wie solchen aus dem Cancer Genome Atlas, übertraf Cerebro menschliche Gehirne im Anpassen neuer Patienten an zielgerichtete Medikamente. Cerebro berücksichtigte nicht nur das, was bekannterweise existiert, sondern auch das, was möglich wird: so folgert Cerebro, wie eine Mutation die Konformation eines Proteins verändert und wie sich diese Veränderung auf den damit verbundenen biochemischen Weg von Karzinogenese, Invasion oder Metastasierung auswirkt. Cerebro war in beiden Aspekten genauer. Zum Beispiel identifizierte das Tool bei einer Gruppe von Patienten mit nicht-kleinzelligem Lungenkrebs eine geringere Zahl an relevanten Mutationen als die Standardtechniken, fand jedoch mehr relevante Mutationen bei Patienten mit metastasiertem Melanom.
In der Zwischenzeit…
Bis maschinelles Lernen soweit ausgereift ist, dass Krebspatienten schnell an eine optimale zielgerichtete Behandlung angepasst werden können, führt ein weiterer neuer Artikel, der in Annals of Oncology veröffentlicht wurde, ein anderes Tool ein. Es ist eine Skala, welche die zielgerichteten Medikamente rankt und abgekürzt mit ESCAT bezeichnet wird (ESMO (European Society for Medical Oncology) Scale for Clinical Actionability of Molecular Targets).
Fabrice André, der die Skala entwarf und Onkologe (am Gustave Roussy-Krebs-Center in Villejuif, Frankreich) ist, erklärt: "Ärzte erhalten zunehmende Mengen an Information über die genetische Zusammensetzung des Tumors jedes Patienten, es kann aber schwierig sein dies zu interpretieren, um optimale Behandlungsmöglichkeiten auszuwählen. Die neue Skala wird uns dabei helfen, zwischen Veränderungen in der Tumor-DNA zu unterscheiden, die für Entscheidungen über gezielte Medikamente oder den Zugang zu klinischen Studien relevant sind, und solche, die es nicht sind."
Basierend auf den Mutationen des Tumors (Abbildung 3) sieht ESCAT sechs Stufen klinischer Evidenz vor, um eine Auswahl von Medikamenten zu treffen:
- >Stufe 1 = "Bereit für den Einsatz bei routinemäßigen klinischen Entscheidungen" basierend auf einem klaren Überlebensvorteil, wie bei Herceptin und Keytruda.
- Stufe II = "Zu prüfende Ziele - definieren wahrscheinlich eine Patientenpopulation, die von einem zielgerichteten Medikament profitiert, zusätzliche Daten werden aber noch benötigt." (Klinische Verbesserung, aber noch keine Überlebensdaten vorhanden.)
- Stufe III = "Klinischer Nutzen, der zuvor bei anderen Tumorarten oder ähnlichen molekularen Zielen nachgewiesen wurde".
- Stufe IV = "präklinischer Nachweis der Wirksamkeit " (in menschlichen Zellen oder Tiermodellen)
- Stufe V = "Evidenz, die ein Co-Targeting unterstützt" (ein zusätzliches Zielmolekül wird benötigt)
- Stufe X = "Fehlende Evidenz der Wirkung"
Stufe-I-Mutationen bestimmen die Auswahl der Medikamente.
Die Skala wird es Onkologen auch ermöglichen, sinnvolle Gespräche mit Patienten zu führen, die verzweifelt alles versuchen wollen. "ESCAT wird Ordnung in den aktuellen Mutationsanalyse-Dschungel bringen, damit wir alle die gleiche Sprache sprechen, um Mutationen zu klassifizieren und Prioritäten zu setzen, wie wir sie zur Verbesserung der Patientenversorgung einsetzen", schließt André.
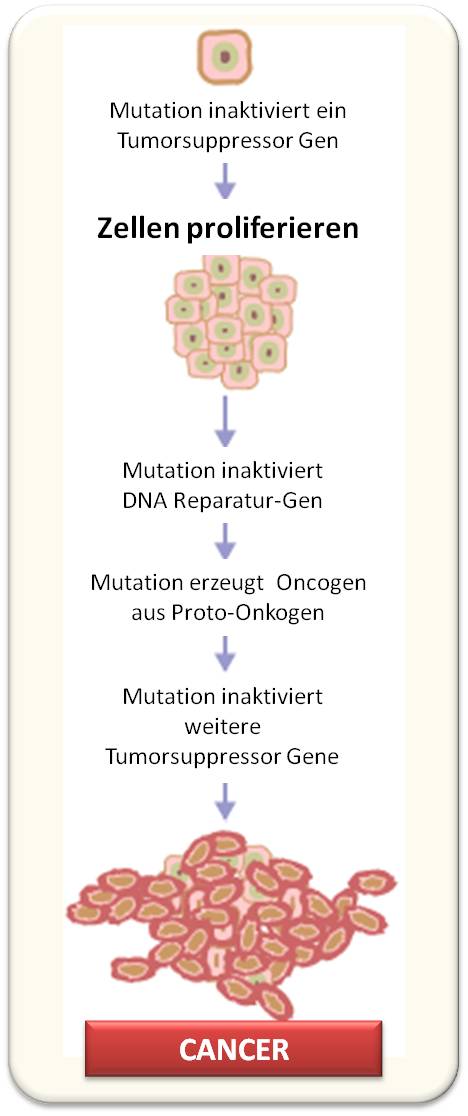 Abbildung 3. Mutationen, die zur Tumorbildung führen
Abbildung 3. Mutationen, die zur Tumorbildung führen
Zusatz
In Zusammenhang mit Krebs verwende ich nie das Wort "Heilung", allerdings "kein Hinweis auf eine Krankheit" scheint zu vorsichtig. Ich hoffe, dass Patienten, die heute zielgerichtete Medikamente nehmen, zusammen mit häufigen Tests zur Identifizierung neuer Mutationen in ihren Krebszellen, eine zukünftige Enzyklopädie des Wissens zur Verfügung stellen, welche die Auswahl von Medikamenten erleichtert, um eine Progression zu verhindern, das Überleben zu verlängern oder sogar einen normalen Zellzyklus wiederherzustellen.
*Der Artikel ist erstmals am 6. September 2018 in PLOS Blogs - DNA Science Blog unter dem Titel " Matching Cancer Patients to Targeted Drugs: Two New Tools " erschienen (https://blogs.plos.org/dnascience/2018/09/06/matching-cancer-patients-to-targeted-drugs-two-new-tools/ und steht unter einer cc-by Lizenz. Die Autorin hat sich freundlicherweise mit der Übersetzung ihrer Artikel durch ScienceBlog.at einverstanden erklärt, welche so genau wie möglich den englischen Fassungen folgen.
Weiterführende Links
Zu maschinellem Lernen
Bessere Medizin dank Machine Learning und künstlicher Intelligenz (KI). Dr. Marco Schmidt (2018) Video 14:01 min. https://www.youtube.com/watch?v=ufCP7dnBrWs
Künstliche Intelligenz und maschinelles Lernen: Eine Prognose(2018). Video 9:14 min. Prof. Peter Buxmann (TU Darmstadt) .hr info. https://www.youtube.com/watch?v=LWcMEDjM-6A
Zu ESCAT
Mateo et al., (21.8.2018): A framework to rank genomic alterations as targets for cancer precision medicine: the ESMO Scale for Clinical Actionability of molecular Targets (ESCAT). open access. https://academic.oup.com/annonc/advance-article/doi/10.1093/annonc/mdy263/5076792
Zu Herceptin Einen ausführlichen Artikel über Herceptin gibt es von Ricky Lewis im Scientist (April 2001): Herceptin Earns Recognition in Breast Cancer Arsenal. https://www.the-scientist.com/news/herceptin-earns-recognition-in-breast-cancer-arsenal-54751
Artikel zu ähnlichen Themen im ScienceBlog
- Norbert Bischofberger, 16.08.2018: Mit Künstlicher Intelligenz zu einer proaktiven Medizin
- Norbert Bischofberger,24.05.2018: Auf dem Weg zu einer Medizin der Zukunft
- Ricki Lewis, 02.11.2017: Ein modifiziertes Poliovirus im Kampf gegen bösartige Hirntumoren
- Francis. S.Collins, 06.04.2017: Pech gehabt - zufällige Mutationen spielen eine Hauptrolle in der Tumorentstehung
Im Jahr 2017 kam die FDA-Zulassung für Zelboraf und Tafinlar. Es sind Medikamente gegen metastasierendes Melanom, die auf eine Mutation (V600E) im B-RAF-Gen abzielen, dessen Proteinprodukt wiederum Teil eines Signalwegs ist, der die Zellteilung beschleunigt.
Keytruda und Opdivo, ebenfalls vor kurzem zugelassen, arbeiten auf andere Weise. Es sind Antikörper, die über eine "Immun Checkpoint Blockade" Moleküle hemmen, welche bei manchen Krebsarten die Immunantwort ausschalten. Die Zielstruktur von Keytruda und Opdivo ist ein Protein - PD-L1 -, das normalerweise T-Zellen abschaltet, die eine Immunantwort auslösen. Opdivo behandelt 12 Krebsarten in Kombination mit anderen Behandlungen oder als letztes Mittel; Keytruda ist derzeit nur für nicht-kleinzelligen Lungenkrebs zugelassen.
...und ärgerliche Verbraucherwerbung
Keytruda und Opdivo sind in den US durch ihre ärgerliche TV-Werbung bekannt. So zeigt ein älterer Herr mit einer schönen Frau an seiner Seite auf einen Wolkenkratzer. Opdivo gab ihm "eine Chance, länger zu leben!" Dass "länger leben" rund 3 Monate bedeutete, hatte der Hersteller Bristol-Myers Squibb zunächst weggelassen und erntete dafür heftige Kritik ; jetzt steht die Information im Kleingedruckten. Keytruda erging es besser als Opdivo: man hatte die klinische Studie auf Patienten beschränkt, bei denen mehr als 50% ihrer Krebszellen übermäßig hohes PD-L1 aufwiesen. Das ist ein sehr wichtiger Punkt: Werden für klinische Studien die passenden Patienten ausgewählt, so beeinflusst dies die beobachtete Wirksamkeit.
In jüngerer Zeit wendet sich die Verbraucherwerbung mit ihrer "strahlenden-, glücklichen-Menschen-Taktik" an die Behandlung von metastasierendem Brustkrebs - konkret mit Verzenio von Eli Lilly, das 2017 von der FDA zugelassen wurde: Eine Mutter sieht ihrer jungen Tochter beim Tanzen zu, zwei Freunde backen Kuchen, eine Familie bläst Seifenblasen in der Nähe des Gartens - weit und breit sind aber weder ein Strahlungsmarker noch ein Chemo-Port zu sehen. Das Kleingedruckte gibt an, dass mit Verzenio die Progression verzögert ist, aber noch kein Überlebensvorteil nachgewiesen wurde. Mit ähnlich reizvollen Szenarien wird auch für Pfizers Ibrance (gegen fortgeschrittenen Brustkrebs) geworben. Nur bei Kisqali von Novartis werden tatsächlich echte Patientinnen gefragt, wie sie sich fühlen. "Ich habe Angst", sagt eine Frau, während eine andere traurig ist. "Wenn Sie herausfinden, dass Sie an metastasierendem Brustkrebs leiden, ist dies eine Qual." Die drei Brustkrebs-Medikamente sind sogenannte CDK-Hemmer, die einen Teil des Zellteilungszyklus blockieren.
Über ein einzelnen Krebsgens hinaus
Opdivo hat eine Ansprechrate von 30%. Das ist für ein Krebsmedikament akzeptabel. Bedenkt man, dass Opdivo ein defininiertes Zielmolekül angreift, jedoch mehrere genetische Wege den Krebs treiben, so ist es besser biologische Übergänge ins Auge zu fassen, die zur Behandlungsresistenz führen. Und eine umfassendere genetische Analyse ist jetzt machbar - die Kosten für Multi-Gen-Tests und Exom- und Genomsequenzierung sind ja stark zurückgegangen.
"Hunderte Laboratorien in den Vereinigten Staaten bieten NGS- (Next Generation Sequencing) Krebs-Profiling an, geben jährlich Zehntausende von Berichten heraus", schreiben Derrick Wood (Johns Hopkins University School of Medicine) und Kollegen in einem neuen Artikel im Journal Science Translational Medicine. Sie weisen darauf hin, dass diese Analysen zwar den "CLIA" -Regeln (Clinical Laboratory Improvement Amendments) entsprechen, das heißt, sie erkennen, worauf sie testen, aber sie sind noch nicht von der FDA als diagnostische Tests für die Zuordnung von Krebsmutationsprofilen zu bestimmten Medikamenten zugelassen.
Dennoch werden die Daten aus all diesen Tests letztlich zu einem wesentlich zielgerichteteren Ansatz in der Krebstherapie führen. Ein Großteil der Daten wird von der American Association for Cancer Research und vom Cancer Genome Atlas zusammen getragen.
Eine Herausforderung für die Bioinformatik
"Bei Krebs wurde das Genom in die Hölle geschossen", sagte mir einst ein prominenter Forscher. Mit Hunderten von Onkogenen und Tumorsuppressor-Genen, von denen jedes auf unzählige Arten mutieren kann, mit Stücken von Chromosomen, die abgetrennt werden, während andere sich wiederholen, wiederholen, wiederholen... So wird ein Anpassen des "genomischen Profils" einer vorherrschenden Krebszelle - ein Tumor kann aus genetisch unterschiedlichen Zellen bestehen - an ein spezifisch zielgerichtetes Medikament zu einem Problem der Bioinformatik.
Genug Daten analysieren, um den Mutations-Weizen von der Spreu genau zu trennen - um dies zu erreichen, wandte sich das Team von der John Hopkins Universität dem maschinellen Lernen zu und erfand Cerebro.
Besser als ein Gehirn
In der Zwischenzeit…
Bis maschinelles Lernen soweit ausgereift ist, dass Krebspatienten schnell an eine optimale zielgerichtete Behandlung angepasst werden können, führt ein weiterer neuer Artikel, der in Annals of Oncology veröffentlicht wurde, ein anderes Tool ein. Es ist eine Skala, welche die zielgerichteten Medikamente rankt und abgekürzt mit ESCAT bezeichnet wird (ESMO (European Society for Medical Oncology) Scale for Clinical Actionability of Molecular Targets).
Fabrice André, der die Skala entwarf und Onkologe (am Gustave Roussy-Krebs-Center in Villejuif, Frankreich) ist, erklärt: "Ärzte erhalten zunehmende Mengen an Information über die genetische Zusammensetzung des Tumors jedes Patienten, es kann aber schwierig sein dies zu interpretieren, um optimale Behandlungsmöglichkeiten auszuwählen. Die neue Skala wird uns dabei helfen, zwischen Veränderungen in der Tumor-DNA zu unterscheiden, die für Entscheidungen über gezielte Medikamente oder den Zugang zu klinischen Studien relevant sind, und solche, die es nicht sind."
Basierend auf den Mutationen des Tumors (Abbildung 3) sieht ESCAT sechs Stufen klinischer Evidenz vor, um eine Auswahl von Medikamenten zu treffen:
- >Stufe 1 = "Bereit für den Einsatz bei routinemäßigen klinischen Entscheidungen" basierend auf einem klaren Überlebensvorteil, wie bei Herceptin und Keytruda.
- Stufe II = "Zu prüfende Ziele - definieren wahrscheinlich eine Patientenpopulation, die von einem zielgerichteten Medikament profitiert, zusätzliche Daten werden aber noch benötigt." (Klinische Verbesserung, aber noch keine Überlebensdaten vorhanden.)
- Stufe III = "Klinischer Nutzen, der zuvor bei anderen Tumorarten oder ähnlichen molekularen Zielen nachgewiesen wurde".
- Stufe IV = "präklinischer Nachweis der Wirksamkeit " (in menschlichen Zellen oder Tiermodellen)
- Stufe V = "Evidenz, die ein Co-Targeting unterstützt" (ein zusätzliches Zielmolekül wird benötigt)
- Stufe X = "Fehlende Evidenz der Wirkung"
Stufe-I-Mutationen bestimmen die Auswahl der Medikamente.
Die Skala wird es Onkologen auch ermöglichen, sinnvolle Gespräche mit Patienten zu führen, die verzweifelt alles versuchen wollen. "ESCAT wird Ordnung in den aktuellen Mutationsanalyse-Dschungel bringen, damit wir alle die gleiche Sprache sprechen, um Mutationen zu klassifizieren und Prioritäten zu setzen, wie wir sie zur Verbesserung der Patientenversorgung einsetzen", schließt André.
 Abbildung 3. Mutationen, die zur Tumorbildung führen
Abbildung 3. Mutationen, die zur Tumorbildung führen
Zusatz
In Zusammenhang mit Krebs verwende ich nie das Wort "Heilung", allerdings "kein Hinweis auf eine Krankheit" scheint zu vorsichtig. Ich hoffe, dass Patienten, die heute zielgerichtete Medikamente nehmen, zusammen mit häufigen Tests zur Identifizierung neuer Mutationen in ihren Krebszellen, eine zukünftige Enzyklopädie des Wissens zur Verfügung stellen, welche die Auswahl von Medikamenten erleichtert, um eine Progression zu verhindern, das Überleben zu verlängern oder sogar einen normalen Zellzyklus wiederherzustellen.
*Der Artikel ist erstmals am 6. September 2018 in PLOS Blogs - DNA Science Blog unter dem Titel " Matching Cancer Patients to Targeted Drugs: Two New Tools " erschienen (https://blogs.plos.org/dnascience/2018/09/06/matching-cancer-patients-to-targeted-drugs-two-new-tools/ und steht unter einer cc-by Lizenz. Die Autorin hat sich freundlicherweise mit der Übersetzung ihrer Artikel durch ScienceBlog.at einverstanden erklärt, welche so genau wie möglich den englischen Fassungen folgen.
Weiterführende Links
Zu maschinellem Lernen
Bessere Medizin dank Machine Learning und künstlicher Intelligenz (KI). Dr. Marco Schmidt (2018) Video 14:01 min. https://www.youtube.com/watch?v=ufCP7dnBrWs
Künstliche Intelligenz und maschinelles Lernen: Eine Prognose(2018). Video 9:14 min. Prof. Peter Buxmann (TU Darmstadt) .hr info. https://www.youtube.com/watch?v=LWcMEDjM-6A
Zu ESCAT
Mateo et al., (21.8.2018): A framework to rank genomic alterations as targets for cancer precision medicine: the ESMO Scale for Clinical Actionability of molecular Targets (ESCAT). open access. https://academic.oup.com/annonc/advance-article/doi/10.1093/annonc/mdy263/5076792
Zu Herceptin Einen ausführlichen Artikel über Herceptin gibt es von Ricky Lewis im Scientist (April 2001): Herceptin Earns Recognition in Breast Cancer Arsenal. https://www.the-scientist.com/news/herceptin-earns-recognition-in-breast-cancer-arsenal-54751
Artikel zu ähnlichen Themen im ScienceBlog
- Norbert Bischofberger, 16.08.2018: Mit Künstlicher Intelligenz zu einer proaktiven Medizin
- Norbert Bischofberger,24.05.2018: Auf dem Weg zu einer Medizin der Zukunft
- Ricki Lewis, 02.11.2017: Ein modifiziertes Poliovirus im Kampf gegen bösartige Hirntumoren
- Francis. S.Collins, 06.04.2017: Pech gehabt - zufällige Mutationen spielen eine Hauptrolle in der Tumorentstehung
- Printer-friendly version
- Log in to post comments
