Do, 25.01.2018 - 07:13 — Francis S. Collins 
![]()
Die meisten Säugetierzellen besitzen sogenannte primäre Zilien, antennenartige Ausstülpungen der Zellmembran, die als Sensoren der Umgebung dienen. Eine neue Untersuchung [1] zeigt, dass derartige subzelluläre Strukturen auf bestimmten Nervenzellen eine Schlüsselrolle in der Regulierung des Essverhaltens und damit der Entstehung der Adipositas spielen. Francis Collins, NIH-Direktor und ehem. Leiter des "Human Genome Project", fasst die faszinierenden Befunde zusammen.*
Der Adipositas (Fettleibigkeit) liegt ein komplexes Zusammenspiel von Ernährung, Lebensweise und Genetik zugrunde und sogar die im Verdauungstrakt angesiedelten Bakterien tragen dazu bei. Es gibt aber auch andere, eher unterschätzte Faktoren, die offensichtlich eine Rolle spielen. Eine neue NIH-geförderte Untersuchung lässt auf Faktoren schließen, an die man nicht einmal im Traum gedacht hätte: es sind dies Antennen-artige sensorische Fortsätze (Ausstülpungen der Zellmembran) auf Nervenzellen, sogenannte primäre Zilien. Abbildung 1.
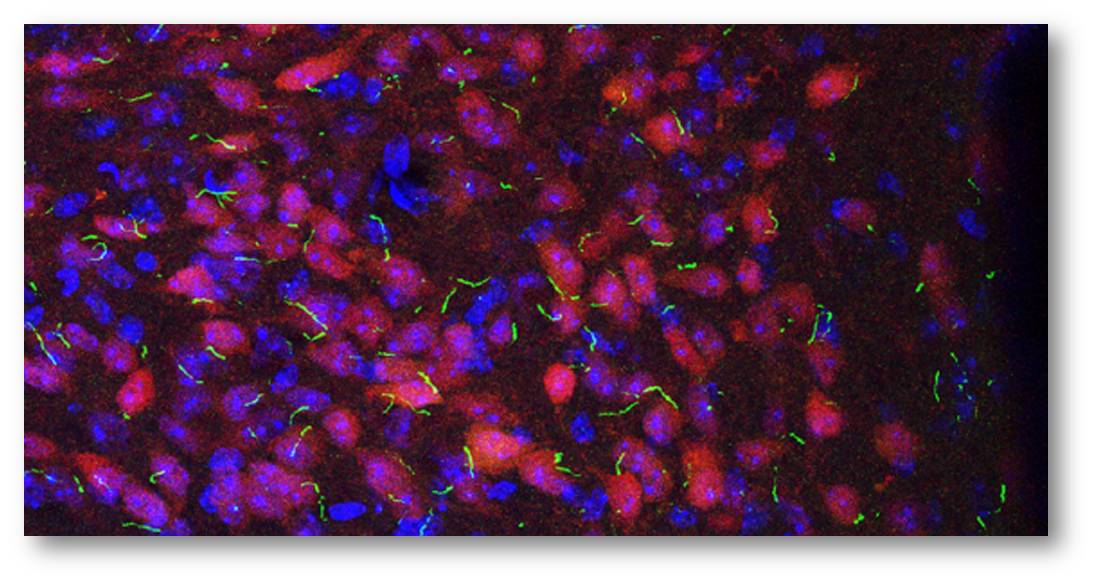 Abbildung 1. Primäre Zilien (grün) auf den Nervenzellen (rot-violett) einer Maus. Die Zellkerne sind blau gefärbt. (Credit: Yi Wang, Vaisse Lab, UCSF)
Abbildung 1. Primäre Zilien (grün) auf den Nervenzellen (rot-violett) einer Maus. Die Zellkerne sind blau gefärbt. (Credit: Yi Wang, Vaisse Lab, UCSF)
Die genannte Studie erfolgte an Mäusen und wurde vor wenigen Tagen im Journal Nature Genetics veröffentlicht [1]. Die Schlußfolgerung daraus: primäre Zilien haben eine Schlüsselrolle in dem bereits bekannten "Hunger-Schaltkreis" inne. Dieser Schaltkreis kontrolliert den Appetit auf Basis von Signalen, die er aus anderen Körperregionen empfängt. Im Mausmodell zeigen die Forscher, dass Änderungen an den Zilien einen "Kurzschluss" erzeugen können; in Folge ist die Fähigkeit des Gehirns den Appetit zu kontrollieren gestört und es kommt zu Überernährung und Fettsucht der Tiere.
Wesentliche Proteine im "Hunger-Schaltkreis"
Die neuen Befunde stammen aus der Zusammenarbeit zweier NIH-unterstützter Teams an der Universität von San Francisco, Californien (UCSF). Das eine, von Christian Vaisse geleitete Team suchte möglichst viele genetische Faktoren zu identifizieren, die zur Adipositas beitragen können . Dies hat die Forscher zu einem wesentlichen Abschnitt des "Hunger-Schaltkreises" geführt, der im Hypothalamus des Gehirns verdrahtet vorliegt. Spezifische Neuronen detektieren hier permanent die Konzentration von Leptin, einem Hormon, das von Fettzellen produziert wird und ein Maß für die Menge des im Organismus gespeicherten Fettes darstellt.
Die Leptin-sensitiven Neuronen geben ihre Informationen dann an einen anderen Abschnitt des Schaltkreises weiter, wo eine zweite Gruppe von Nervenzellen das übrige Gehirn informiert ob der Appetit nun gesteigert oder gedrosselt werden soll. Erst kürzlich hat das Team um Vaisse festgestellt, dass an der Oberfläche dieser zweiten Gruppe von Neuronen ein Rezeptor - der Melanocortin-4-Rezeptor (MC4R) - eine ganz wesentliche Funktion in der Weiterleitung des Signals zur Appetit -Regulierung hat. Abbildung 2. Ist der Rezeptor defekt, so kann das übermittelte Signal nicht korrekt weitergegeben werden - der Appetit verbleibt "eingeschaltet" in der on-Position. Tatsächlich sind Mutationen im MC4R-Gen die häufigsten genetischen Ursachen für extreme Fettsucht im kindlichen Alter.
 Abbildung 2.Das Herz des Hungers. Eine stilisierte Darstellung der Neuronen (rot), die den Melanocortin-4 Rezeptor (MC4R) exprimieren. Es ist dies eine Untergruppe der Neuronen im sogenannten Paraventriculären Nukleus des Hypothalamus, einer Gehirnregion, die für ihre regulierende Rolle im Energie-Gleichwicht und im Hunger bekannt ist. (Quelle: https://directorsblog.nih.gov/2015/05/05/tracing-the-neural-circuitry-of... Credit: Michael Krashes, NIDDK, NIH)
Abbildung 2.Das Herz des Hungers. Eine stilisierte Darstellung der Neuronen (rot), die den Melanocortin-4 Rezeptor (MC4R) exprimieren. Es ist dies eine Untergruppe der Neuronen im sogenannten Paraventriculären Nukleus des Hypothalamus, einer Gehirnregion, die für ihre regulierende Rolle im Energie-Gleichwicht und im Hunger bekannt ist. (Quelle: https://directorsblog.nih.gov/2015/05/05/tracing-the-neural-circuitry-of... Credit: Michael Krashes, NIDDK, NIH)
Die Rolle der primären Zilien
Das andere Team am UCSF, unter der Leitung von Jeremy Reiter, hat sich der Untersuchung der primären Zilien gewidmet. Interessanterweise wurden diese unbeweglichen "Antennen" im Gehirn ursprünglich als unnötige Zellorganellen angesehen, als reine biologische Relikte, die keinerlei Zweck erfüllten. Dass dies falsch ist, hat sich inzwischen herausgestellt. Schäden an primären Zilien tragen zu einem weiten Spektrum genetischer Syndrome bei, die kollektiv als Ziliopathien bezeichnet werden. Ziliopathien weisen dabei häufig eine Vielfalt von Merkmalen auf, beispielweise Polydaktylie - d.i. das Vorhandensein von zusätzlichen Fingern und Zehen -, Schädigungen der Retina, Lungenerkrankungen und Nierendefekte. Hier gab es allerdings ein Faktum, das erst jetzt verstanden wird, nämlich warum Menschen mit bestimmten Ziliopathien praktisch immer extrem adipös sind (das Bardet-Biedl Syndrom mit Polydaktylie und Nierendysplasie und das Alström Syndrom mit Sehstörungen und Störungen des Stoffwechsels und des Hormonsystems miteingeschlossen).
Mit der neuen Studie lassen sich nun alle diese Teile zu einem Ganzen zusammensetzen. Die Forscher haben das MC4R Protein mit Fluoreszenzmarkern gekennzeichnet und erstmals seine Verteilung im Gehirn der Maus untersucht. Dabei stellten sie fest, dass MC4R auf den primären Zilien lokalisiert ist und zwar spezifisch auf den Zilien jener Neuronen, die zur Regulierung des Appetits mit dem übrigen Hirn kommunizieren.
Auch ein weiteres Protein, die sogenannte Adenylat-Cyclase 3 (ADCY3) wurde von den Forschern untersucht. (Adenylat-Cyclase katalysiert die Bildung von zyklischem Adenosinmonophosphat -cAMP- , einem der wichtigsten Botenstoffe zur Signalübertragung innerhalb von Zellen; Anm. Red.) Von diesem Protein war bereits bekannt , dass es spezifisch auf den Zilien von Neuronen lokalisiert ist und auch, dass es mit Adipositas in Verbindung steht. Neue Untersuchungen von Teams aus den US, Pakistan und Grönland - publiziert in derselben Ausgabe von Nature Genetics wie [1] - zeigen nun, dass Mutationen im ACDY3-Gen zu Adipositas und Diabetes führen.
Das Team um Vaisse vermutete nun, dass der Melanocortin-4-Rezezeptor und die Adenylatcyclase ihre Funktion auf den primären Zielien gemeinsam ausüben könnten. Um dies herauszufinden, blockierten sie bei Mäusen die Funktion von ADCY3 auf den Zilien der MC4R exprimierenden Neuronen in spezifischer Weise. Wie angenommen begannen die Tiere mehr zu fressen und an Gewicht zuzunehmen.
Fazit
Die Ergebnisse der neuen Untersuchungen weisen darauf hin, dass die beiden, auf den primären Zilien von Neuronen lokalisierten Proteine MC4R und ADCY3 zusammenwirken , um den "Hunger-Schaltkreis" im Gehirns zu regulieren. Während Mutationen im MC4R Gen für 3 -5 % aller Fälle von schwerer Adipositas verantwortlich sind, gibt es häufigere Mutationen in Dutzenden, wenn nicht Hunderten weiteren Genen, die das Risiko für Adipositas erhöhen. Christian Vaisse hält es für möglich, dass viele dieser Gene auch in den primären Zilien des Gehirns eine Rolle spielen. Sollte dies der Fall sein, so könnte daraus eine wichtige "vereinheitlichte Theorie" der Genetik von Adipositas entstehen.
[1] Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Siljee JE, Wang Y, Bernard AA, Ersoy BA, Zhang S, Marley A, Von Zastrow M, Reiter JF, Vaisse C. Nat Genet. 2018 Jan 8.
* Dieser Artikel von NIH Director Francis Collins, M.D., Ph.D. erschien unter dem Titel:"Unraveling the Biocircuitry of Obesity" zuerst (am 17. Jänner 2018) im NIH Director’s Blog. Der Artikel wurde von der Redaktion aus dem Englischen übersetzt und geringfügig (mit Untertiteln und zwei Kommentaren) für den Blog adaptiert. Abbildung 2 wurde von einem früheren Blogartikel des Autors übernommen (https://directorsblog.nih.gov/2015/05/05/tracing-the-neural-circuitry-of... ) Eine Reihe von Literaturangaben (nicht frei zugänglich) finden sich im Original. Reprinted (and translated by ScienceBlog) with kind permission from the National Institutes of Health (NIH).
Weiterführende Links
National Institutes of Health (NIH) in Bethesda (Maryland)
Obesity (National Institute of Diabetes and Digestive and Kidney Diseases/NIH)
Christian Vaisse (University of California San Francisco)
Reiter Lab (UCSF)
- Printer-friendly version
- Log in to post comments
