Gentherapie der Duchenne-Muskeldystrophie (DMD) - ein Rückschlag
Gentherapie der Duchenne-Muskeldystrophie (DMD) - ein RückschlagFr 17.11.2023 — Ricki Lewis
Tausende Erkrankungen werden durch schadhafte Gene ausgelöst. Bereits vor Jahrzehnten gab es erste Ansätze, um diese Gene durch Gentherapie - reparierte Gene oder intaktes genetisches Material - auszutauschen; man erwartete damit viele der zumeist ererbten Krankheiten nicht nur behandeln, sondern auch wirklich heilen zu können. Obwohl enorme Anstrengungen zur Umsetzung dieser Strategie gemacht und mehrere Tausende klinische Studien dazu durchgeführt wurden, ist der Erfolg bescheiden - von der FDA wurden bislang 6 gentherapeutische Produkte zugelassen - und immer wieder von Rückschlägen bedroht geblieben. Über enttäuschte Hoffnungen und den jüngsten Rückschlag bei einer Gentherapie von Duchenne Muskledystrophie berichtet die Genetikerin Ricki Lewis.*
Im letzten Kapitel meines 2012 erschienenen Buches The Forever Fix: Gene Therapy and the Boy Who Saved It, habe ich prophezeit, dass sich diese Technologie bald weit über die Welt der seltenen Krankheiten hinaus ausbreiten würde. (Anm. Redn.: von einer seltenen Krankheit sind weniger al 0,5 Promille der Bevölkerung betroffen.)
Ich war zu optimistisch. Es hat sich herausgestellt, dass die Gentherapie keinen großen Einfluss auf die Gesundheitsversorgung hatte, da sie nur einigen wenigen Menschen mit seltenen Krankheiten extrem teure Behandlungen offeriert. Wir sind immer noch dabei zu lernen, welche Folgen es haben kann, wenn Millionen von veränderten Viren in einen menschlichen Körper eingeschleust werden. Können sie heilende Gene liefern, ohne eine überschießende Immunreaktion auszulösen?
Ein Bericht im New England Journal of Medicine vom 28. September 2023 beschreibt einen jungen Mann mit Duchenne-Muskeldystrophie (DMD), der nur wenige Tage nach einer Gentherapie starb [1]. Die Einzelheiten erinnern in beunruhigender Weise an den berühmten Fall von Jesse Gelsinger, der im September 1999 an einer überschießenden Immunantwort auf eine experimentelle Gentherapie starb.
Jesse war 19 Jahre alt und litt an einer Defekt im Harnstoffzyklus (Ornithintranscarbamylase-Defizienz). Er wurde an einem Montag behandelt und starb am Freitag infolge eines Multiorganversagens. Die Viren, mit denen die Gene übertragen wurden, hatten ihr Ziel verfehlt und drangen in nicht dafür vorgesehene Zelltypen der Leber ein, was den Alarm der Immunabwehr auslöste.
Es gibt erst wenige Gentherapie-Zulassungen
Auch wenn bereits einige hundert Menschen dem Ende 2017 zugelassenen Luxturna das Sehvermögen verdanken, ist die Liste der Gentherapien, die die Hürden der FDA nehmen konnten, noch kurz geblieben. Zu den enorm hohen Kosten und den kleinen Märkten kommt dazu, dass man die Reaktionen der Patienten nicht vorhersehen konnte. Man braucht ein besseres Verfahren, um Patienten zu identifizieren, die am ehesten auf eine bestimmte Behandlung ansprechen.
Denken wir an Zolgensma, eine Gentherapie, die 2019 zur Behandlung der spinalen Muskelatrophie zugelassen wurde. Betroffene Kinder überleben selten das Säuglingsalter. Deshalb waren die Videos eines kleinen Mädchens namens Evelyn, das nach der Behandlung mit Zolgensma tanzte, so erstaunlich - ihre Schwester war an der Krankheit gestorben. Ein aktuellerer Fall war ein Säugling, der 2021 die 2,25 Millionen Dollar teure einmalige Anwendung von Zolgensma erhielt und im Alter von acht Monaten nur in der Lage war, seinen Kopf für ein paar Sekunden zu heben.
Die FDA hat 6 Gentherapien zugelassen - begraben in einer Liste von 32 zugelassenen Produkten von Zell-und Gentherapien [2]. Gentherapien und Zelltherapien in einen Topf zu werfen, ist nicht sehr hilfreich - bei den zellbasierten Produkten handelt es sich meist um manipulierte T-Zellen zur Behandlung von Krebs. Darunter sind zwei interessante Produkte sind eine Behandlung für Knieschmerzen, die aus Knorpelzellen eines Patienten besteht, die auf Schweinekollagen gezüchtet werden, und 18 Millionen eigene Fibroblasten, die unter die Haut injiziert werden, um "Nasolabialfalten" aufzufüllen.
Die zugelassenen Gentherapien sind bestimmt für:
- die Gerinnungsstörungen Hämophilie A und B
- die schwere Form der Hautablösung, dystrophische Epidermolysis bullosa
- Netzhautblindheit
- Spinale Muskelatrophie
- Duchenne Muskeldystrophie (DMD)
Die Gentherapie zur Behandlung von DMD ist allerdings nur fürJungen im Alter von 4 bis 5 Jahren vorgesehen, die noch gehen können. In der Packungsbeilage des Medikaments, Elevidys, wird vor unerwünschten Nebenwirkungen wie akuten Leberschäden und Entzündungen im Bereich des Herzens und der Muskeln gewarnt. Lungenschäden, die zu dem jüngsten Todesfall geführt haben, werden nicht erwähnt.
Ein riesengroßes Gen einschleusen
Der 27-Jährige Mann mit DMD hatte von seiner Mutter eine Mutation in einem Gen auf dem X-Chromosom geerbt.
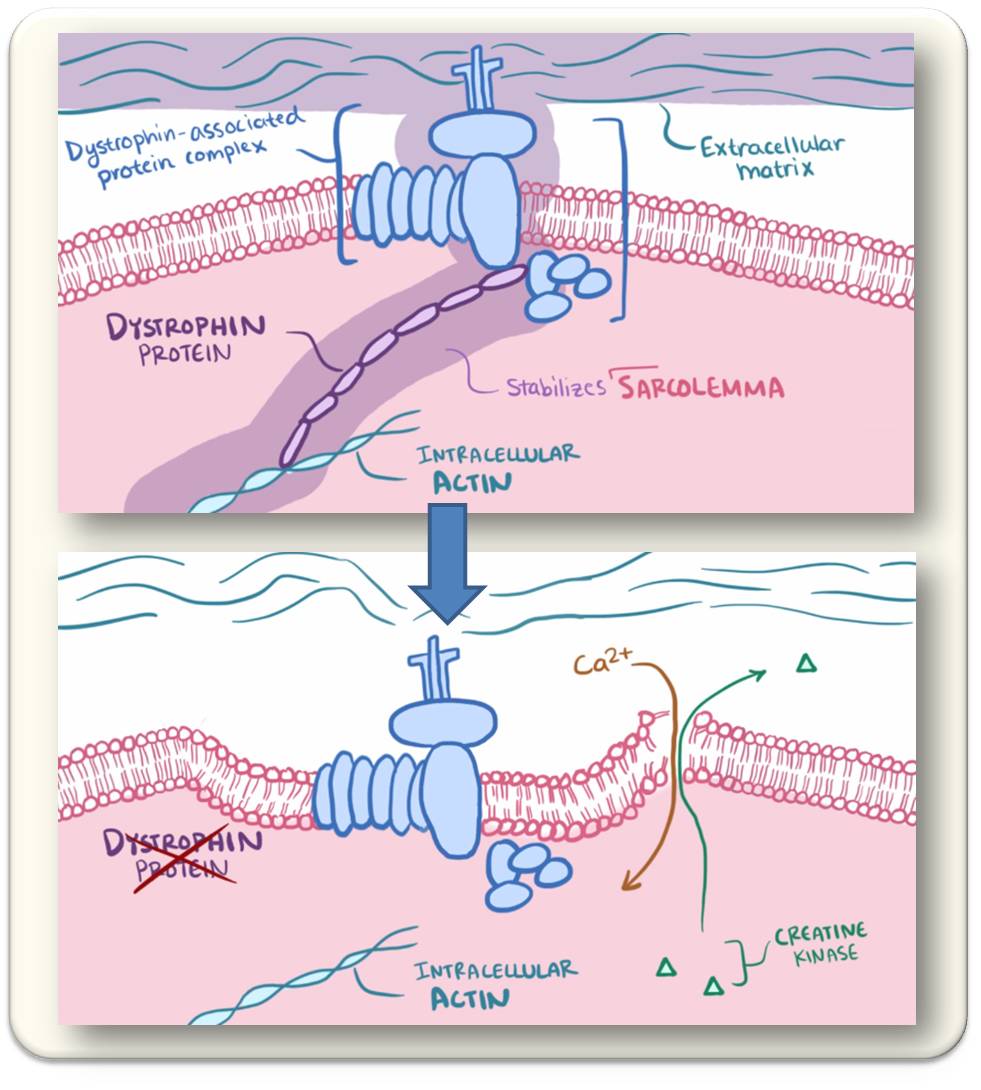
Bei dem betroffenen Gen handelt es sich um das mit 2,2 Millionen DNA-Basen größte im menschlichen Genom. Es kodiert für das Protein Dystrophin, das im Vergleich zu den Aktin- und Myosin-Filamenten, aus denen die Muskelmasse besteht, in verschwindend geringer Menge vorhanden ist, aber als essentielle Stütze fungiert (Abbildung).
| Abbildung. In Muskelzellen ist Dystrophin das Bindeglied zwischen den kontraktilen Actinfasern und der Zellmembran (Sarcolemma), die wiederum über einen Proteinkomplex an das umgebende Bindegewebe (extrazelluläre Matrix) gekoppelt ist (oben). Fehlt Dystrophin, so verliert die Muskelzelle ihre Stabilität, die Membran bekommt Risse, Calcium strömt permanent ein (unten) und dies führt zur Dauerkontraktion.(Bild von Redn. eingefügt: Screenshots aus open.osmosis.org,Duchenne and Beckermuscular dystrophy [3]; Lizenz CC-BY-SA) |
Wird die Fähigkeit, Dystrophin zu bilden zerstört, wie es bei DMD der Fall ist, so fallen Skelett- und Herzmuskelfasern auseinander. Die Muskeln hören zu arbeiten auf. Den betroffenen Personen fehlen Teile des Gens oder das gesamte Gen.
Die DMD-Gentherapie liefert eine verkürzte Version des Dystrophin-Gens, nur 4.558 DNA-Basen. Zwei weitere Design-Strategien sorgen für Präzision:
i) Das Adeno-assoziierte Virus (AAV) ist Vektor für das Gen und nicht das Adenovirus (AV), das in Jesses Leberzellen eingedrungen war, die nicht das Ziel waren. Seit dem tragischen Fall von Jesse ist die Verwendung von AV in der Gentherapie eingeschränkt worden und AAV wird häufiger als Übertragungsvektor verwendet.
ii) Die zweite Veränderung ist wichtiger: Anstatt Kopien eines funktionierenden Gens hinzuzufügen, wie es in der Gentherapie zur Zeit, als ich mein Buch schrieb, der Fall war, ermöglicht nun das CRISPR-Geneditieren, eine Mutation tatsächlich zu korrigieren. Dieser Ansatz wird als maßgeschneiderte CRISPR-Transaktivator-Therapie bezeichnet. Sie heißt "maßgeschneidert", weil sie entwickelt wurde, um eine definierte Mutation zu verändern, mit dem Ziel auf eine ausreichende Anzahl der Millionen von Muskelzellen des Körpers einzuwirken, um die Beweglichkeit zu verbessern - und sei es nur ein bisschen.
Der Ansatz baute auf einer Besonderheit des Patienten auf. Auch wenn seinen Skelettmuskelzellen das riesige Dystrophin-Gen völlig fehlte, hatten bestimmte Gehirnneuronen den Anfang der DNA-Sequenz des Gens (den Promotor und Exon 1) beibehalten. Also designten die Forscher das CRISPR-Werkzeug in der Weise, um die Skelettmuskelzellen des Mannes dazu zu bringen, eine kurze Version des benötigten Proteins zu produzieren, hoffentlich in ausreichender Menge, um etwas Funktion zu gewährleisten. In Zellkulturen und in vivo in Mäusen hatte dies mit menschlichen DMD-Genen funktioniert.
Eine rasche Verschlechterung
Ein Spezialistenteam wählte den Patienten für die maßgeschneiderte klinische Studie aus, da sich sein Zustand rasch verschlechterte und es keine anderen Behandlungsmöglichkeiten mehr gab.
Im Vorfeld des Eingriffs erfolgten zahlreiche Tests. Der Mann hatte weder Antikörper gegen das zu verwendende Virus - AAV9 - noch wies er Anzeichen einer der Virusinfektionen auf, wie sie Transplantatempfänger befallen. Die kardialen Marker waren in Ordnung. Um auf Nummer sicher zu gehen, erhielt er eine immunsuppressive Therapie.
Anscheinend war es aber der Immunreaktion egal, wie gut die heilenden Viren designt waren oder wie viele Vorsichtsmaßnahmen getroffen worden waren.
Der Patient wurde am 4. Oktober 2022 behandelt. Und dann ging alles ganz schnell.
Einen Tag nach der Gentherapie bekam der Patient Extrasystolen. Am zweiten Tag sank die Zahl der Blutplättchen. Am dritten Tag zeigten Biomarker an, dass sein Herz zu versagen begann.
Am 4. Tag sammelte sich Kohlendioxid in seinem Blut an, und am 5. Tag verschlechterte sich seine Herzfunktion, als sich der Herzbeutel mit Flüssigkeit füllte.
Am 6. Tag kam es zum akuten Atemnotsyndrom (ARDS) und zum Herzstillstand. Er starb 2 Tage später. Trotz der Behandlung jeder einzelnen Krise starb er am 8. Tag an Multiorganversagen und Koma. Die Autopsie ergab, dass die Alveolen - die winzigen Luftsäcke in der Lunge - zerstört waren.
Angeborene versus adaptive Immunität: Zwei Stufen der Verteidigung
Wie zuvor Jesse Gelsinger starb auch der Mann mit DMD zu schnell, als dass der Grund dafür die adaptive Immunantwort sein könnte - die dafür maßgebliche Produktion von B- und T-Zellen dauert normalerweise eine Woche oder länger. Somit war die Schuld der unmittelbareren und generalisierten angeborenen Immunreaktion zuzuschreiben.
Eine Immunreaktion ist zweistufig. Zunächst setzt die angeborene Reaktion unspezifisch wirkende antivirale Biochemikalien wie Zytokine (Interferone und Interleukine) und Proteine -das sogenannte Komplement - frei. Tage später produziert die präzisere adaptive Reaktion der B-Zellen spezifische Antikörper gegen Moleküle auf der Oberfläche des Erregers, während die T-Zellen weitere Zytokine freisetzen und direkt angreifen.
Die Schlussfolgerung: Der Patient erlitt eine angeborene Immunreaktion, die auf die hohe Dosis der Gentherapie zurückzuführen war und ein akutes Atemnotsyndrom verursachte. In seinem Blutserum wimmelte es von Zytokinen, die normalerweise kaum nachweisbar sind, während sein Herz ertrank. Ein Zytokin, Interleukin-6, war um sein Herz herum 100-mal so hoch konzentriert wie im Blut. Da sein Herz und seine Lunge angegriffen wurden, hatte er keine Chance mehr.
Die Autopsie ergab, dass sich AAV9 in der Lunge und der Leber konzentrierte, nicht aber in den Muskeln, dem eigentlichen Ziel. Auch gab es keine Antikörper gegen AAV9. Dieses Bild wies darauf hin, dass der Zeitablauf in dem sich der Zustand des Pateinten verschlechterte und schlussendlich letal endete von der angeborenen und nicht von der adaptiven Immunität herrührten.
Die Forscher kamen zu dem Schluss, dass der Mann ein "Zytokin-vermitteltes Kapillarlecksyndrom" erlitt, das am fünften Tag Flüssigkeit in den Herzbereich und in die Lunge schickte und am sechsten Tag ein tödliches ARDS auslöste. "Sowohl die Wirtsfaktoren als auch die inhärenten Eigenschaften des Vektors führten zu unerwartet hohen Konzentrationen von Vektorgenom in der Lunge und könnten zu diesem Ergebnis beigetragen haben", schreiben sie.
Neben dem Trimmen von Genen, einer sorgfältigen Auswahl von viralen Vektoren, massenhaften Tests und sogar dem Einsatz präziserer neuer Instrumente wie CRISPR sind die Eigenschaften des Patienten also nach wie vor von größter Bedeutung. Die Lungen des 27-Jährigen, der an einer Gentherapie seiner Muskeldystrophie starb, waren aus irgendeinem Grund anfällig für eine Infektion durch den viralen Vektor, das normalerweise sichere AAV9.
Vielleicht haben unsere Werkzeuge und Technologien keine Chance gegen die Kräfte der Evolution.
Es ist schwer, eine Milliarde Jahre Evolution in Frage zu stellen
Die überschießende angeborene Immunreaktion, die den Mann mit DMD tötete (und nebenbei für viele COVID-Todesfälle verantwortlich ist), ist der ältere der beiden Zweige der Immunität und geht, auf eine Milliarde Jahre zurück. Wir folgern dies aus dem Umstand, dass sie in allen mehrzelligen Arten - Tieren, Pflanzen und Pilzen - vorkommt. Eine biologische Reaktion, die sich im Laufe der Zeit bewährt hat, hat einen Grund dafür - sie ist vorteilhaft und unterstützt das Überleben.
Und vielleicht ist das eine der Grenzen des Versuchs, mutierte Gene zu ergänzen, zu ersetzen oder zu reparieren. Im Gegensatz dazu ist die adaptive Immunantwort, die Antikörper ausschüttet und Armeen von T-Zellen aussendet, vor weniger als 450 Millionen Jahren entstanden, was sich aus ihrem Vorhandensein nur bei Wirbeltieren ableiten lässt.
Und so ist ironischerweise das Alter der angeborenen Immunantwort vielleicht die größte Hürde, die es zu überwinden gilt, wenn man mit Hilfe der modernen Biotechnologie versucht, unsere Gene therapeutisch zu verändern.
[1] Lek A. et al., Death after High-Dose rAAV9 Gene Therapy in a Patient with Duchenne's Muscular Dystrophy. N Engl J Med. 2023 Sep 28;389(13):1203-1210. • DOI: 10.1056/NEJMoa2307798 ..
[2] FDA: Approved Cellular and Gene Therapy Products. https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products
[3] WebM audio/video file, VP9/Opus, DOI: https://commons.wikimedia.org/wiki/File:Duchenne_and_Becker_muscular_dystrophy.webm. Video: 7:18 min. Lizenz cc-by-sa.
*Der Artikel ist erstmals am 12. Oktober 2023 in PLOS Blogs - DNA Science Blog unter dem Titel "Is Recent Gene Therapy Setback for Duchenne Muscular Dystrophy (DMD) Déjà vu All Over Again?" https://dnascience.plos.org/2023/10/12/is-recent-gene-therapy-setback-for-duchenne-muscular-dystrophy-dmd-deja-vu-all-over-again/ erschienen und steht unter einer cc-by Lizenz . Die Autorin hat sich freundlicherweise mit der Übersetzung ihrer Artikel durch ScienceBlog.at einverstanden erklärt. Der ungekürzte Artikel folgt so genau wie möglich der englischen Fassung. Eine Abbildung wurde von der Redaktion eingefügt.
Artikel über Gentherapie im ScienceBlog
von Ricki Lewis:
- 08.06.2023: Erste topische Gentherapie zur Behandlung der Schmetterlingskrankheit (dystrophe Epidermolysis bullosa) wurde in den USA zugelassen.
- 29.09.2022: Retinitis Pigmentosa: Verbesserung des Sehvermögens durch Gelbwurz, schwarzen Pfeffer und Ingwer.
- 03.10.2019: Gentherapie - ein Update.
von anderen Autoren
- Francis S. Collins, 02.02.2017: Finden und Ersetzen: Genchirurgie mittels CRISPR/Cas9 erscheint ein aussichtsreicher Weg zur Gentherapie.
- Francis SCollins, 27.07.2017: Ein weiterer Meilenstein in der Therapie der Cystischen Fibrose.
- Christina Beck, 23.04.2020: Genom Editierung mit CRISPR-Cas9 - was ist jetzt möglich?
- Redaktion, 08.10.2020: Genom Editierung mittels CRISPR-Cas9 Technologie - Nobelpreis für Chemie 2020 an Emmanuelle Charpentier und Jennifer Doudna.
- Francis S. Collins, 18.03.2021: Faszinierende Aussichten: Therapie von COVID-19 und Influenza mittels der CRISPR/Cas13a- Genschere.