Somatische Mutationen bei Säugetieren skalieren mit deren Lebensdauer
Somatische Mutationen bei Säugetieren skalieren mit deren LebensdauerDo, 26.05.2022 — Redaktion
Es liegt nun die erste Studie vor, in der bei vielen Tierarten die Zahl der während der Lebenszeit erworbenen Mutationen verglichen wurde. Insgesamt 16 Säugetierarten - von der Maus bis zur Giraffe - zeigten trotz großer Unterschiede in Körpergröße und Lebensdauer eine ähnlich hohe Zahl von im Laufe des Lebens erworbenen Mutationen. Diese von Forschern des Wellcome Sanger Institute durchgeführte Studie lässt jahrzehntelange Fragen zur Rolle solcher genetischer Veränderungen im Alterungsprozess und in der Krebsentstehung in einem neuen Licht erscheinen.*
Forscher vom Wellcome Sanger Institute haben herausgefunden, dass verschiedene Tierarten trotz enormer Unterschiede in Lebensspanne und Größe ihr natürliches Leben mit einer ähnlichen Anzahl genetischer Veränderungen beenden. In der kürzlich in Nature veröffentlichten Studie [1] wurden Genome von 16 Säugetierarten - von der Maus bis zur Giraffe - analysiert. Die Autoren belegten darin: je länger die Lebenserwartung einer Spezies ist, desto langsamer ist die Mutationsrate; dies stützt die schon seit langem bestehende Theorie, dass somatische Mutationen eine Rolle bei der Alterung spielen.
Genetische Veränderungen, sogenannte somatische Mutationen, treten über die gesamte Lebenszeit in allen Zellen eines Organismus auf. Dies ist ein natürlicher Prozess; beim Menschen häufen Zellen etwa 20 bis 50 Mutationen pro Jahr an. Die meisten dieser Mutationen sind harmlos, aber einige von ihnen können eine Zelle zur Krebszelle entarten lassen oder auch die normale Funktion der Zelle beeinträchtigen.
Seit den 1950er Jahren haben einige Wissenschaftler darüber spekuliert, dass diese Mutationen eine Rolle im Alterungsprozess spielen könnten. Auf Grund der Schwierigkeit somatische Mutationen in einzelnen Zellen oder kleinen Klonen zu bestimmen, war es allerdings bislang ein Problem diese Möglichkeit zu untersuchen. Technologische Fortschritte der letzten Jahren erlauben nun endlich genetische Veränderungen in normalem Gewebe zu verfolgen; dies lässt hoffen damit die Frage nun zu beantworten.
Eine weitere, seit langem bestehende Frage betrifft das sogenannte Peto-Paradoxon: Da sich Krebserkrankungen aus einzelnen Zellen entwickeln, müssten Spezies mit größeren Körpern (und damit mehr Zellen) theoretisch ein viel höheres Krebsrisiko haben. Tatsächlich ist aber die Krebshäufigkeit bei Tieren unabhängig von deren Körpergröße. Man nimmt an, dass Tierarten mit großen Körpern bessere Mechanismen zur Krebsprävention entwickelt haben. Ob einer dieser Mechanismen darauf beruht, dass sich weniger genetische Veränderungen in ihrem Gewebe anhäufen, wurde bislang nicht untersucht.
Die Wellcome Sanger Studie
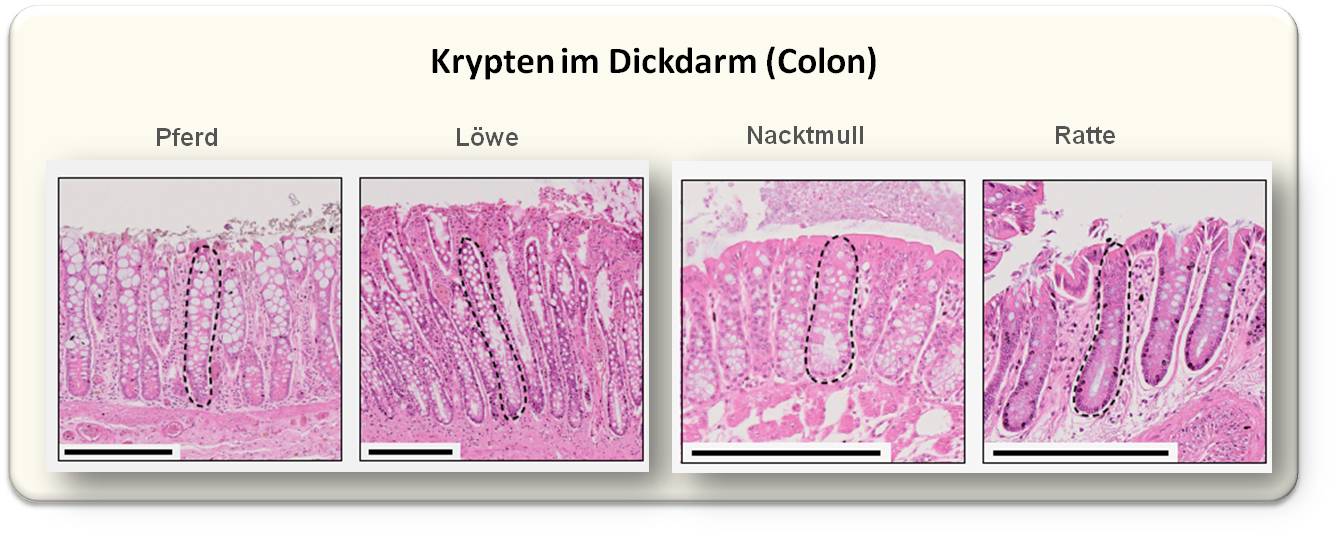
| Abbildung 1. Histologische Bilder von Dickdarmproben mehrerer Tierspezies wobei jeweils ein Krypte strichliert umrandet ist. Der durch den schwarzen Strich angezeigte Maßstab ist 0,25 mm. (Bild stammt aus aus A. Cagan et al., 2022 [1]; Lizenz cc-by. und wurde von der Redn. eingefügt.) |
In der neuen Studie haben Forscher des Wellcome Sanger Institute diese Theorien untersucht; sie haben neue Methoden angewandt, um die somatische Mutation bei 16 Säugetierarten zu messen, die ein breites Spektrum an Lebenserwartung und Körpergröße abdecken. (Im Detail waren dies: Schwarz-weißer Stummelaffe, Katze, Kuh, Hund, Frettchen, Giraffe, Schweinswal, Pferd, Mensch, Löwe, Maus, Nacktmull, Kaninchen, Ratte, Ringelschwanzlemur und Tiger.) Erwähnt werden soll hier auch der langlebige, sehr krebsresistente Nacktmull.
Die Gewebeproben - Krypten aus dem Dickdarmbereich (Kolon) - wurden von mehreren Organisationen, u.a. der Zoological Society of London zur Verfügung gestellt. Krypten sind anatomische Strukturen im Epithel des Dickdarms (und auch des Dünndarms). Da alle Zellen einer Krypte sich von einer einzigen Stammzelle herleiten, sind sie ideal für die Untersuchung von Mutationsmustern und Mutationsraten geeignet. Wie diese Krypten aussehen, ist in Abbildung 1 für mehrere Spezies gezeigt.
Mit zunehmendem Alter einer Spezies steigen die Mutationen linear an
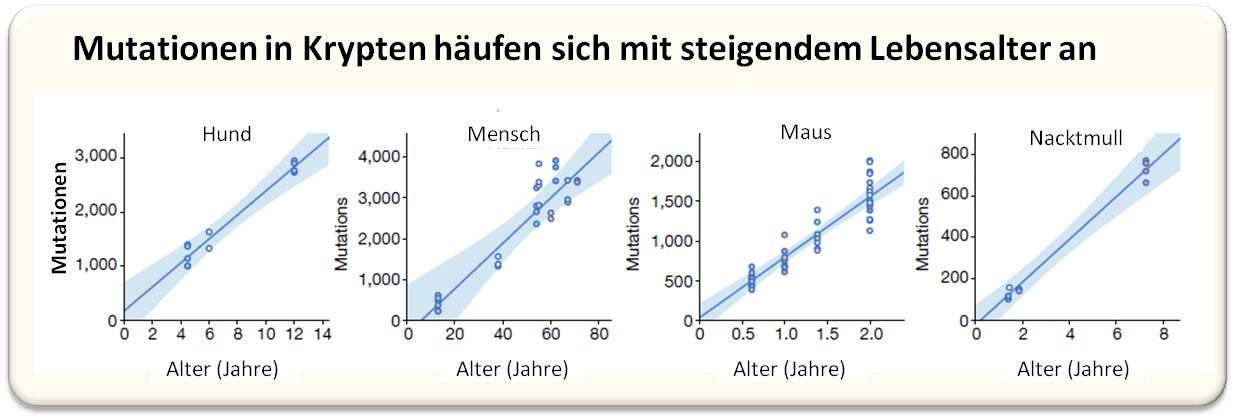
| Abbildung 2. Mutationen in den Krypten-Zellen steigen linear mit dem Lebensalter an. Am Lebensende weisen die einzelnen Spezies eine ähnliche Anzahl von Mutationen in ihren Genomen auf. Beispiele von 4 Säugetierspezies.(Bild stammt aus aus A. Cagan et al., 2022 [1]; Lizenz cc-by. und wurde von der Redn. eingefügt.) |
Um die Mutationsraten in einzelnen Darmstammzellen zu messen, wurden Gesamtgenom-Sequenzen aus 208 solcher Darmkrypten von insgesamt 48 Individuen analysiert. Die Analyse der Mutationsmuster (Mutationssignaturen - charakteristische Muster an Mutationen) lieferte Informationen über die ablaufenden Prozesse. Die Forscher fanden heraus, dass sich somatische Mutationen im Laufe der Zeit linear anhäufen (Abbildung 2.) und dass diese bei allen Spezies, einschließlich des Menschen - trotz sehr unterschiedlicher Ernährungsweisen und Lebensabläufen- durch ähnliche Mechanismen verursacht werden.
Mit steigender Lebenserwartung sinken die Mutationsraten
Einen Hinweis auf eine mögliche Rolle somatischer Mutationen im Alterungsprozess lieferte die Entdeckung der Forscher, dass die Rate somatischer Mutationen mit zunehmender Lebenserwartung der Spezies abnahm. Abbildung 3.
| "Es war überraschend, ein ähnliches Muster genetischer Veränderungen bei so unterschiedlichen Tieren wie einer Maus und einem Tiger zu finden. Der interessanteste Aspekt der Studie ist jedoch die Feststellung, dass die Lebensspanne umgekehrt proportional zur somatischen Mutationsrate ist. Dies deutet darauf hin, dass somatische Mutationen eine Rolle bei der Alterung spielen, obgleich auch andere Erklärungen denkbar sind. In den nächsten Jahren wird es spannend werden, diese Studien auf noch diversere Arten, wie Insekten oder Pflanzen, auszuweiten." sagt der Erstautor der Studie Dr Alex Cagan vom Wellcome Sanger Institute |
| Abbildung 3. Somatische Mutationen in den Krypten des Dickdarms von 16 Spezies, die sich in ihrer Größe bis um das 39 000-Fache, in ihrer Lebensdauer bis um das 30-Fache und in ihrer jährlichen Mutationsrate um bis das 17-Fache unterscheiden. Die zum Lebensende angehäuften Mutationen differieren aber nur um das 3-Fache! (Bild stammt aus aus A. Cagan et al., 2022 [1]; Lizenz cc-by. und wurde von der Redn. eingefügt.) |
Die Suche nach einer Antwort auf Petos Paradoxon geht jedoch weiter. Nach Berücksichtigung der Lebensspanne fanden die Autoren keinen signifikanten Zusammenhang zwischen der somatischen Mutationsrate und der Körpermasse, was darauf hindeutet, dass andere Faktoren an der Fähigkeit größerer Tiere beteiligt sein müssen, ihr Krebsrisiko im Verhältnis zu ihrer Größe zu verringern.
| "Die Tatsache, dass die Unterschiede in der somatischen Mutationsrate offenbar durch Unterschiede in der Lebensspanne und nicht durch die Körpergröße erklärt werden können, deutet darauf hin, dass die Anpassung der Mutationsrate zwar nach einer eleganten Methode zur Kontrolle des Auftretens von Krebs bei verschiedenen Arten klingt, die Evolution diesen Weg aber nicht wirklich gewählt hat. Es ist durchaus möglich, dass die Evolution jedes Mal, wenn sich eine Art größer entwickelt als ihre Vorfahren - wie bei Giraffen, Elefanten und Walen - eine andere Lösung für dieses Problem findet. Um das herauszufinden, müssen wir diese Arten noch genauer untersuchen", sagt Dr. Adrian Baez-Ortega, Koautor der Studie [1] (Wellcome Sanger Institute) |
Trotz der großen Unterschiede in Bezug auf Lebensdauer und Körpermasse zwischen den 16 untersuchten Arten war die Anzahl der somatischen Mutationen, die im Laufe des Lebens der einzelnen Tiere erworben wurden, relativ ähnlich. Eine Giraffe ist im Durchschnitt 40 000-mal größer als eine Maus, und ein Mensch lebt 30-mal länger, aber der Unterschied in der Anzahl der somatischen Mutationen pro Zelle am Ende der Lebensspanne zwischen den drei Arten betrug nur etwa den Faktor drei (Abbildung 3).
Die genauen Ursachen des Alterns sind nach wie vor eine ungelöste Frage und ein Bereich, in dem aktiv geforscht wird. Das Altern wird wahrscheinlich durch die Anhäufung verschiedener Arten von Schäden an unseren Zellen und Geweben im Laufe des Lebens verursacht, unter anderem durch somatische Mutationen, Proteinaggregation und epigenetische Veränderungen. Ein Vergleich der Raten dieser Prozesse bei verschiedenen Arten mit sehr unterschiedlicher Lebensdauer kann Aufschluss über ihre Rolle bei der Alterung geben.
|
"Die Alterung ist ein komplexer Prozess, der auf vielfältige Formen molekularer Schädigungen in unseren Zellen und Geweben zurückzuführen ist. Seit den 1950er Jahren wird vermutet, dass somatische Mutationen zur Alterung beitragen, doch deren Erforschung blieb schwierig. Mit den jüngsten Fortschritten in der DNA-Sequenzierungstechnologie können wir nun endlich die Rolle untersuchen, die somatische Mutationen beim Altern und bei verschiedenen Krankheiten spielen. Dass diese verschiedenen Säugetiere ihr Leben mit einer ähnlichen Anzahl von Mutationen in ihren Zellen beenden, ist eine aufregende und faszinierende Entdeckung", sagt Dr. Inigo Martincorena . korrespondierender Autor( [1] Wellcome Sanger Institute.. |
*Der vorliegende Artikel basiert auf einem News Article des Wellcome Trust Sanger Institute vom 13.April 2022: Mutations across animal kingdom shed new light on ageing. https://www.sanger.ac.uk/news_item/mutations-across-animal-kingdom-shed-new-light-on-ageing/. Dieser Artikel wurde weitestgehend wörtlich übersetzt und durch 3 Abbildungen aus der zugrundeliegenden Publikation ergänzt:
[1] Alex Cagan, Adrian Baez-Ortega et al. (2022). Somatic mutation rates scale with lifespan across mammals. Nature. DOI: https://doi.org/10.1038/s41586-022-04618-z
Die Inhalte der Website des Sanger Instituts und auch [1] stehen unter einer cc-by 3.0 Lizenz.